比较3种方法制备的农杆菌侵染玉米自交系‘B 104’幼胚的效率
2022-05-18冯鑫磊李结平
冯鑫磊 李结平
(河南大学 生命科学学院/省部共建作物逆境适应与改良国家重点实验室/棉花生物学国家重点实验室,河南 开封 475004)
玉米是重要的农作物和基础研究的模式植物,具有丰富的遗传多样性。高效的玉米遗传转化体系可用于培育农艺性状更优的玉米品种,2019年全球已经商业种植转基因玉米约6 090万hm2[1]。遗传转化是创制研究材料,支撑分子生物学基础研究的重要技术手段。
最早的玉米转化采用电转原生质体,但是没有获得可育的植株[2],后来研究人员开发了一系列的方法,如对玉米幼胚或者悬浮细胞进行基因枪轰击等,获得了可育的玉米转化植株[3-4]。但是这类利用压力轰击的物理方法会增加外源基因的拷贝数,出现目的基因片段断裂等不可控问题[5]。农杆菌介导转化具有稳定遗传和插入片段拷贝数低等优点,它被广泛应用于作物农艺性状改良和植物基础研究。1996年首次成功实现了农杆菌介导的玉米遗传转化[6],此后流程中的各种关键因子,如载体、菌株、组织培养基、外植体和愈伤培养条件一直在优化,玉米遗传转化效率在不断的提高[7-8]。但是作为模式植物,玉米的遗传转化效率偏低,制约了玉米功能基因的基础研究和分子育种的发展。
以自交系为受体减少了杂交种(‘HiII’材料)为受体的背景纯合过程,有利于基因功能研究。玉米公共自交系‘B 104’是经典转化受体材料,它由Iowa Stiff Stalk Synthetic(BSSS)群体,BS13(S)C5选育出来,与玉米研究中广泛应用的自交系‘B 73’具有60%的遗传相似性[9]。因其自身农艺性状特点和较强的再生能力,国际玉米研究机构如爱荷华州立大学植物转化中心及多家国内玉米转化服务公司均选择将其作为玉米转化的受体材料。
瞬时转化效率与遗传转化阳性效率呈现高度的正相关关系,使用活力强的农杆菌侵染适宜的幼胚是农杆菌介导转化成功最关键的步骤之一。农杆菌的制备方法影响农杆菌活性,但是针对玉米转化,当前制备农杆菌一般采用LB培养基或者YEP培养基,比较单一。AB微量矿质培养基应用于玉米的遗传转化仅有少量报道[10],而在受体‘B 104’上的应用未见报道,农杆菌培养方法对侵染效率影响的研究也鲜见报道。本研究分别选用YEP培养基与AB微量矿质培养基对玉米自交系‘B 104’幼胚进行侵染,分析不同方法制备的农杆菌侵染效率,旨在探究提高农杆菌侵染效率的最优制备方法,以期为提高玉米幼胚瞬时转化效率提供参考。
1 材料与方法
1.1 主要培养基的制备
AB液体培养基:20 g/L葡萄糖(Glucose),19.52 g/L 2-(N-吗啡吡啉)乙磺酸(MES),1 g/L氯化氨(NH4Cl),0.3 g/L七水硫酸镁(MgSO4·7H2O),0.002 5 g/L七水硫酸亚铁(FeSO4·7H2O),150 mg/L氯化钾(KCl,母液浓度150 mg/mL),10 mg/L氯化钙(CaCl2,母液浓度10 mg/mL),1 mL/L磷酸二氢钠(NaH2PO4,母液浓度0.5 mol/L),使用KOH调节pH至5.4,高压湿热灭菌115 ℃,15 min。使用时,每升培养基加入2 mL乙酰丁香酮(AS,母液100 mmol/L),1 mL利福平(Rifampicin,母液浓度25 mg/mL),1 mL卡那霉素(Kanamycin sulfate,母液浓度50 mg/mL)[11]。YEP液体,固体培养基及其他培养基,如侵染培养基,共培养培养基,选择培养基参考Raji等[12]。采用YEP固体平板划单克隆的方式活化菌株。
1.2 3种不同的农杆菌制备方法
采用农杆菌EHA 105和植物双元表达载体pCAMBIA 3301为侵染菌株和表达载体,挑取EHA 105-pCAMBIA 3301母板上的单克隆菌落,加至5 mL含有卡那霉素(kan)和利福平(rif)的YEP液体培养基中,28 ℃,180 r/min,摇菌。12 h后,分别采用3种不同方法处理:
YEP液体培养基制菌:取其中1 mL菌液加入新制备的10 mL含有抗生素(kan和rif)的YEP液体培养基中,28 ℃,180 r/min,摇菌12 h后,25 ℃,3 500 r/min,离心10 min收集菌落。
YEP固体培养基制菌:使用接菌环取活化的菌液在含有抗生素(kan和rif)的YEP平板上划S形的条纹。倒置放置于28 ℃生化培养箱,黑暗培养12 h,用接菌环刮取菌落。
AB液体培养基制菌:25 ℃,3 500 r/min,离心10 min收集菌体,使用10 mL含有kan、rif和乙酰基丁香酮(AS)的AB液体培养基重悬菌落,调节菌液浓度,使得OD550=0.1,28 ℃,180 r/min,摇菌12 h后,25 ℃,3 500 r/min,离心10 min收集菌落。
菌体收集后,使用含有AS的侵染培养基重悬菌液,紫外分光光度计调节菌液浓度,使得OD550=0.3。
1.3 农杆菌侵染玉米幼胚程序
将制备好含菌的侵染液放置于室温摇床上,100 r/min,30 min。取授粉后12 d的玉米雌穗,挑取长度约2 mm的幼胚放入制备好的含菌侵染液中,剥取过程约30 min。上下轻柔颠倒含有幼胚和菌液的2 mL离心管20次,静止放置5 min,吸除多余菌液,将侵染后的幼胚转移至共培养培养基,24 ℃黑暗培养3 d。每种制备方法侵染3次,每次3个重复。
1.4 GUS染色
根据Jefferson RA方法对共培养3 d的幼胚进行GUS染色[12],将幼胚放入GUS染液中,37 ℃暗培养12 h处理后转移至体视镜观察染色结果,统计蓝色斑点的幼胚和染色面积占幼胚面积30%~50%的幼胚数量[7]。
1.5 转移幼胚至筛选培养基
共培养3 d后,将幼胚转移至筛选培养基(含有‘草铵膦’),保持幼胚盾片面朝上,每皿约30个幼胚,于28 ℃黑暗条件下继续培养。10 d后统计胚性愈伤的形成数量及比例。
1.6 阳性转化率
分别使用YEP液体和AB液体培养基制备含有不同载体的农杆菌进行幼胚侵染,其中用YEP液体培养基分别制备含有8个不同基因载体的农杆菌EHA 105,用AB液体培养基分别制备含有18个不同基因载体的农杆菌EHA 105,用于每个载体侵染的幼胚数为400~800个,分析比较2种方法阳性转化率。
1.7 数据分析
运用spss16.0软件对试验数据进行独立样本Student’s t-test和ANOVA分析,采用Duncan多组样本间差异显著性分析(P=0.05)。
2 结果与分析
2.1 GUS染色差异
由图1可知,YEP液体培养基制菌侵染后出现蓝色斑点的幼胚数量占总体幼胚数量比率为60%,YEP固体培养基制菌成功瞬时侵染比率为42%,AB液体培养基制菌侵染后所有幼胚都含有蓝色的斑点,瞬时侵染比率为100%,幼胚GUS染色颜色加深(图1(c))。
由图2可知,YEP液体培养基侵染产生的符合高效转化的侵染幼胚(面积达到30%~50%)占幼胚总数量比率为10%,YEP固体培养基制菌侵染后,没有出现此种幼胚,单次处理30个幼胚中有1~2个幼胚蓝色面积占比达到10%。AB液体培养基处理高效转化幼胚数量占比约为40%(图2(b))。结果表明,AB液体培养基制菌瞬时转化效率最高,出现GUS染色幼胚比率和浸染面积≥30%幼胚比率均显著高于YEP液体和YEP固体培养基。因此,针对玉米自交系‘B 104’,3种培养基制备的EHA 105-pCAMBIA 3301介导瞬时转化效率由高到低为:AB液体培养基>YEP液体培养基>YEP固体培养基。
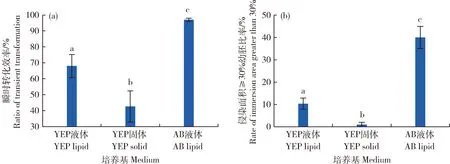
不同小写字母表示不同方法之间差异显著(P<0.05)。Different letters represent significant difference among methods (P<0.05).图2 3种方法制备农杆菌侵染幼胚瞬时转化效率(a)和侵染面积≥30%幼胚比率(b)的差异Fig.2 Differences in the transient transformation efficiency (a) and rate of immersion area greater than 30% (b) of immature embryos infected by three methods prepared Agrobacterium
2.2 胚性愈伤差异
由图3可知,经过诱导生长,与YEP液体和AB液体培养基相比,YEP固体培养基(图3(b))诱导的愈伤形状较小。而YEP液体和AB液体培养基制备的处理组,瞬时侵染率高,幼胚受到侵染的细胞显著多于YEP固体培养基(图1(a)和(c)),在选择培养基上,愈伤诱导产生较大的抗性愈伤,此结果也与之前GUS染色指示瞬时表达效率的结果一致(图1)。

白色箭头指示胚性愈伤White arrows indicate embryogenic calluses图3 YEP液体(a),YEP固体(b)和AB液体(c)培养基制备农杆菌侵染幼胚的胚性愈伤Fig.3 Embryogenic callus induced from immature embryo infected with preparation methods of Agrobacterium by YEP liquid (a), YEP solid (b) and AB liquid medium (c)
由图4可知,经过10 d的筛选处理,不同制备方法侵染幼胚后经过筛选培养基诱导产生的胚性愈伤比例差异显著,其中YEP液体培养基制菌处理的愈伤诱导率为27%,YEP固体培养基制菌处理方式为13%,AB液体培养基制菌方式愈伤诱导率最高,达到49%。3种培养基制备农杆菌的幼胚诱导胚性愈伤的比率由高到低为:AB液体培养基>YEP液体培养基>YEP固体培养基,差异达到显著性水平。这一结果与GUS染色结果表征的瞬时转化效率结果相符(图2)。

图4 3种方法制菌侵染幼胚胚性愈伤诱导率差异Fig.4 The induction rate of embryogenic calluses in immature embryos infected by three different methods prepared Agrobacterium
2.3 阳性转化率差异
如图5所示,YEP液体培养基方法的阳性转化率平均为2.74%,AB液体培养基的阳性转化率平均为5.46%,显著高于YEP液体培养基制备方法(P<0.05),表明AB液体培养基在大量转化操作时可显著提高转化效率,在瞬时侵染时提高了侵染效率和转化阳性率。

*表示不同方法之间差异显著(P<0.05)。* Represent significant difference among methods (P<0.05).图5 YEP液体和AB液体培养基方法阳性转化率比较Fig.5 The difference of positive transformation between YEP liquid and AB liquid medium methods prepared Agrobacterium
3 讨 论
为增加农杆菌的侵染能力,重组蛋白工业生产领域已有对农杆菌制备方法的优化研究[13]。AB培养基是一种以简单碳水化合物为糖源,包含少量矿质元素的最简培养基(Minimal Media),最早见于农杆菌生长的放射性标记研究[15],更多地应用于工业领域农杆菌的培养,如农杆菌介导烟草瞬时转化表达具有药用价值的植物蛋白[9]。
YEP固体培养基广泛应用于多种植物的遗传转化,如拟南芥[16],中国白菜(Brassicarapassp. Pekinensis)[16]等。以YEP或者LB固体培养基划线生长菌落的方法广泛应用于玉米的遗传转化,在不同的报道中转化效率差异很大[6-7,17-19]。但是在本研究中,YEP固体培养基制备的农杆菌侵染未产生面积比例超过30%的幼胚,因为划线的菌株经过摇菌活化,28 ℃黑暗培养12 h后,在平板表面堆积了大量的菌落,可能造成底层的菌落生长时间过长而死亡,仅顶端存在新生长的菌落具有侵染活性,重悬于侵染培养基后包含了死亡菌落,影响了瞬时转化效率。农杆菌的活化通常在YEP液体培养基中进行。YEP液体培养基可以应用于玉米[20],大豆[21]和烟草[22]等遗传转化。
含有不同外源基因质粒的农杆菌在YEP培养基中的生长速度不相同,加之甘油管保存菌液浓度的差异,致使固定时间内保持相同菌液浓度比较困难,本研究中采用相同的制备程序,先使用YEP液体培养基活化保存于甘油管中的菌株,然后分别使用YEP液体和AB液体培养基进行扩摇。在YEP液体培养基中,菌株生长速度很快,短时间内菌落大量积累,菌落生长环境恶化,产生死亡菌体,可能是本研究中出现侵染面积≥30%幼胚较少的原因。在AB液体培养基的处理组中,菌株生长缓慢[15],菌株的活性保持好,侵染时菌株处于指数生长期,避免了最初菌液浓度差异的影响。相对于YEP液体制菌处理,AB培养基制备的农杆菌侵染玉米幼胚GUS染色的颜色更深,可能侵染深层细胞,增加了侵染细胞的数量,进而保证了筛选培养过程中更高的胚性愈伤比率,应进一步对显色后的幼胚进行切片观察验证。在使用大量幼胚,多种载体进行遗传转化时,使用AB液体培养基侵染方法显著提高了阳性转化率。当前普遍采用的玉米转化技术体系要求转化受体为大小合适的幼胚,侵染的最佳时期只有1~2 d,所以对菌液的活性和操作的稳定性要求很高,与双子叶植物(如烟草和拟南芥等)有很大的差别。本研究的结果表明,针对玉米自交系‘B 104’的幼胚,AB液体培养基制备农杆菌侵染效率更高。
对AB培养基的优化研究结果已经应用于AB培养基的改良,如采用阿拉伯糖(arabinose)或者葡萄糖(glucose)作为碳源,可以提高外源蛋白表达水平[23];酸性的环境(pH 5.4)可以增加VIR基因的表达,培养基的配方中加入19.52 g/L MES稳定pH,减少酸性环境对农杆菌生长的不利影响[24];在共培养培养基加入AB培养基能显著增加农杆菌对拟南芥幼苗的瞬时侵染效率,培养基pH 5.5对侵染效率有显著提升作用[24],可以应用于玉米转化,提高瞬时转化效率。根据本实验室的经验,制备AB培养基过程中需要严格试剂的用量,避免产生微小沉淀,致使菌落成团生长,试验条件允许的情况下,宜采用过滤灭菌的方式,避免沉淀的产生。本试验结果表明相对于传统的YEP培养基,AB液体培养基制备的方法能显著提高农杆菌对玉米‘B 104’幼胚的瞬时侵染效率和抗性胚性愈伤的比率,可以应用于玉米自交系‘B 104’遗传转化的工艺改良,最终提高玉米遗传转化阳性率。未来也可以应用于其他的玉米受体材料,如‘H 99’,‘综31’和‘A 188’等,从而满足玉米育种和基础研究中创制材料的需求。
4 结 论
本研究结果表明,AB液体培养基制备的农杆菌侵染玉米自交系‘B 104’幼胚的侵染率达到100%,染色面积≥30%的幼胚占比为40%,均显著高于YEP固体和液体培养基制备的农杆菌,AB液体培养基制菌侵染的幼胚在选择培养基上产生的胚性愈伤的比率为49%,显著高于YEP固体和液体培养基制备的农杆菌(P<0.05),AB液体培养基制备的农杆菌侵染幼胚的转化苗阳性转化率显著高于YEP液体培养基。因此,使用AB液体培养基制备农杆菌可以有效地提高对玉米自交系‘B 104’幼胚的瞬时侵染率,获得更多的胚性愈伤。