山羊KLF16对肌内前体脂肪细胞分化的影响
2022-05-18王佳美俄木曲者李艳艳朱江江林亚秋
李 鑫 张 浩 王佳美 王 永 俄木曲者 李艳艳 朱江江 林亚秋*
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041;2.西南民族大学 畜牧兽医学院,成都 610041;3.四川省畜牧科学研究院 动物遗传育种重点实验室,成都 610066)
山羊脂肪组织按沉积部位的不同可以分为皮下脂肪组织(SAT)、肌内脂肪(IMF)和内脏脂肪组织(VAT)等,其中肌内脂肪(IMF)含量影响山羊肉质,主要包括风味和多汁性[1-2]。IMF的沉积是前体脂肪细胞不断聚脂,分化为成熟脂肪细胞的过程[3]。因此通过探索肌内脂肪细胞分化机制来分析脂肪沉积的调控机理对山羊乃至经济畜种肉质改良具有重大意义。
已有研究证明,CCAAT/增强子结合蛋白β(C/EBPβ)调控过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT/增强子结合蛋白α(C/EBPα),从而激活成脂分化进程[4],然而脂肪细胞分化是一个复杂生物学进程,同时受诸如类维生素X受体Alpha(RXRα)和Krüppel样转录因子家族(Krüppel-like factors,KLFs)等多种基因和转录因子共同调控,它们是脂肪细胞分化进程中不可或缺的重要调控因子[5-8]。其中,KLFs共计18位成员,广泛分布于哺乳动物细胞内,通过由3个连续的C2H2型锌指构成的锌指结构域结合DNA中的GC-rich区,以直接与靶基因结合或与其他辅助调节因子组合成调节复合物的方式,广泛参与到真核细胞基因转录水平的表达调控[9-11]。
研究显示,KLFs家族成员在脂肪细胞分化过程中扮演重要角色,且对脂肪细胞分化调控作用具有物种特异性,如KLF13促进猪前体脂肪细胞的分化,但对小鼠前脂肪细胞分化无影响[12];实验室前期研究发现KLF3和KLF10促进山羊肌内和皮下前体脂肪细胞分化[13-14],但却是小鼠脂肪生成的负调控因子[15-16];以上研究提示KLF家族基因在脂肪细胞分化方面的调控作用具有物种差异性。KLF16自2002年被发现以来[17],对其研究多集中在胰腺癌细胞转化[18]、神经细胞生长及突触形成、内分泌系统稳态[19]、子宫内膜生理和代谢[20]及多巴胺信号的传导[21]等方面,表明KLF16在多种生物学过程中具有重要调控作用。而KLF16在脂肪方面的研究直至2016年才被报道,即Jang等[22]研究发现干扰KLF16基因表达可以刺激小鼠棕色和白色前体脂肪细胞分化,而过表达KLF16会以浓度依赖性方式降低PPARγ启动子活性,从而抑制脂肪生成,提示KLF16对脂肪细胞分化具有调控作用,且尚未见除小鼠外其他物种的KLF16基因在脂肪细胞分化方面的作用。此前本实验室利用高通量测序发现KLF16为山羊肌内脂肪细胞分化前后的差异调控基因,但其具体的调控作用机制尚不清楚,该基因目前仅猪中存在克隆序列[23],牛和绵羊仅见预测序列,山羊KLF16基因序列与现有研究是否存在差异,是否导致不同的基因功能,需要深入研究。且基于上述KLFs成员对不同物种脂肪细胞分化调控作用的物种特异性,不能仅以小鼠中的报道为参考,需要以体外培养的山羊肌内前体脂肪细胞为研究对象进行功能研究。
因此本研究首先利用RT-PCR技术克隆山羊KLF16基因序列,然后利用荧光定量PCR(Quantitative real-time PCR,qPCR)检测该基因在山羊不同组织及不同诱导分化阶段肌内脂肪细胞中的表达模式,构建其组织及细胞时序表达谱,利用过表达及生物信息学预测等手段明确KLF16基因对山羊肌内前体脂肪细胞分化的影响及可能的作用机制,为最终阐明KLF16对山羊前体脂肪细胞分化的调控机制及经济畜种的肉质改良提供基础数据及参考。
1 材料与方法
1.1 试验材料
1.1.1试验样品的采集
选择四川省简阳市大哥大牧业有限公司种羊场健康的6~8月龄(育成羊)简州大耳羊公羊作为研究对象(n=4)。晨间屠宰后迅速采集其心、肝、脾、肺、肾、背最长肌、股二头肌、臂三头肌、背部皮下脂肪和腹部皮下脂肪组织,用DEPC水清洗除去血渍后立即用锡箔纸包裹好分装入冻存管中,置入液氮中冻存并带回实验室进行后续实验。原代肌内脂肪细胞由实验室前期分离保存[24]。
1.1.2主要材料
山羊肌内前体脂肪细胞(本实验室保存);Trizol、PMD-19T载体和SYBR®Premix Ex Taq TM(2×)购自TaKaRa;DNA纯化试剂盒和2×GC-rich PCR Master Mix购自TIANGEN;TreliefTM5α购自北京擎科生物科技有限公司,胎牛血清、双抗和胰酶购自Gibco;DEME/F12培养基购自Hyclone;油酸购自Sigma;反转录试剂盒购自Thermo Fisher;过表达腺病毒载体HBAD-KLF16-EGFP和对照腺病毒载体HBAD-EGFP的构建及过表达山羊KLF16的重组腺病毒和对照重组腺病毒的包装均由汉恒生物科技(上海)有限公司完成。
1.2 试验方法
1.2.1山羊KLF16基因克隆及生物信息学分析
取保存于液氮中的山羊组织样品约0.2 g,用Trizol法提取组织样品中的总RNA,经过IMPLEN NanoPhotometer®N60 超微量分光光度计测定RNA样品质量浓度,A260/280和 A260/230的值均>2.0,取1 μg的total RNA用反转录试剂盒将RNA反转录为cDNA。根据NCBI上绵羊KLF16基因预测序列(XM_012116067.1),使用Primer Premier 5.0软件设计克隆引物(表1)。共25 μL的反应体系(山羊背最长肌cDNA 2 μL、2×GC-rich PCR Master Mix 12.5 μL、上下游引物各1 μL、ddH2O 8.5 μL)按照94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸50 s,共38个循环。用1%琼脂糖凝胶电泳检测并回收产物,用PMD-19T 载体连接并转化至TreliefTM5α感受态细胞,37 ℃恒温培养12 h后挑菌,扩大培养的菌液用PCR鉴定,将符合目的条带大小的样品送至北京擎科生物技术有限公司成都分公司测序。

表1 克隆和荧光定量PCR引物信息Table 1 Information of primers for cloning and quantitative real-time PCR
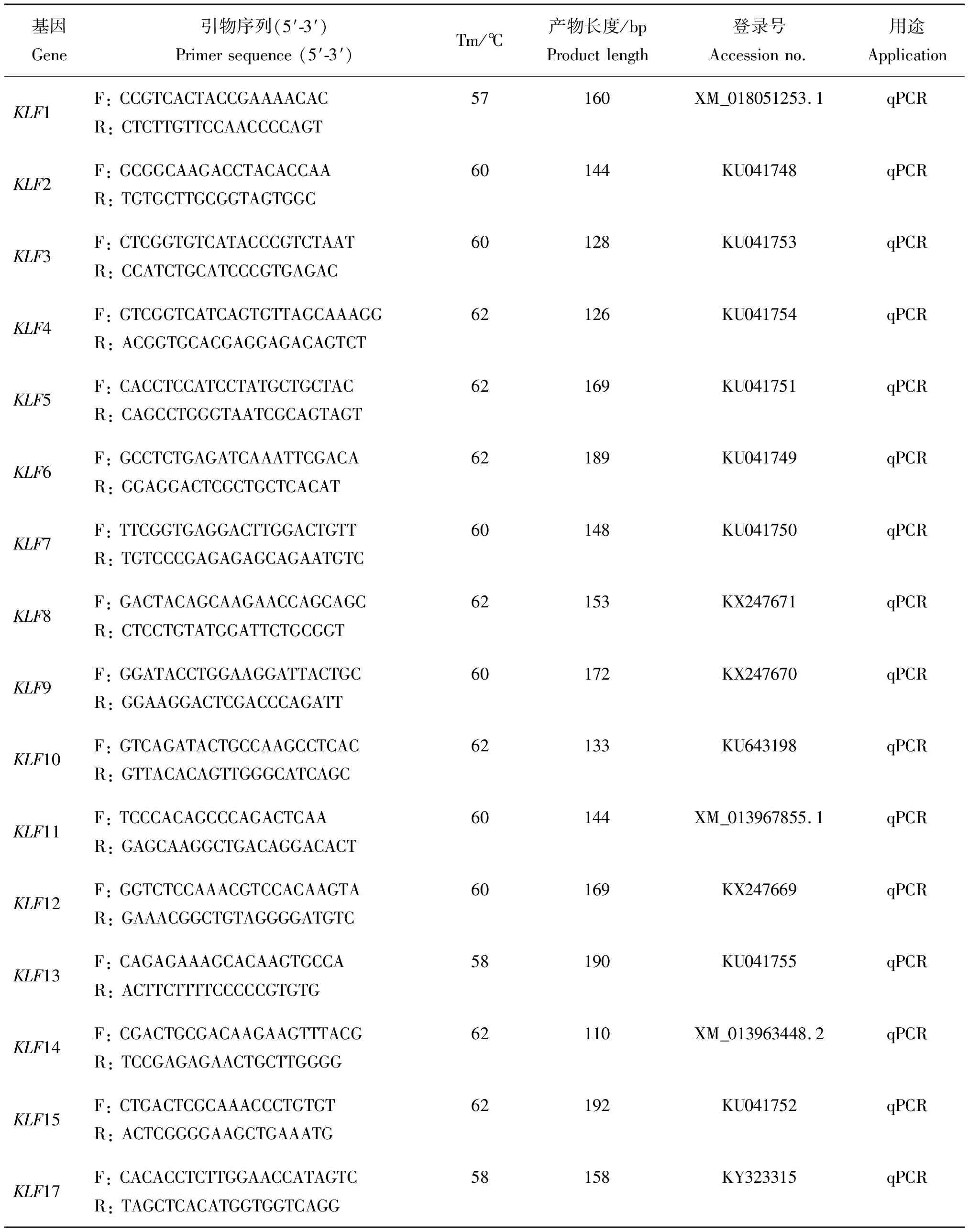
表1(续)
对测序获得的序列进行生物信息学分析,分析内容及对应的工具如表2。

表2 山羊KLF16序列分析内容及相应分析工具Table 2 Sequence analysis content and corresponding analysis tools of goat KLF16
1.2.2山羊KLF16在组织及细胞时序表达分析
选用UXT和GAPDH为内参基因,qPCR检测KLF16在山羊不同组织和不同分化阶段肌内脂肪细胞中的表达水平,引物信息如表1。山羊各组织cDNA由1.2.1获得。
沿用本实验室前期的方法将山羊原代肌内脂肪细胞复苏培养[14], F3代细胞生长到80%左右时,加入含50 μmol/L油酸的培养基进行诱导分化,分别收集0、1、2、3、4、5和6 d的细胞,用Trizol法提取细胞中的总RNA,取1 μg RNA反转录为cDNA,将获得的cDNA原液5倍稀释后即获得细胞时序cDNA。qPCR反应体系为:cDNA模板1 μL,上下游引物各1 μL, SYBR®Premix ExTaqTM (2×)10 μL,用ddH2O补充至20 μL。95 ℃预变性3 min,95 ℃变性10 s,66 ℃退火10 s,72 ℃延伸15 s,共40个循环。
1.2.3山羊KLF16在肌内前体脂肪细中的过表达
将F3代山羊肌内前体脂肪细胞按4×104个/孔接种于12孔板,待融合度达80%后根据腺病毒小体积感染表(汉恒生物科技(上海)有限公司)用3 μL 携带目的基因的重组腺病毒(HBAD-KLF16-EGFP)感染细胞24 h(病毒滴度为1.26×1010PFU/mL),获得KLF16过表达组(Overexpression, OE),阴性对照组(Negative control, NC),用不携带目的基因的空载腺病毒(HBAD-EGFP)感染细胞;然后更换为50 μmol/L 油酸的培养基诱导分化2 d,观察细胞内绿色荧光蛋白(EGFP)的表达情况并收集细胞用于后续实验,细胞总RNA的提取和cDNA的获得方法同1.2.1。
1.2.4过表达KLF16对山羊肌内前体脂肪细胞分化的影响
1.2.4.1 油红O染色观察脂滴形成情况
用油红O染色法检测诱导分化前后山羊肌内脂肪细胞中脂滴的变化,用于染色的细胞接种于24孔板,过表达KLF16两天后移除培养基,PBS洗涤三遍后用中性甲醛(10%)固定30 min,移除甲醛,重复PBS洗涤,然后加入适量的油红O染液染色20 min,移除染液后用PBS多次洗涤,在显微镜下观察并拍照。随后根据油红O染色提取法,每孔加入1 mL异丙醇溶解脂滴中吸附的油红O染料,转移至96孔板中测定490 nm时的吸光度值(OD值)以量化染色结果。
1.2.4.2 分化标志基因及家族其他成员表达变化
用qPCR检测过表达KLF16后KLFs和分化标志基因的表达情况,反应体系同1.2.3,引物信息同表1。
1.2.5数据处理及分析
用2-ΔΔCt法处理qPCR数据结果,以“平均值±标准差”表示,并用SPSS 18.0检验数据显著性。P<0.05表示存在显著差异;P<0.01表示存在极显著差异。KLF家族基因表达量的相关性分析由Excel相关程序完成。
2 结果与分析
2.1 山羊KLF16基因克隆及生物信息学分析
克隆得到山羊KLF16基因序列全长986 bp(图1(a)),包含756 bp完整的CDS区序列,编码251个氨基酸,功能结构域预测显示KLF16具有3个相邻的C2H2型锌指结构,分别位于128~150、158~180和188~208位氨基酸(图1(b))。山羊KLF16蛋白分子量大小为25.597 ku,理论等电点为10.17,无信号肽,不包含跨膜结构域,亚细胞定位显示其主要定位于细胞核。山羊KLF16蛋白具有29个O-糖基化位点,不含有N-糖基化位点;含有25个丝氨酸(S)磷酸化位点,5个苏氨酸(T)磷酸化位点和1个酪氨酸(Y)磷酸化位点。蛋白质三维结构预测显示山羊KLF16具有3个锌指结构,佐证了功能结构域预测的结果(图1(c))。蛋白质互作分析显示KLF16可能与CYP1A1、KLF6、SIN3A、MITD1和IRF2BP1等蛋白质间存在相互作用(图1(d))。
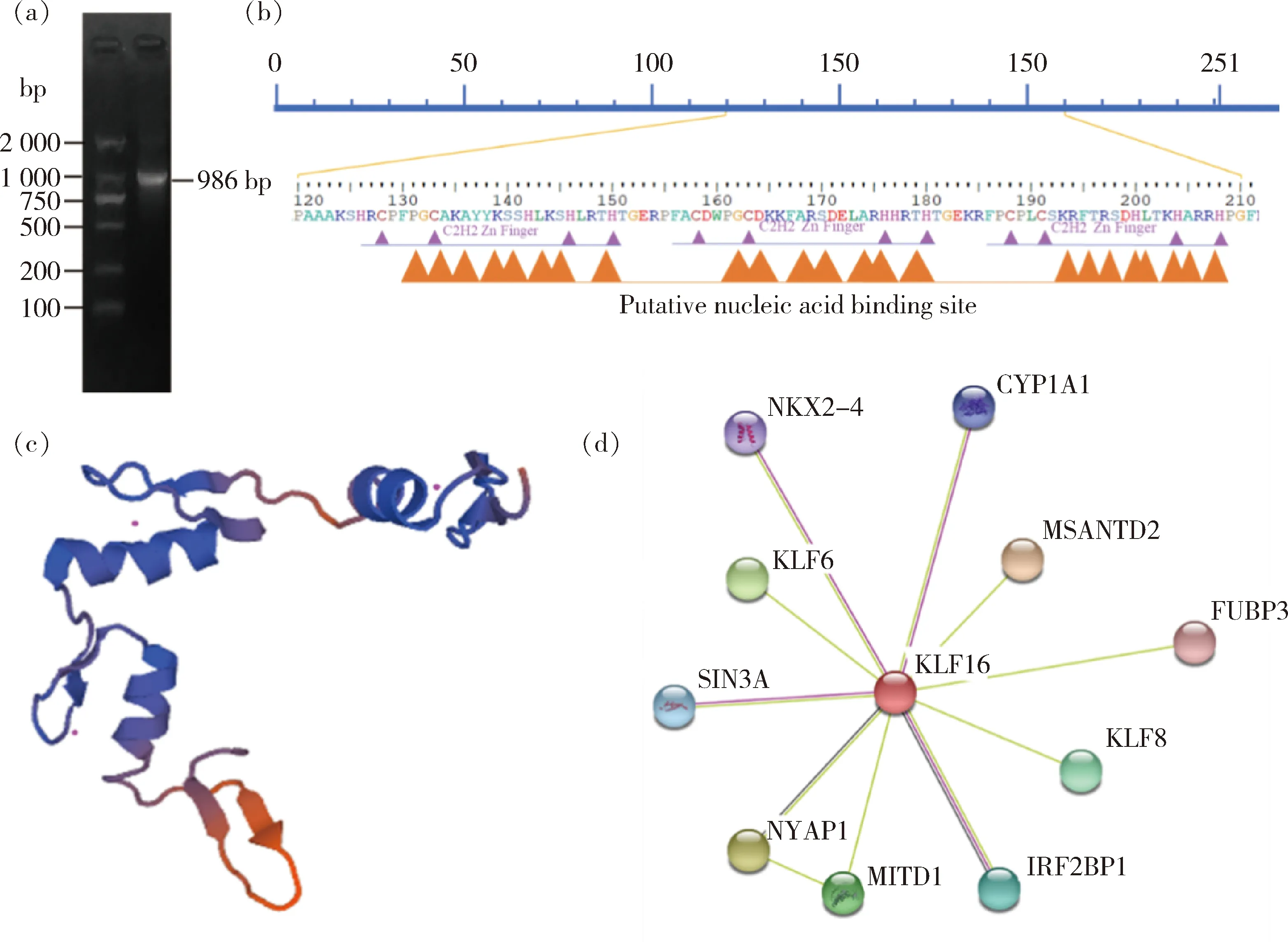
(a)PCR扩增KLF16基因;(b)KLF16锌指结构域位点;(c)KLF16蛋白三级结构预测;(d)KLF16相互作用预测(a) Amplication of KLF16 gene by PCR; (b) KLF16 zinc finger domain site; (c) KLF16 protein tertiary structure prediction; (d) KLF16 interaction prediction图1 山羊KLF16基因克隆及序列分析Fig.1 Clone and sequence analysis of goat KLF16 gene
山羊KLF16氨基酸序列与绵羊高度相似,达到99.47%,与牛也存在较高相似性(图2(a))。进化树显示山羊KLF16与绵羊、牛亲缘关系较近(图2(b))。
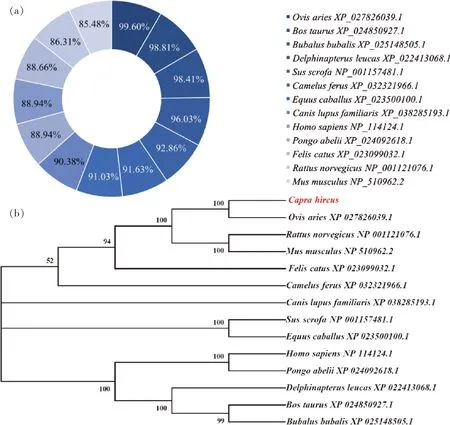
图2 KLF16氨基酸相似性比对(a)与进化树分析(b)Fig.2 KLF16 amino acid similarity comparison (a) and evolutionary tree analysis (b)
2.2 山羊KLF16基因组织和细胞表达模式
qPCR 结果显示,KLF16在育成羊各组织中广泛表达,在腹部皮下脂肪中表达量最高(P<0.01);同时在肺脏中的表达水平也显著高于其他组织(P<0.05)(图3(a))。
KLF16在山羊肌内前体脂肪细胞分化的0~6 d均有表达且存在差异,呈现先剧增后下降的特点。KLF16在1 d的表达量达最高水平,且极显著高于分化前和其他分化过程(P<0.01),而在2~6 d内持续低表达(图3(b))。
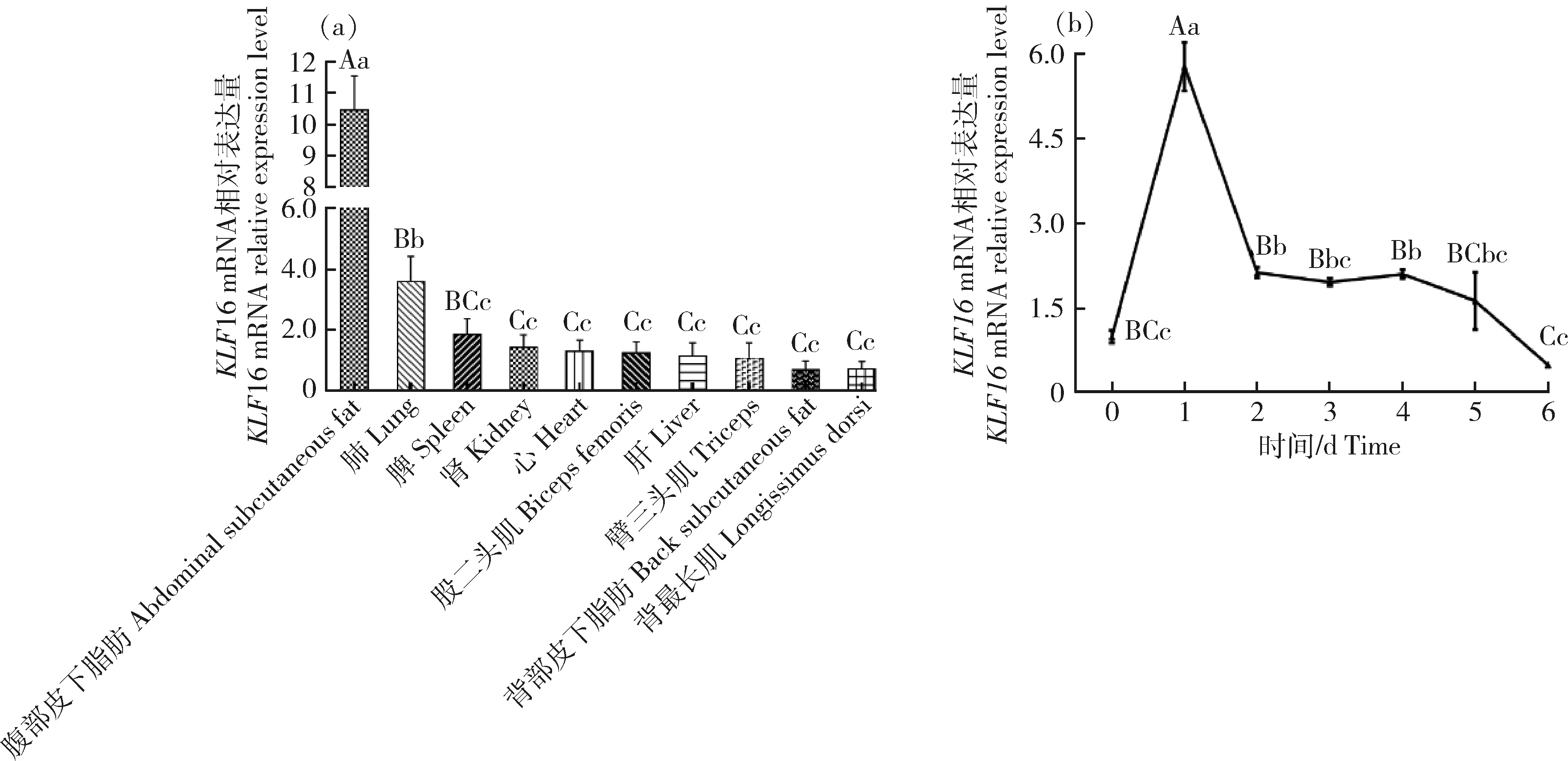
同行数据肩标不同大写字母为差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。Different uppercase letters in the data of the same peer group indicate that the difference is extremely significant (P<0.01), and different lowercase letters indicate that the difference is significant (P<0.05).图3 山羊KLF16在不同组织(a)和肌内前体脂肪细胞(b)的表达量Fig.3 The expression levels of goat KLF16 in different tissues(a) and intramuscular preadipocytes (b)
2.3 过表达KLF16对山羊肌内前体脂肪细胞分化的影响
2.3.1过表达山羊KLF16对肌内脂肪细胞脂滴积聚的影响
镜下观察诱导两天的细胞绿色荧光蛋白的表达,利用ImageJ软件计算图片荧光区域,NC组绿色荧光占图片46.62%,OE组绿色荧光占图片46.32%,NC组和OE组荧光表达量相当,说明感染效率基本一致,可以进行后续观察和分析(图4(a)和(c))。qPCR检测KLF16过表达效率,显示KLF16极显著(P<0.01)上调达到约1 500倍(图4(e)),油红O染色观察到过表达KLF16后细胞内脂滴生成减少(图4(b)), 油红O染色提取法OD值也呈现相同的结果(图4(d))。
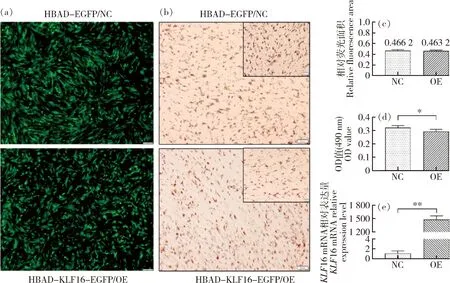
(a)NC组与OE组细胞内荧光表达情况(40×);(b)油红O染色观察细胞内脂滴积聚情况;(c)NC组与OE组荧光相对表达面积;(d)OD值量化油红O染色结果;(e)NC组与OE组KLF16相对表达量(a) Fluorescence expression in adipocytes of NC group and OE group (40×); (b) Oil red O staining to observe the accumulation of intracellular lipid droplets; (c) Relative fluorescens area of NC group and OE group; (d) OD value quantifies the Oil red O staining results; (e) Relative expression of KLF16 in NC group and OE group**表示P<0.01,*表示P<0.05,下同。** means P<0.01, * means P<0.05. The same below.图4 过表达KLF16后形态学观察及效率检测Fig.4 Morphological observation and efficiency detection after overexpression of KLF16
2.3.2过表达山羊KLF16对肌内脂肪细胞分化标志基因及KLFs的影响
为探究KLF16在山羊肌内脂肪细胞分化中的作用机制,本研究检测分化标志基因相关基因的表达,发现PPARα、PPARγ、C/EBPα和C/EBPβ均表现为下调,且PPARα和PPARγ表达极显著水平(P<0.01)(图5(a))。预测KLF16保守结合域如图5(b)所示,且与PPARα、PPARγ、C/EBPα和C/EBPβ启动子区域存在多个结合位点(图5(c))。
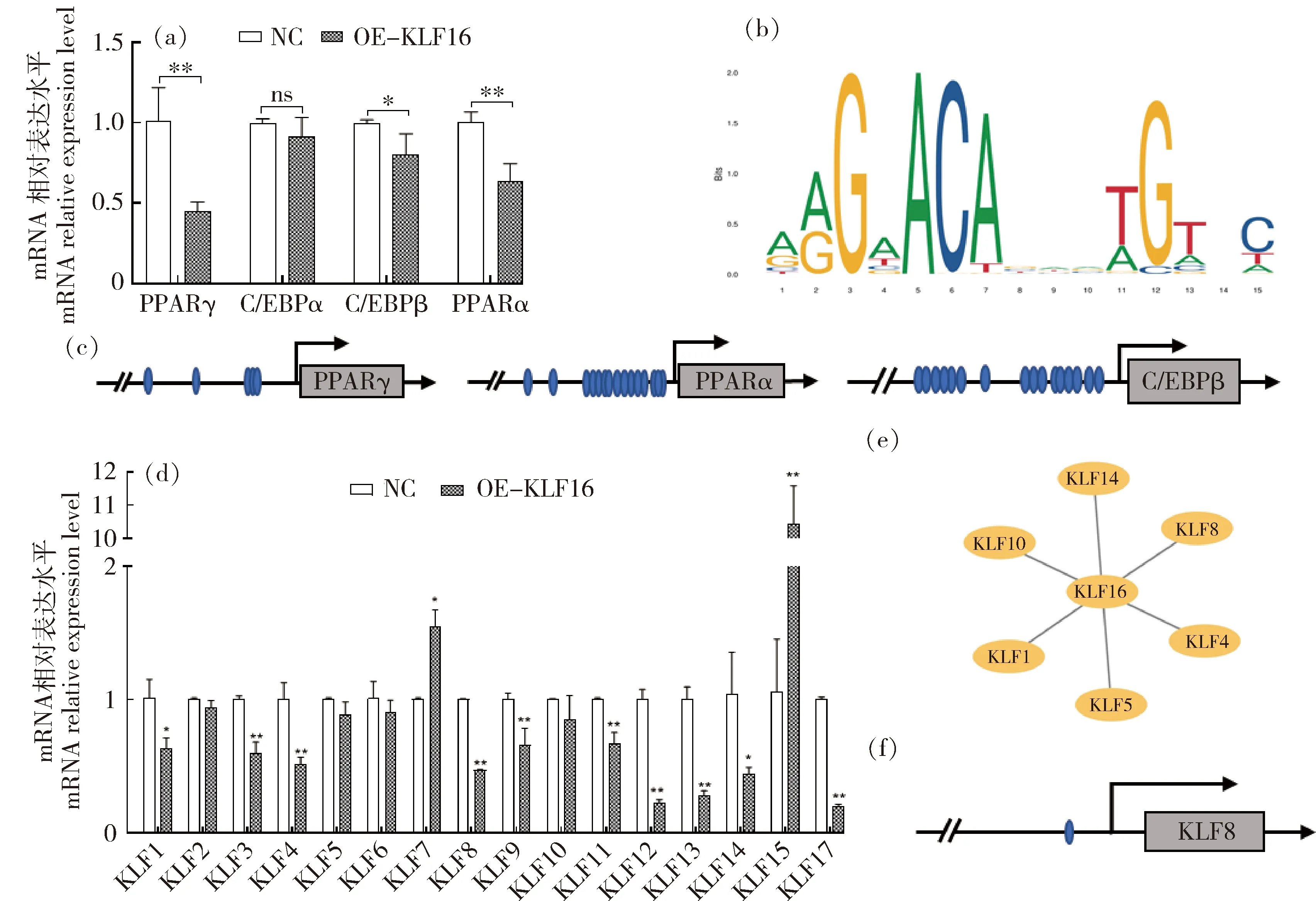
(a)分化标志基因检测;(b)KLF16 DNA结合域预测;(c)KLF16与基因的启动子结合关系预测;(d)KLFs表达直方图;(e)KLFs成员与KLF16的表达相关性分析;(f)KLF16与KLF8启动子结合位点预测。(a) Detection of differentiation marker genes; (b) Prediction of KLF16 DNA binding motif; (c)Prediction of KLF16 binding sites with genes promoter; (d) Histogram of KLFs expression; (e) The expression correlation analysis of KLFs with KLF16; (f) Prediction of KLF16 binding sites with KLF8 promoter.图5 山羊KLF16调控肌内前体脂肪细胞分化的作用途径分析Fig.5 Analysis of the role of goat KLF16 in regulating the differentiation of intramuscular preadipocytes
为探讨KLF16是否通过与其他KLF成员之间相互作用来发挥调控作用,qPCR检测过表达KLF16后KLFs的表达(图5(d)),发现除KLF2、5、6和10之外其他成员的表达均发生显著变化,其中KLF7和KLF15表达分别显著(P<0.05)和极显著(P<0.01)上调,KLF1、9和14显著下调(P<0.05),KLF3、4、8、11~13和17极显著下调(P<0.01)。采用皮尔逊相关系数(Pearson,r)表征过表达KLF16后KLFs之间的表达关系,显示家族成员之间存在一定程度的相关表达,且KLF16与KLF1、KLF8和KLF14存在正相关(r>0.7),与KLF4、KLF5和KLF10存在负相关(r<-0.7)(图5(e)),预测KLF16与KLF8启动子存在结合位点(图5(f))。
3 讨 论
3.1 山羊KLF16基因克隆及分子特性
本研究克隆得到山羊KLF16基因序列,分析发现该序列具有KLF家族典型的C2H2锌指结构域。山羊KLF16的锌指结构中,前2个锌指均由23个氨基酸组成,第三个锌指由21个氨基酸组成,符合KLF家族锌指保守规律,与现有人和猪方面的报道一致[23,25]。已知C2H2型锌指结构域可以识别并结合DNA序列[26], 从而调控基因的表达进而发挥作用,推测山羊KLF16可能通过C2H2锌指结构域发挥调控作用。山羊KLF16第一锌指前六肽为“AAKSHR”,包含3个碱性氨基酸,主要分布于细胞核,这与Song等[27]报道在KLF16在T淋巴细胞中具有核定位序列相似。山羊KLF16氨基端的AAVDL,属于保守的A(A/V)XXL基序[23],该基序可招募转录共抑制因子Sin3A抑制靶基因表达[28]。蛋白质互作分析显示山羊KLF16与KLF6、KLF8、CYP1A1、SIN3A、MITD1和IRF2BP1等可能存在相互作用。其中已证实KLF6、KLF8促进小鼠脂肪细胞分化,KLF6与HDAC3在DLK1启动子上相互作用抑制DLK1基因表达,从而促进3T3-L1脂肪细胞的分化[29],还通过干扰PPARα的表达从而达到的促进分化的作用[30];而KLF8则是通过增强PPARγ2和C/EBPα启动子活性促脂肪细胞分化[31-32]。细胞色素CYP1A1通过促进肝脏脂肪酸ω氧化过程,从而调节脂质代谢[33-34]。IRF2BP2是脂质稳态的新型调节器,且在KLF2转录激活过程中必需IRF2BP2的参与[35],同时KLF2已被证实是山羊肌内脂肪细胞分化的负调控因子[24]。系统进化树分析发现山羊KLF16氨基酸序列与绵羊的相似性更高,其次为牛,符合物种进化规律。
3.2 山羊KLF16的表达特性
明确基因表达特性是阐明基因功能的基础。NCBI上收录的小鼠组织表达数据(Gene ID: 118445)显示KLF16在成年小鼠子宫、肾上腺、脾表达量相对较高,在生殖系统脂肪垫和皮下脂肪中也存在较高表达;此外,猪(Gene ID: 100302638)KLF16在子宫中表达水平最高,其次为脾、肺、心脏和皮下脂肪等组织。本研究发现KLF16在山羊各组织中广泛表达,尤以腹部皮下脂肪中高表达,其次为肺脏。与上述结果存在差异,可能是物种差异造成的。本研究发现KLF16在山羊腹部皮下脂肪组织中的高表达,提示其可能对脂肪沉积存在影响。本研究发现KLF16在山羊肌内脂肪细胞分化0~6 d均存在表达,但表达趋势与Jang等[22]研究结果存在差异,Jang等研究表明KLF16在小鼠棕色脂肪细胞和3T3-L1前脂肪细胞分化0 d的表达量最高,随后逐渐降低。这种差异可能是由于物种特异性和不同取材部位两方面的影响,Jang实验中的小鼠前体脂肪细胞取材于皮下,而本研究中山羊前体脂肪细胞来源于背最长肌,肌内脂肪与肌纤维面积和直径等表型具有正相关,对前脂肪细胞分化过程可能也有影响[36]。
3.3 山羊KLF16在脂肪细胞分化中的作用
在明确山羊KLF16组织及肌内脂肪细胞分化表达模式的基础上,本研究利用HBAD-KLF16-EGFP重组病毒感染体外培养的山羊肌内前体脂肪细胞,使其过表达,结果发现与对照组相比,过表达后细胞内脂滴积聚减少,这与Jang等[22]的研究结果相似,Jang等研究表明KLF16是小鼠脂肪生成中的负调控因子。为了确定过表达山羊KLF16减少肌内脂肪细胞脂滴积聚的可能机制,本研究检测了脂肪细胞分化标志基因PPARγ、PPARα、C/EBPα 和C/EBPβ的表达变化,结果发现PPARγ、PPARα和C/EBPβ均存在显著下调,推测可能通过调控这些基因的表达来发挥作用。且通过ALGGEN PROMO程序预测,山羊KLF16在PPARα、PPARγ和C/EBPα启动子区存在多个结合位点。Sun等[37]指出过表达KLF16通过直接结合PPARα的启动子来加速小鼠脂肪酸氧化并减弱线粒体应激和氧化应激,从而减少脂质沉积,与本实验结果相似。现有研究证实PPARs与C/EBPs做为典型的脂肪组织特异性转录因子,具有协同作用[38-39],因此推测KLF16可能通过直接结合PPARα,影响PPARs与C/EBPs之间的协同作用从而抑制山羊肌内脂肪细胞分化,但KLF16是否直接作用于PPARγ和C/EBPα仍需进一步研究探明。研究指出KLF家族成员之间的表达存在相互影响[40-44],因此本研究检测了过表达KLF16后KLFs的表达情况,其中KLF7和KLF15表达上调,KLF1、3、4、9、8、11~14、17下调。分析KLFs之间表达相关性显示KLF16与KLF1和KLF8的相关系数达到0.9以上,存在较强正相关,与山羊KLF16可能与KLF8具有相互作用的预测结果相对应,分析发现KLF8启动子区存在KLF16结合位点,并且本实验室前期研究表明干扰KLF8抑制山羊肌内脂肪细胞成脂分化,KLF16表达水平上调,基于上述推测山羊KLF16通过拮抗KLF8 抑制PPARα、PPARγ和C/EBPβ的表达来抑制肌内脂肪细胞分化。
后续研究将致力于探究KLF16在山羊不同部位脂肪沉积中的作用,并通过mRNA和蛋白水平的研究全面阐述其调控脂肪沉积的分子机理。
4 结 论
本研究成功克隆获得具有典型三锌指结构的山羊KLF16基因序列,主要定位于细胞核,属于不稳定碱性亲水蛋白质;过表达山羊KLF16减少了脂滴积聚,且可能通过拮抗KLF8下调脂肪细胞分化标志基因PPARγ、PPARα和C/EBPβ的表达水平抑制肌内前体脂肪细胞分化;本研究为揭示山羊KLF16调控肌内前体脂肪细胞分化机制提供基础,并为完善山羊KLFs脂肪细胞分化调控网络构建提供数据支撑。