一株纤维降解菌的鉴定及其对酒糟固态发酵效果的研究
2022-05-18代秦丹黎光杨姚小鹤邹华围王之盛彭全辉王立志
代秦丹 黎光杨 汪 成 马 健 胡 瑞 李 翔 姚小鹤 邹华围 王之盛 彭全辉 薛 白 王立志
(四川农业大学 动物营养研究所/四川省牛低碳养殖与安全生产高校重点实验室,成都 611130)
我国拥有非常丰富的低成本粗饲料和非常规饲料资源,这类饲料具有质地粗硬,粗纤维含量高及蛋白质含量低等缺点,在畜牧生产利用中受到限制。一般需要通过合理加工来改善其利用率,例如物理、化学和生物学方法[1],其中生物学方法对环境友好且具有良好前景[2]。农业部“十三五”规划也明确提出生物饲料产业发展是供给侧结构性改革的重要突破口。因为生物饲料不仅在改善饲料营养价值上发挥作用,也是无抗饲料的重要组成部分。粗饲料经微生物发酵后能提高蛋白质含量[3],改善氨基酸组成,同时获得有益的微生物代谢产物[4]。生物发酵饲料应用广泛,按总量普及率的20%计算,2018年发酵饲料总量约195万t[5]。
白酒糟在我国产量巨大,据估计2019年我国白酒糟产量可达2 115万t[6]。由于白酒在酿造的过程中会添加45%左右的稻壳,导致白酒糟木质纤维素含量高,营养价值较低,有机物消化率低[7],在单胃动物和反刍动物中的实际利用率有限。利用微生物发酵后,酒糟营养价值均有明显改善[8-9]。利用微生物发酵方式改善白酒糟的营养价值主要集中于降低纤维含量,提高蛋白质含量。能降解纤维的微生物主要包括真菌、细菌和放线菌,其中细菌比真菌有更强的环境耐受性以及功能多样性,比多数放线菌有更强的纤维酶活[10],已在饲料、食品和农业等领域发挥作用。目前能在饲料发酵上应用的饲用细菌较少,例如酿酒酵母[11]和枯草芽孢杆菌[12]等,但以上菌种产酶种类有限。因此,为满足现代工业需求,获得新的生物催化剂来源,寻找新的环境友好型和高效率的菌种是饲料发酵工业的发展趋势。
芽孢杆菌类细菌是一类重要的益生菌,饲用芽孢杆菌能生产饲用酶,饲用活性代谢产物以及作为肠道益生菌等,可促进动物生长,提高动物健康,在饲料资源开发应用上有很大的发展空间[13]。芽孢杆菌在自然界广泛存在,柯恩氏菌属是其中一种,该属的成员来自于多种环境中,如土壤、淡水和植物根系等。研究发现某些柯恩氏菌属于木聚糖[14]、纤维素和半纤维素溶解菌[15]。本实验室前期从腐殖土中应用平板法分离出一株具有明显纤维降解效果的细菌,但对其种属、生理生化特性以及对饲料纤维的降解效果尚不明确。因此,本研究旨在对本实验室前期筛选的一株纤维降解菌进行鉴定,并以白酒糟为发酵底物,探究其对饲料纤维的降解效率,从而为该菌在低品质高纤维饲料开发与利用方面提供理论依据。
1 材料与方法
1.1 菌株和培养基
1.1.1菌株
本研究所用菌株T5为四川农业大学动物营养研究所草食动物营养研究室前期筛选保藏的菌株。
1.1.2培养基
LB培养基:10.0 g蛋白胨,5.0 g酵母浸提物,5.0 g氯化钠,溶于1 L蒸馏水,121 ℃灭菌30 min,作为种子液培养基。
鉴别培养基:7.5 g羧甲基纤维素钠,1.0 g KH2PO4,1.0 g蛋白胨,0.5 g酵母膏,0.5 g MgSO4·7H2O,1.5 g NaCl,20.0 g琼脂,蒸馏水定容至1 L,121 ℃灭菌30 min。
发酵培养基:20 g发酵底物(m(麸皮)∶m(浓香型干酒糟)=1∶9,干物质(DM)基础),1.5%尿素(以占发酵底物干物质质量分数计算),置于250 mL锥形瓶中,121 ℃灭菌20 min。酒糟购于宜宾五粮液酒厂,经65 ℃烘干制成干酒糟,麸皮采自四川农业大学动物营养研究所教学科研基地。
1.2 菌株的活化与鉴定
1.2.1菌株的活化及种子液的确定
取-80 ℃保藏的菌液,于4 ℃解冻后,接种到鉴别培养基上,待长出菌落后,挑取一接种环的菌株接种到含50 mL LB培养基的250 mL锥形瓶中,于39 ℃,180 r/min振荡培养18 h,作为种子液。此菌液浓度下进行平板计数,其浓度约为3.48×107CFU/mL。
1.2.2菌株的鉴定
在电镜下进行菌株的形态观察,部分生理生化指标检测参照《伯杰氏细菌鉴定手册》[16]。
利用引物16S rRNA扩增引物(通用引物)正向引物Forward为:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物Reverse为:5′-TACGGCTACCTTGTT-ACGACTT-3′进行分子生物学鉴定。提取菌株T5的基因组DNA,以之为模板,用引物扩增其16S rDNA片段,送北京六合华大基因科技有限公司测序,测序结果进行NCBI-BLAST比对,借助MEGA X软件构建系统发育树。
1.3 发酵白酒糟试验
1.3.1单因素试验
采用单因素试验设计对发酵因素进行初步探索和优化,即发酵温度(30、33、36、39和42 ℃);发酵时间(2、3、4、5、6和7 d);种子液添加量(5%、10%、15%、20%、25%和30%)和料水比(1∶1.00、1∶1.25、1∶1.50、1∶1.75、1∶2.00和1∶2.25),每个处理3个重复。其中添加量为占发酵底物DM质量分数,料水比为料(DM基础)与水质量比。发酵结束后,65 ℃烘干,粉碎过40目筛,测定粗蛋白质(CP)和中性洗涤纤维(NDF)含量。
1.3.2正交试验
单因素试验基础上,进行四因素三水平的正交试验设计(L9(34))继续优化发酵温度(A)、发酵时间(B)、添加量(C)和料水比(D),确定最优发酵条件,每个处理3个重复。发酵结束后,65 ℃烘干,粉碎过40目筛,测定NDF和CP含量。
1.3.3最优条件发酵白酒糟
最优条件下发酵白酒糟,比较对照组与发酵组营养成分和酒糟结构的变化,每个处理3个重复。发酵结束后,取约2 g发酵样品,临界点干燥后,用电镜专用胶带将样品固定在台支架上,经干燥喷金处理,利用扫描电镜(HITACHI Regulus 8100)进行表面结构观察。剩余样品于65 ℃烘干,粉碎过40目筛,用于常规营养成分分析。
1.4 体外试验
1.4.1瘤胃液的采集
瘤胃液于晨饲前2 h,用胃管式瘤胃液采样装置抽取3头1岁左右体况良好的筠连黄牛瘤胃液,将3头牛的瘤胃液混匀,经4层无菌纱布过滤到充满CO2的保温瓶中,并迅速运送回实验室。筠连黄牛饲养于四川农业大学动物营养研究所试验基地。
1.4.2体外发酵试验
参照Menke等[17]方法配制人工唾液,按照祝伊枭等[18]描述的方法进行体外发酵试验,记录3、6、9、12、24、48和72 h的发酵管刻度。发酵结束后,用铝箔集气袋收集气体,待测甲烷(CH4)体积分数,然后将发酵管置于冰水中终止发酵,将发酵管中的发酵液用预先恒重的尼龙袋过滤,留下滤渣,用于干物质降解率(IVDMD)的测定。滤液分装于10 mL无菌离心管中,测发酵液pH,其余-20 ℃保存,用于氨态氮(NH3-N)、微生物蛋白(MCP)和挥发性脂肪酸(VFA)质量浓度的测定。
1.5 指标测定与计算
干物质(DM)、粗脂肪(EE)和粗灰分(Ash)分别按照GB/T 6435—1986、GB/T 6433—2006和GB/T 6438—2007测定,粗蛋白质(CP)、真蛋白(TP)、粗纤维(CF)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的测定参照张丽英的《饲料分析及饲料质量检测技术》[19]。
按以下公式[20]计算累积产气量(GP):
GPt=200×(Vt-V0)/W
(1)
式中:GPt为t时间点的累积产气量,mL/mg;Vt为样品发酵t时间后发酵管刻度读数;V0为样品在开始发酵时空白培养管刻度读数;W为样品干物质质量,mg。
利用气相色谱仪(CP-3800)法[21]测各挥发性脂肪酸(VFA)质量浓度,总挥发性脂肪酸(TVFA)质量浓度为各VFA质量浓度之和。发酵液pH使用雷磁25型pH酸度计测定。苯酚—次氯酸盐比色法[22]测定NH3-N质量浓度。参照庄二林[23]的BCA蛋白定量测试盒法测定MCP质量浓度,试剂盒购买于南京建成生物工程研究所。参照周芯宇等[24]描述的气相色谱仪(福立GC9790Ⅱ)法测定CH4百分含量,并计算CH4产量,即CH4产量=72 h GP×CH4体积分数。IVDMD%=100×((尼龙袋重+样重)-过滤后的尼龙袋和滤渣重)/样重。
1.6 数据统计与分析
试验数据经Excel整理后,用GraphPad Prism 8.0绘制单因素试验结果和产气量变化图,并用SPSS 20.0进行二次回归统计分析;对正交试验结果进行极差和方差分析;发酵前后酒糟营养成分和瘤胃发酵特性结果进行One-way ANOVA分析,结果用平均值±均值标准误(SEM)表示,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 菌株的鉴定
2.1.1形态学及部分生理生化鉴定
从图1扫描电镜下可以观察到菌株呈杆状,由表1可知,菌株革兰氏染色和甲基红试验呈阳性,不能分解淀粉,但可降解纤维二糖、葡萄糖和蔗糖,属兼性厌氧菌。此结果表明菌株T5为革兰氏阳性杆菌,能利用葡萄糖生成有机酸。
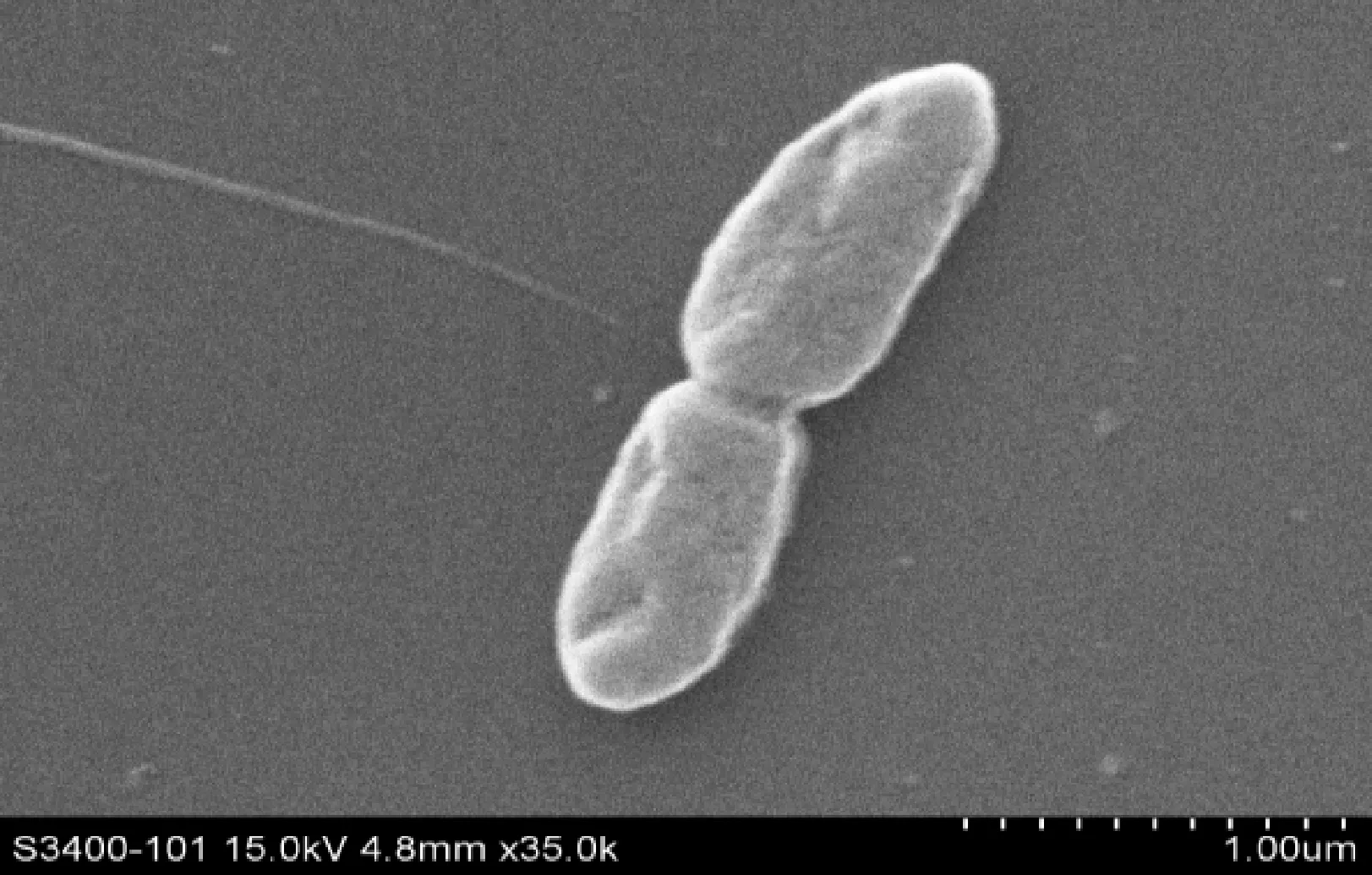
图1 扫描电镜下菌株T5的形态结构Fig.1 Morphological structure of the strain T5 by scanning electron microscope
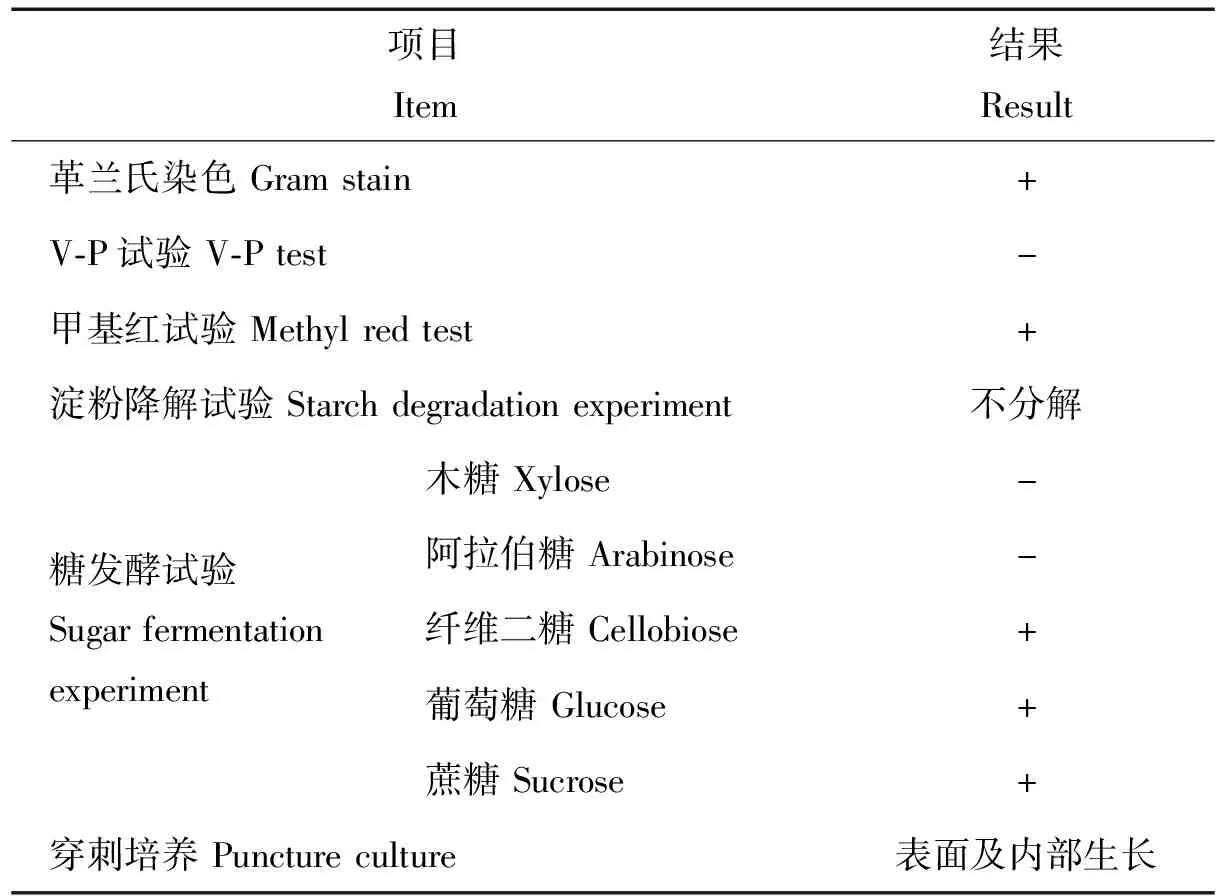
表1 菌株T5的部分生理生化特征Table 1 Some physiological and biochemical characteristics of strain T5
2.1.2菌株T5的系统发育树
测序后,应用NCBI-BLAST在线分析工具对测序结果进行相似性比对,建立的系统发育树如图2所示,菌株T5与Cohnellaxylanilytica聚为一支,他们的亲缘关系最近,且BLAST分析中菌株T5与Cohnellaxylanilytica的16S rRNA序列的相似性最高,达99.57%。以上结果表明该菌株为Cohnellaxylanilytica,可命名为Cohnellaxylanilyticastrain T5。
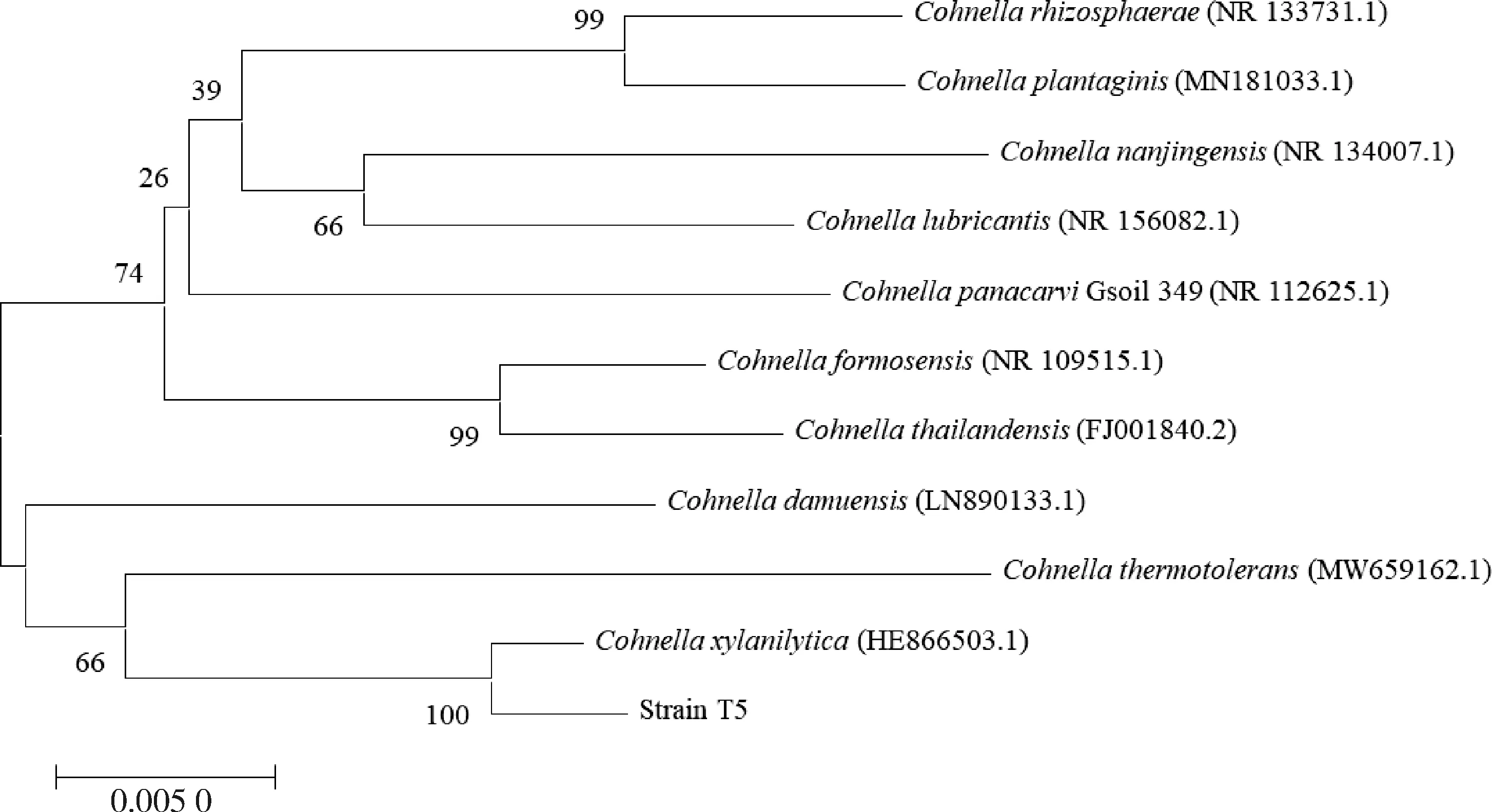
线段0.005表示序列差异的分支长度,括号内数字为GenBank登录号。Line segment 0.005 represents the branch length of sequence difference, and the number in parentheses is the GenBank login number.图2 菌株T5的系统发育树Fig.2 Phylogenetic tree of strain T5
2.2 单因素发酵条件的优化
如图3所示,随着温度、时间、添加量和料水比因素的梯度变化,NDF和CP含量也随之变化。如表2所示,当发酵温度分别为36.26和35.99 ℃,发酵时间分别为4.92和5.28 d,添加量分别为19.08%和17.33%,含水量分别为59.25%和56.86%(料水比在1∶1.25~1∶1.50)时,NDF和CP增长率分别达到最优值。回归分析最适值结合图3中各因素的NDF和CP增长率的变化趋势可以确定菌株T5进行正交试验的各因素水平:发酵温度分别为30、33和36 ℃,发酵时间分别为4、5和6 d,添加量分别为15%、20%和25%,料水比分别为1∶1.25、1∶1.50和1∶1.75。
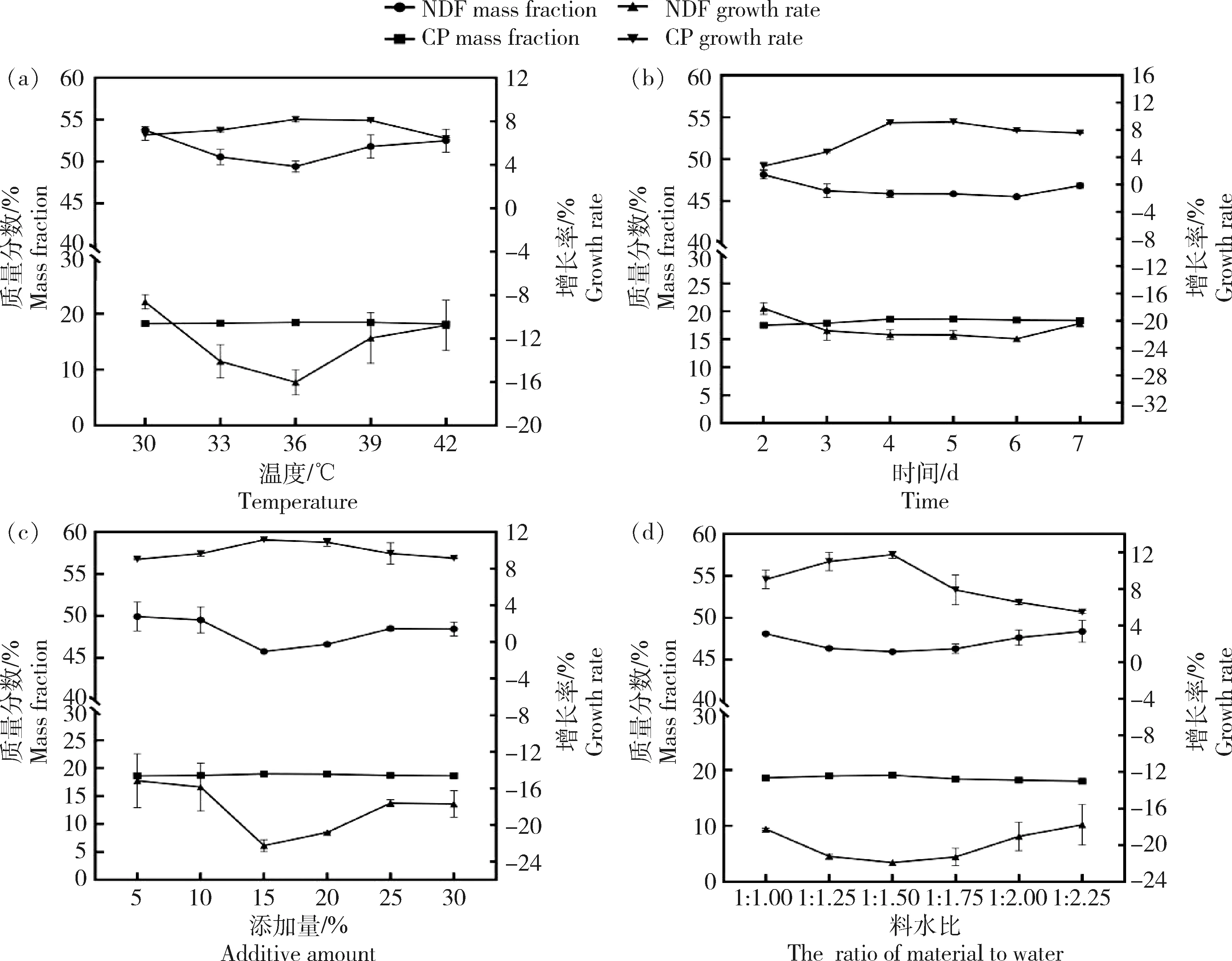
图中左纵坐标表示NDF和CP质量分数的变化范围,右纵坐标代表NDF和CP增长率的变化范围。The left longitudinal coordinate in the figure represents the change range of NDF and CP mass fraction, and the right longitudinal coordinate represents the change range of NDF and CP growth rate.图3 菌株T5发酵酒糟单因素试验分析Fig.3 Single factor test analysis of strain T5 fermented distillers’ grains

表2 菌株T5发酵酒糟单因素试验的回归分析Table 2 Regression analysis of single factor test for strain T5 fermented distillers’ grains
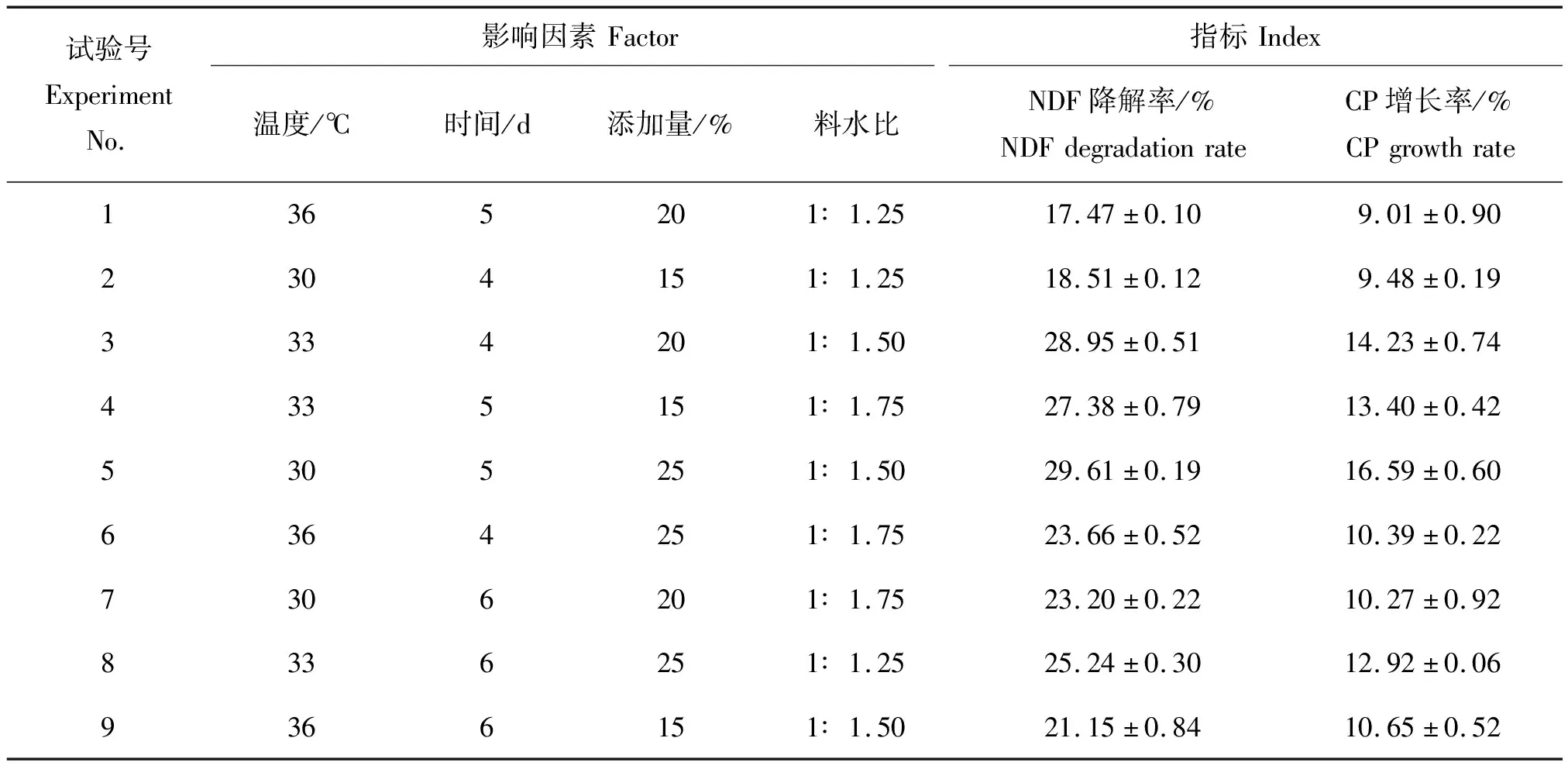
表3 正交试验结果Table 3 Results of orthogonal test
2.3 正交试验
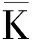

表4 菌株T5正交试验结果的极差分析表Table 4 Table of extreme differential analysis of the results of the orthogonal tests for strain T5
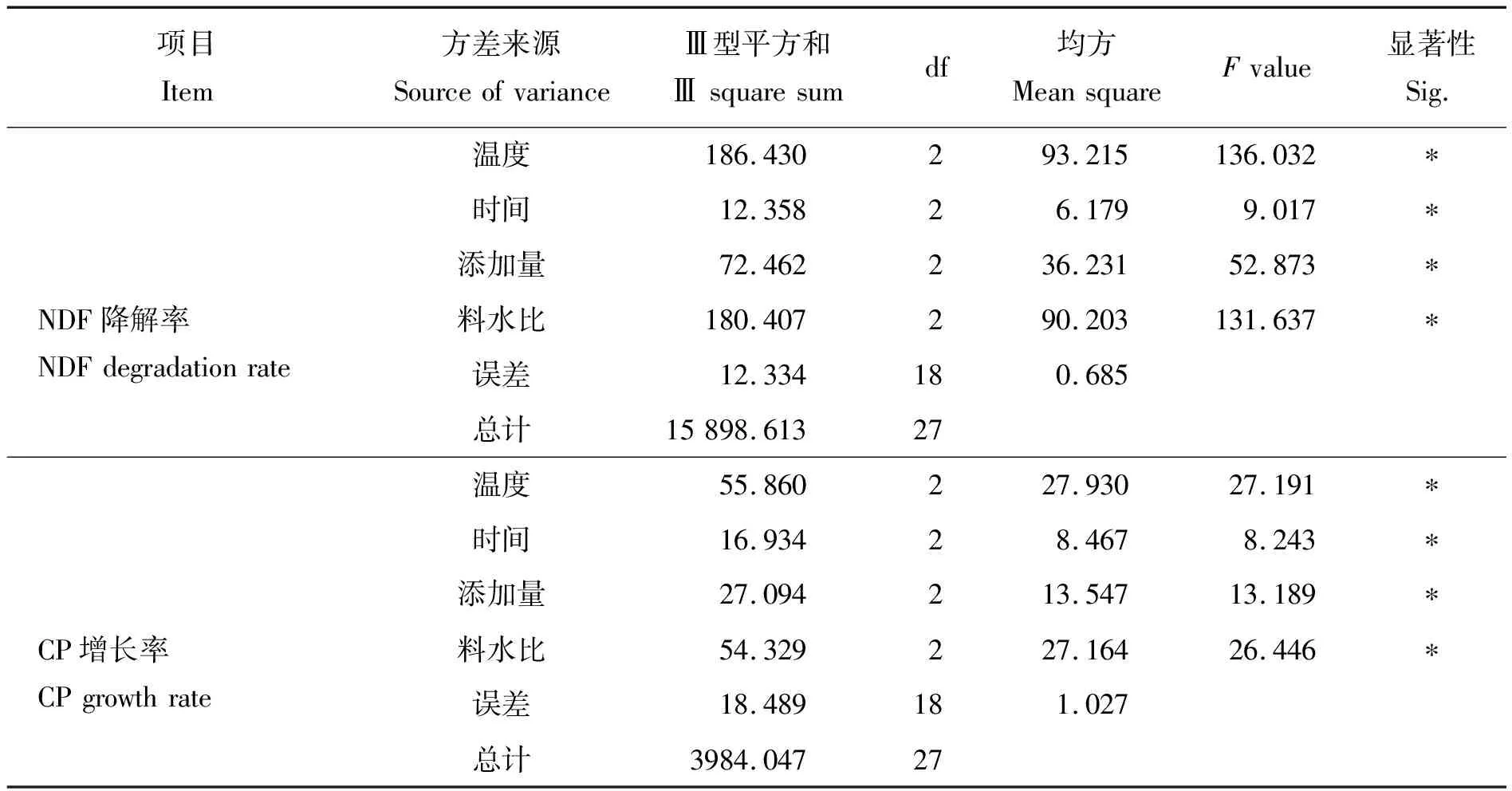
表5 菌株T5正交试验结果的方差分析表Table 5 Analysis of variance of strain T5 orthogonal test results
2.4 发酵酒糟前后营养成分变化
由表6可知,对照组和T5发酵组的CP、TP、CF、NDF、ADF和Ash质量分数差异显著(P<0.05),而EE质量分数差异不显著(P>0.05)。T5发酵组CP和TP质量分数相对于对照组分别增加了19.68%和30.38%;Ash质量分数由8.90%增加到9.25%;而EE、CF、NDF和ADF相对于对照组都有不同程度的降低。其中NDF、ADF和CF质量分数分别降低了31.68%、27.69%和7.95%,EE质量分数由13.70%降低到12.66%。此结果表明,与对照组相比,发酵酒糟组的纤维含量有较大幅度降低,并且蛋白含量有所增加。
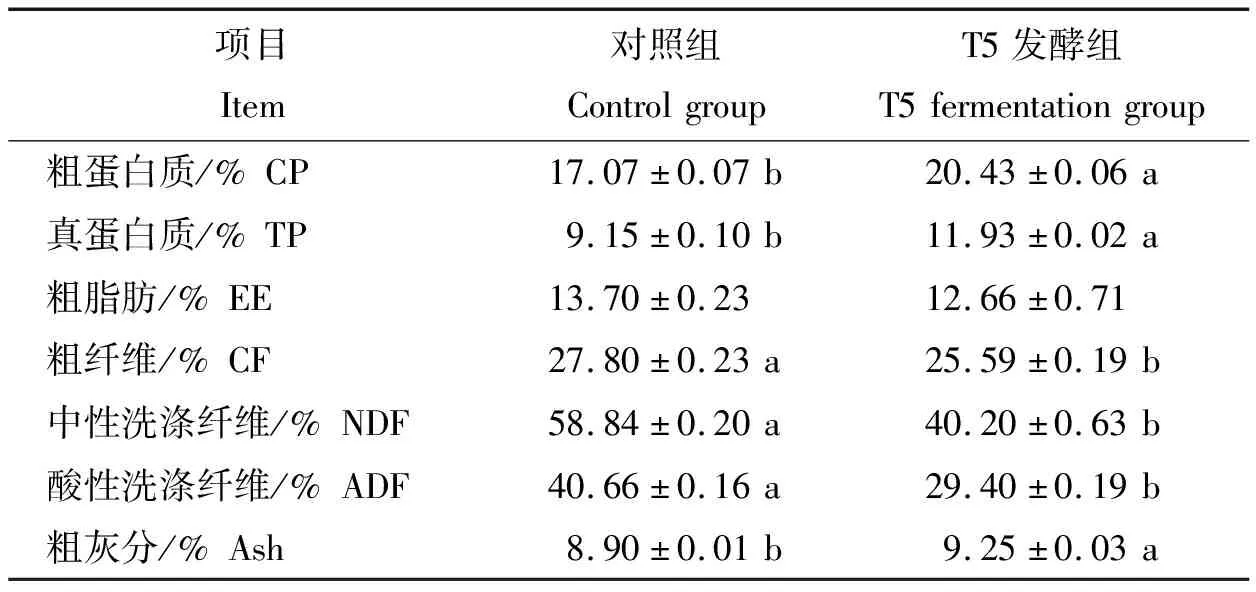
表6 发酵酒糟前后营养成分变化(DM基础)Table 6 The changes of nutrient composition before and after fermentation of distillers’ grains (DM basis)
2.5 发酵前后扫描电镜对比
由图4扫描电镜结果可知,对照组的扫描电镜结果显示酒糟的结构比较完整,而T5发酵组的酒糟结构松散不完整,表面出现大量蜂窝状孔洞(剪头指向),并有明显的菌株附着(圆内)。此结果表明,与对照组相比,菌株T5发酵酒糟可破坏酒糟结构。

(a)和(b)为对照组,(c)和(d)为T5发酵组。(a) and (b) represent control group, (c) and (d) represent T5 fermentation group.图4 发酵前后酒糟的扫描电镜图Fig.4 Scanning electron micrographs of before and after fermentation
2.6 酒糟发酵前后的瘤胃发酵特性
由图5和表7可知,对照组的GP在12~72 h时间段均高于T5发酵组,且72 h GP有显著高于T5发酵组的趋势(P=0.06)。此外,T5发酵组的NH3-N、TVFA、乙酸、丙酸、丁酸、异丁酸、异戊酸和戊酸质量浓度以及IVDMD均显著高于对照组(P<0.05),但MCP质量浓度和乙酸/丙酸差异不显著(P>0.05)。而对照组的CH4百分含量和产量显著高于T5发酵组(P<0.05)。这表明,与对照组相比,发酵酒糟组的产气量和CH4产量降低,而VFA、TVFA和NH3-N质量浓度均有不同程度的升高。
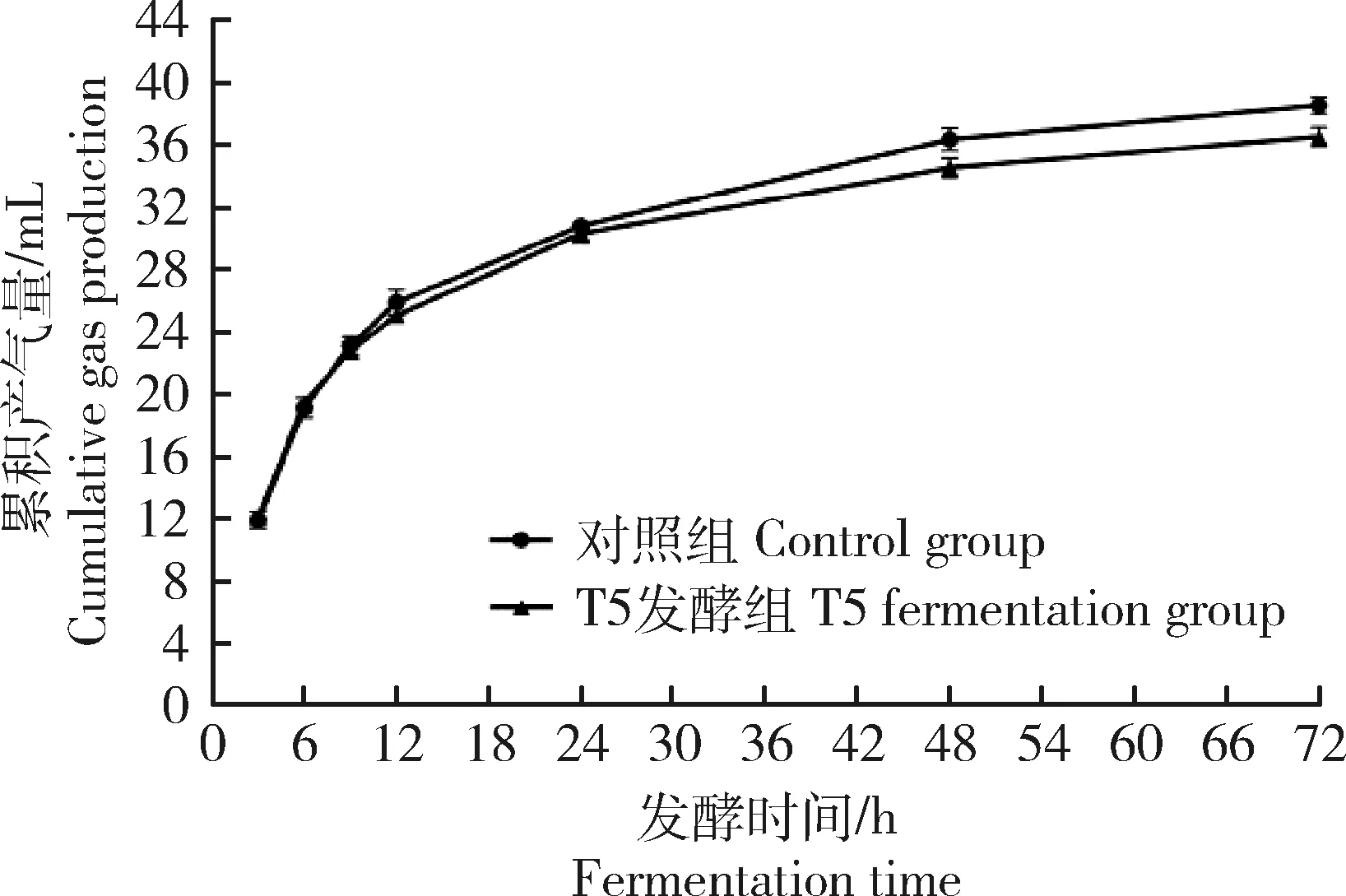
图5 对照组和T5发酵组的累积产气量动态变化比较Fig.5 Comparison of dynamic changes of cumulative gas production in control group and T5 fermentation group
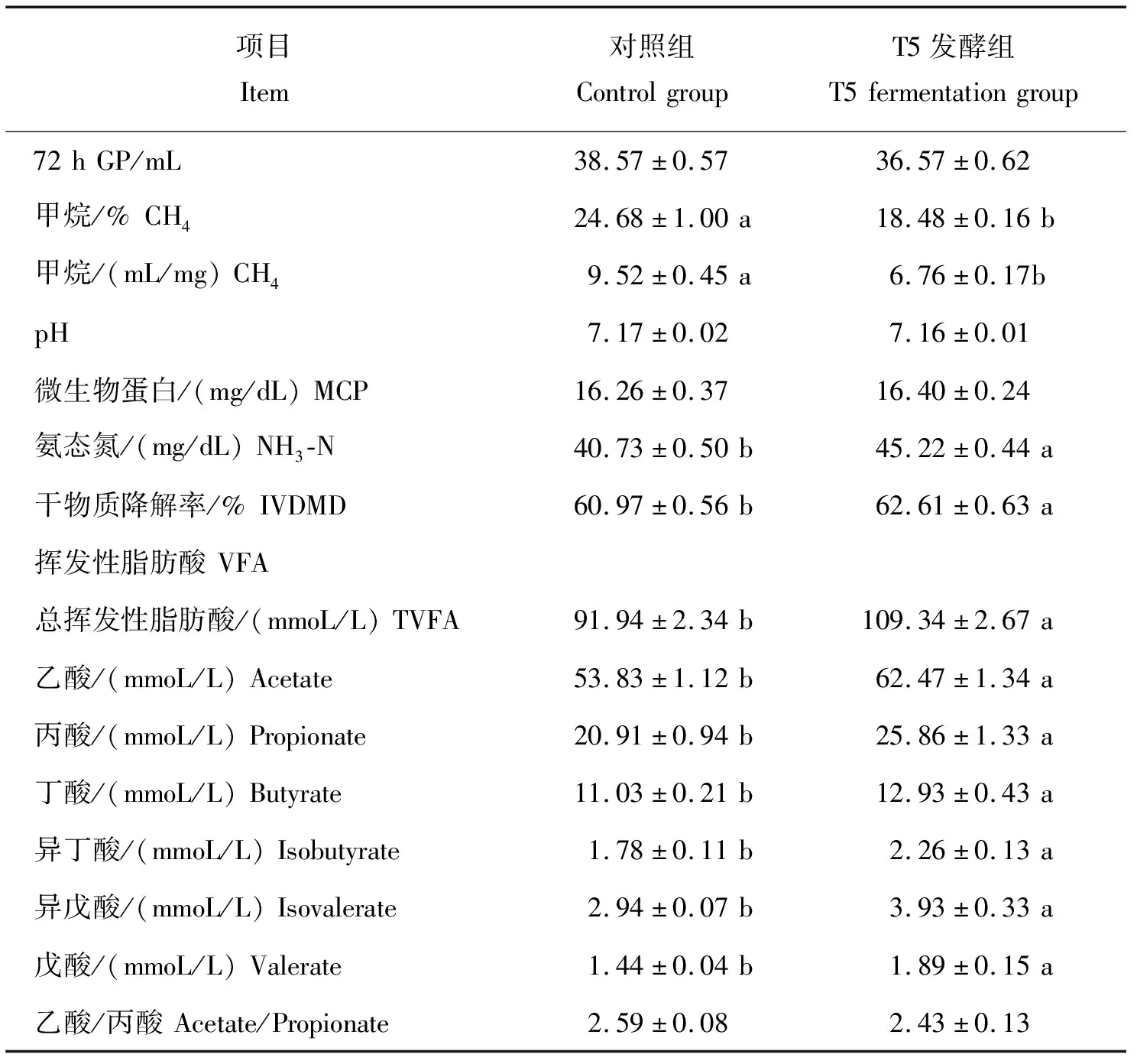
表7 菌株T5发酵酒糟前后体外发酵参数的变化Table 7 Changes of in vitro fermentation parameters of before and after fermentation of distiller’s grains
3 讨 论
3.1 菌株T5的鉴定及发酵白酒糟的工艺条件优化
根据菌株16S rRNA测序结果可以发现菌株T5隶属于柯恩氏菌属,与Cohnellaxylanilytica的相似性最高。Khianngam等[25]研究发现一株Cohnellaxylanilytica具有降解纤维作用,这与本研究结果一致。该菌属兼性厌氧菌,在发酵工程中能较好的适应有氧发酵和厌氧发酵,一定程度上可为进一步开发工程菌株提供菌源。
本研究所用种子液是根据菌株生长曲线确定,将菌接种到LB培养基,培养至菌株生长到对数期刚结束时,此时菌株生长速度和产酶活性达最高[26-27]。固态发酵通常以营养均衡的发酵底物为基础,加入益生菌和水,在适宜温度的好氧或厌氧环境下发酵[28]。本研究考虑到白酒糟营养价值较低,所以发酵培养基中添加麸皮,为微生物生长产酶提供碳源。由于酒糟酸度高,pH一般在3.51~4.56,培养基添加尿素,可以达到调节pH,增加氮源的目的。此外对于粗饲料而言,还可以起到氨化的作用。例如张玉诚[29]在发酵酒糟时,添加了一定比例的麸皮、玉米粉和菜籽粕以及1.5%尿素;张博润等[30]添加了麦芽根粉和2%尿素。
为达到更好的发酵效率,有必要优化发酵过程,促进饲料中各种营养物质的生物转化[31]。本研究对发酵效果影响最大的因素是温度和料水比,其次是种子液和接种量,影响最小的是发酵时间。温度除了影响菌株的生长繁殖外,还会影响其酶活。Pisa等[32]研究发现一株Cohnellasp. AR92的最适生长温度为37 ℃,Huang等[33]发现一株Cohnellananjingensissp. nov.的最适培养温度为30 ℃。本研究菌株T5的最适发酵温度为33 ℃,在前人研究范围内。发酵环境中的水分直接影响菌株的生存环境和活性,从而影响菌株产酶效果[34]。Li等[11]研究表明粗糙脉孢菌单菌发酵豆粕和粗糙脉孢菌和酿酒酵母混菌发酵的最大影响因素之一就是料水比。此外,于海漫[35]用单菌发酵白酒糟,物料含水量在60%最适,这与本研究结果一致。种子液添加量也是影响发酵的重要因素,添加量过低,菌株繁殖缓慢,且易受杂菌污染,添加量过多,则会缩短菌株的生长周期,且大量菌株代谢产物聚集,会影响菌株活性物质的形成[36]。
3.2 菌株T5对白酒糟纤维的降解效果
酒糟是一类特殊的非常规饲料资源,其非淀粉多糖(NSP)含量高,并且还含有残留的酵母细胞和酵母细胞成分、活性生长因子和未知生长因子等[37]。NSP是饲料纤维的主要成分,能将营养物质包裹起来,妨碍动物消化吸收。如将这些NSP去除,营养物质就能从细胞壁里释放出来,从而提高碳水化合物利用率。本研究结果发现,发酵后酒糟的纤维含量显著降低,并且扫描电镜结果展示酒糟结构被破坏,说明菌株T5在纤维降解上发挥作用,且从营养学角度上说,这有利于家畜消化吸收。发酵底物在尿素氨化和灭菌作用下,纤维结构之间的氢键被打断,暴露出结晶纤维素内核,把纤维素从木质素的包裹中释放出来,增加发酵培养基之间的孔隙度以及纤维素和微生物的接触面积,利于纤维降解[38]。发酵过程中纤维被降解,转化为单糖和二糖,并伴随着水和二氧化碳的产生,有机物的比例相对降低,而微生物难利用的无机物相对增加,表现为发酵酒糟Ash含量增加。值得关注的是,本研究发酵酒糟CP和TP含量也明显升高,可能原因是纤维含量降低,相对升高了蛋白含量,同时菌株T5可能利用尿素氮源用于自身生长,并生成微生物蛋白,此外菌株T5菌体本身也含有蛋白质组分。与本课题组前期混菌发酵白酒糟NDF含量降低了18.12个百分点[29]相比,本研究NDF降解效果与之相似,可能是因为本研究发酵培养基经过灭菌以及在最适的物理条件下进行的发酵。刘鹏[39]利用酶菌混合固态发酵白酒糟,CF降幅为42%。宋善丹等[40]混菌固态发酵白酒糟,NDF降幅25.53%,CP增率22.32%。与以上研究相比,本研究菌株T5单菌发酵白酒糟,可达到降解纤维含量,改善蛋白含量的目的。
3.3 体外产气法评定发酵白酒糟的瘤胃发酵特性
不同类型饲料作为发酵底物,体外发酵产气特性会有一定差异。GP某种程度上反映瘤胃微生物的降解活性和饲料降解率[41]。T5发酵组表现出较低GP,可能是因为T5发酵组中酒糟CP含量相对较高的原因,因为瘤胃产气主要基于碳水化合物的降解,而饲料蛋白对GP贡献不大。由于对照组还保留较多的难降解碳水化合物以及较低的CP含量,所以GP较高。饲粮营养组成是影响CH4产生的重要因素,一般低质的粗饲料CH4产量大[42]。瘤胃微生物利用碳水化合物生成CO2和H2,然后经甲烷菌还原生成CH4[43]。对照组的CH4产量更高,一是因为其可能更有助于甲烷菌的生长[44],二是因为对照组纤维含量高,有助于瘤胃纤维降解菌的附着,纤维降解菌活性增强,产生更多的H2和CO2供甲烷菌利用。这也表明经菌株T5发酵的酒糟饲喂反刍动物,可能达到一定的减排作用。瘤胃NH3-N浓度能反映瘤胃氮代谢,也能间接反映瘤胃微生物分解饲料CP产生NH3-N和利用NH3-N合成MCP的平衡情况[45]。因为酒糟发酵过程中添加了尿素,再加上体外发酵过程中产生的NH3-N不能经瘤胃上皮吸收,所以试验结果中的NH3-N质量浓度高于正常范围值[46]。本研究MCP质量浓度差异不显著,而T5发酵组的NH3-N质量浓度高于对照组,说明经菌株T5发酵后的酒糟蛋白质可能更容易被瘤胃微生物利用分解成NH3-N。此外研究发现发酵组的IVDMD显著高于对照组,这可能是因为酒糟经发酵后,非结构性碳水化合物和可消化有机物含量增加,也可能与对照组相比,发酵组的碳氮比更适于瘤胃微生物的利用。
VFA是维持反刍动物生长和生产的主要能量来源,能提供反刍动物能量需要的70%~80%,其中乙酸、丙酸和丁酸约占瘤胃发酵产生TVFA的95%左右[42]。本课题组前期探索了不同酒糟的瘤胃发酵特性,发现不同酒糟NDF含量与乙酸含量呈负相关,与丙酸含量呈正相关[47]。Gastelen等[48]报道,高淀粉含量倾向于丙酸的生成,低淀粉含量倾向于乙酸的生成。研究表明目前还没有确切的经验模型或化学计量模型对瘤胃VFA产量和比例进行准确的预测[49]。一般而言,经白酒酿造后,白酒糟的淀粉含量低,但本研究发酵组的各VFA和TVFA质量浓度均高于对照组。分析其原因可能是对照组由于含有较高比例的致密性结构碳水化合物,导致瘤胃纤维降解菌不能充分利用,而发酵酒糟经微生物作用后,木质纤维降解成可利用的碳水化合物,可消化养分增加,因此表现为各VFA含量均有所升高。此外菌株的甲基红试验呈阳性,证明菌株能利用葡萄糖产生甲酸、乙酸和乳酸等有机酸。在烘干过程中会有部分挥发,但培养基中仍会有部分有机酸残留,这也是VFA质量浓度均升高的原因之一。
4 结 论
经鉴定菌株T5为Cohnellaxylanilytica,其在最佳工艺条件下发酵酒糟,可以破坏酒糟的结构,降解纤维含量,提高蛋白含量。初步评定该发酵酒糟在反刍动物上应用具有减少甲烷能损失,改善能量供应和营养物质利用率的作用。因此菌株T5具有改善白酒糟营养价值的效果,一定程度上可作为饲料资源开发的候选菌株。