西兰花芽提取物体外抗肿瘤活性及作用机制研究
2022-05-17毛佳奇游海曦孙瑜阳刘军刘海杰
毛佳奇,游海曦,孙瑜阳,刘军,刘海杰*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
癌症是一种慢性非传染性疾病,病死率高[1],在全球近100个国家中,癌症被列为过早死亡的最主要原因[2]。据估计,全世界范围内患癌风险约为40%,这一趋势还在继续增加[3]。结直肠癌是消化系统常见的癌症,也是世界上第三大常见癌症[4]。肝癌也是最常见的前六大癌症之一,其中肝细胞癌占原发性肝癌的85%~90%[5]。因此,结肠癌和肝癌的预防对人体健康十分重要。1981年到2014年,美国批准的175种小分子抗癌药物中,有49%的抗癌药物来源于天然产物[6]。此外,有研究表明,一些植物性食物,如红枣、蓝莓、十字花科蔬菜、辣木等,对肿瘤的预防和治疗具有有益作用[7-10]。
西兰花是十字花科芸薹属一年到两年生植物,含有丰富的维生素、花色苷、硫代葡萄糖苷和芥子酸[11]等生物活性成分。硫代葡萄糖苷,简称硫苷,是一类含硫和氮的阴离子亲水性植物次生代谢产物[12],目前在西兰花中已经检测到16种硫苷。萝卜硫苷是西兰花中含量最高的硫苷,约占总硫苷的50%[13]。植物组织受到破坏或在肠道微生物的作用下,萝卜硫苷被黑芥子酶催化发生水解反应,生成萝卜硫素[14]。萝卜硫素是迄今为止发现的抗癌作用最强的天然植物活性成分,在西兰花种子及芽苗中含量较多[15]。西兰花芽已被证明具有多种不同的生理活性,在抑菌[16-17]、抗氧化[18]、抗肿瘤[19-20]、预防高血压和动脉粥样硬化等疾病[21-22]方面发挥重要作用。因此,西兰花芽具有用作功能食品原料的潜力,对其抗肿瘤活性进行深入研究可以为西兰花芽提取物的研究和西兰花功能食品的开发提供参考。
前期已探索出西兰花芽富集生物活性物质的发芽条件,发现电解水处理后西兰花芽中萝卜硫素前体物质和提取率得到明显提高[23]。结肠癌细胞株Caco-2和肝癌细胞株HepG2是结肠癌和肝癌体外实验研究最常用的细胞模型[24-26]。因此,本文以CaCl2电解水处理的西兰花芽为研究对象,选择Caco-2和HepG2两种细胞株,评价西兰花芽提取物对结肠癌和肝癌细胞的增殖抑制作用,并对其促进结肠癌细胞凋亡的机制进行研究。
1 材料与方法
1.1 材料与试剂
“中青12号”西兰花种子:中蔬种业科技有限公司;结肠癌Caco-2细胞、肝癌HepG2细胞:西北农林科技大学食品营养与健康研究室。
比色试剂:日本KRK笠原理化工业株式会社;MEM培养基:美国Gibco公司;DMEM培养基:美国Hyclone公司;噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]:美国 sigma 公司;活性氧(reactive oxygen species,ROS)检测试剂盒:上海碧云天生物技术有限公司;5-氟尿嘧啶(5-fluorouracil,5-FU)、线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(JC-1):北京索莱宝科技有限公司;Annexin V-FITC/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒:上海翊圣生物科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
PRX-450C智能人工气候箱:宁波赛福实验仪器有限公司;RC-3F高浓度有效氯素计:日本KRK笠原理化工业株式会社;MP523型pH测量仪:上海三信仪器仪表有限公司;CyFlow Cube 6型流式细胞仪:德国PARTEC公司;LS-CO150型二氧化碳细胞培养箱:美国Thermo Scientific公司;SpectraMax M2型多功能微孔板检测仪:Molecular Devices公司;IX71倒置荧光显微镜:日本Olympus公司。
1.3 方法
1.3.1 西兰花芽制备
CaCl2电解水的配制:称取一定量无水CaCl2,使用自来水(tap water,TW)溶解并定容。将溶液倒入实验室自制电解槽中,电流恒定为3 A,电解(28.88±1.55)s后,使用比色试剂和高浓度有效氯素计检测电解水的有效氯浓度(available chlorine concentration,ACC),得到含有20 mmol/L CaCl2的电解水溶液。不同处理液的理化指标如表1所示。
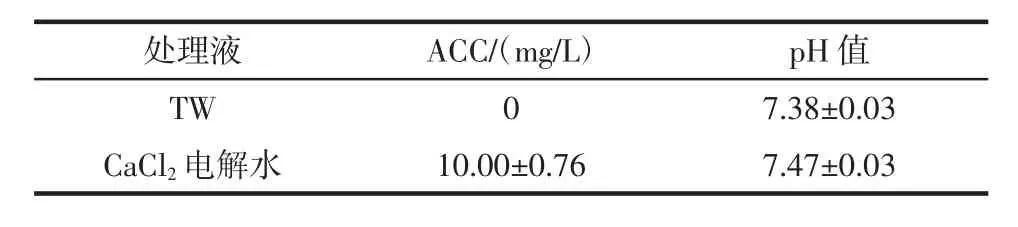
表1 不同处理液的理化指标Table 1 The parameter of different solutions
发芽参照Li等[23]的方法并稍作修改。称取6 g西兰花种子,加入90 mL上述制备好的CaCl2电解水,25℃黑暗条件下静置3 h。浸种后均匀播种于铺有纱布的长方形盘中,发芽盘下层倒入制备好的上述电解水,以TW组作为阴性对照。发芽温度设为25℃,相对湿度设为80%,光照强度为100%,每天喷淋3次,每隔2 d换一次水。培养6 d后收芽,西兰花芽经过48 h冻干,研磨,过80目筛,储存于-20℃冰箱备用。
1.3.2 西兰花芽提取物的制备
称取1 g西兰花芽冻干粉,加入4 mL蒸馏水,25℃水解8 h,在离心管中加入5 g氯化钠和3.75 g无水硫酸钠。加入4 mL二氯甲烷,混匀,100%功率超声辅助提取30min,以5000r/min在4℃离心15min,无水硫酸钠过滤,重复上述提取步骤3次。将上清液在30℃旋转蒸发,加入二甲基亚砜复溶至样品终浓度为200mg/mL,得到TW和20 mmol/L CaCl2电解水处理的西兰花芽提取物(简称为TW组和CaCl2组)。使用前用无血清培养基将提取液稀释至工作浓度。
1.3.3 细胞培养
Caco-2细胞使用DMEM培养基,HepG2细胞使用MEM培养基,培养基中加入1%青霉素-链霉素。完全培养基需加入10%胎牛血清,配制好后密封,储存于4℃冰箱备用。细胞置于37℃培养箱中进行培养,胰蛋白酶收集细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞,每隔2 d换液,每隔2 d~4 d传代。
1.3.4 形态学观察
细胞生长面积达到80%~90%时,制备单细胞悬液,使用血球计数板计数,将Caco-2和HepG2细胞浓度分别调整至5×104个/mL和1×105个/mL,每孔加入2 mL细胞悬液。贴壁培养12 h后,更换为1.8 mL无血清培养基,加入200 μL浓度为0.045、0.180 mg/mL的西兰花芽提取物,对照组加入等体积的培养基。加入样品48 h后,放大100倍观察细胞形态。
1.3.5 细胞增殖抑制率测定
采用MTT法检测西兰花芽提取物对Caco-2和HepG2细胞的增殖抑制率[27]。在96孔板中加入调整浓度后的细胞悬液,使得Caco-2细胞为5 000个/孔,HepG2细胞为1×104个/孔,边缘孔加入PBS。培养12 h后,更换为90 μL无血清培养基,每孔加入10 μL西兰花芽提取物,样品最终浓度分别为0.006、0.011、0.023、0.045、0.090、0.180 mg/mL,每个处理设 6 个复孔,以无血清培养基和0.01 mg/mL 5-FU为对照。加入提取物培养24 h后移除培养基,避光加入100 μL 0.5 mg/mL的MTT溶液。37℃孵育4 h,将MTT溶液更换为二甲基亚砜溶液,37℃避光振荡15 min,测定490 nm处吸光值。按照下列公式计算西兰花芽提取物对Caco-2细胞和HepG2细胞的抑制率,并采用Graphpad Prism 7.0计算半数抑制浓度(half maximal inhibitory concentration,IC50)。
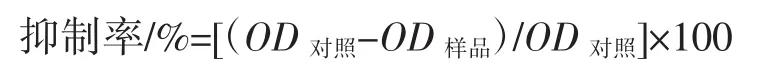
式中:OD对照为对照组吸光值;OD样品为样品组吸光值。
1.3.6 细胞凋亡率的测定
细胞培养12 h后,将Caco-2细胞的浓度调整为1×105个/mL,在6孔板中加入1.8mL细胞悬液和200μL浓度为0.180 mg/mL的西兰花芽提取物,对照组加入等体积的培养基,继续培养24 h。将培养液收集至离心管中,加入1 mL胰酶消化贴壁细胞,摇匀,吸出800 μL胰酶,待细胞间隙增大时终止消化,收集细胞至之前的离心管中,1 000 r/min离心5 min。按照试剂盒说明书染色,设置Annexin V-FITC和PI单染组,避光放置15 min,混匀后上机检测。
1.3.7 ROS水平测定
使用2’,7’-二氯荧光黄双乙酸盐作为荧光探针测定细胞ROS水平[28]。调整Caco-2细胞浓度为1×105个/mL,接种细胞至6孔板中培养12 h,各孔中分别加入 1.8 mL的完全培养基、200 μL浓度为 0.045、0.180 mg/mL的西兰花芽提取物,对照组加入等体积的培养基。培养24 h后,移除培养液,加入1 mL稀释后的2’,7’-二氯荧光黄双乙酸盐,混匀,孵育 30 min,无血清培养基洗涤3次,在倒置荧光显微镜下观察绿色荧光。
1.3.8 MMP测定
使用线粒体特异性亲脂阳离子荧光染料JC-1测定MMP[27]。调整Caco-2细胞浓度为5×104个/mL,培养12 h后,加入浓度为0.045、0.180 mg/mL的西兰花芽提取物,对照组加入等体积的培养基,继续培养24 h,PBS洗涤细胞,加入完全培养基和稀释后的JC-1染色液,混匀,培养箱中静置30 min。用缓冲液洗涤2次,加入无血清培养基,随后将6孔板置于显微镜下,放大100倍观察红绿荧光。定量检测方法操作步骤同上,在96孔板中培养细胞12 h,加入西兰花芽提取物继续培养24 h,之后加入JC-1染色液,使用荧光酶标仪检测绿色荧光和红色荧光,计算二者比值。
1.3.9 统计与分析
所有试验均进行3次重复试验,数据采用SPSS 26软件进行单因素ANOVA分析,采用Duncan多重比较,p<0.05,表示差异显著,采用Graphpad Prism 7.0绘制图形,结果以平均值±标准误差表示,Annexin-VITC/PI双染色结果采用FlowJo软件分析。
2 结果与分析
2.1 西兰花芽提取物对Caco-2和HepG2细胞形态的影响
西兰花芽提取物对Caco-2和HepG2细胞形态的影响见图1。
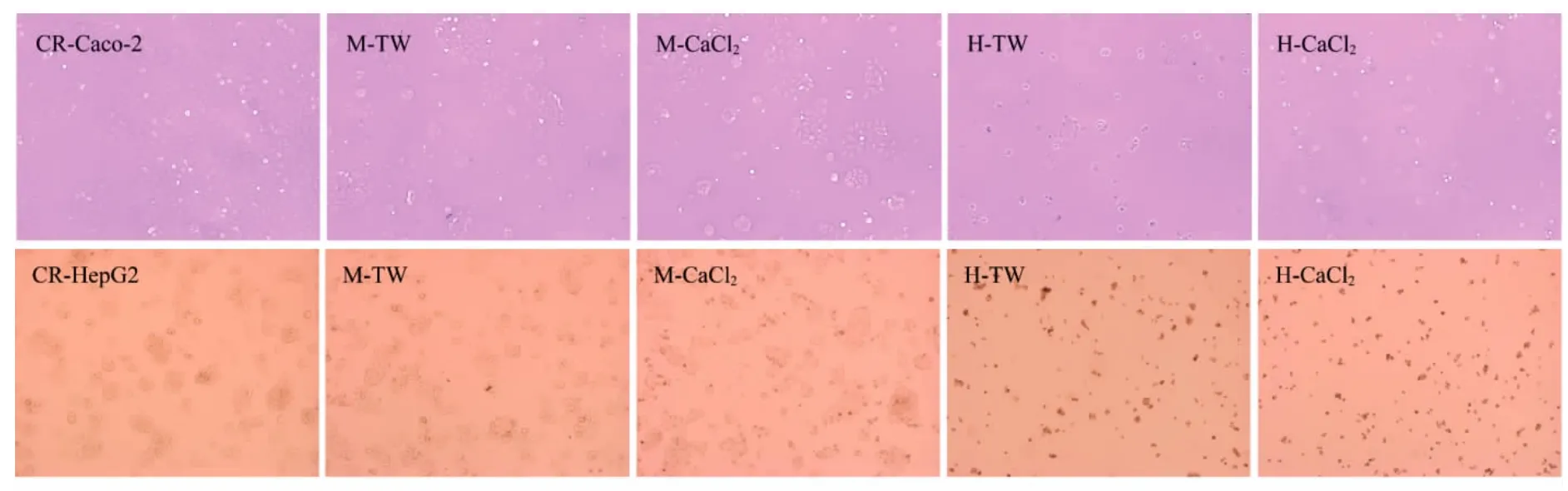
图1 西兰花芽提取物对Caco-2和HepG2细胞形态的影响(100 x)Fig.1 Effects of broccoli sprouts extracts on the morphology of Caco-2 and HepG2 cells(100 x)
如图1所示,经过不同浓度的西兰花芽提取物处理后的Caco-2和HepG2细胞形态明显不同。对照组Caco-2和HepG2细胞紧贴培养皿,生长良好,Caco-2细胞紧密相连,呈不规则多边形,HepG2细胞呈梭形。0.045 mg/mL西兰花芽提取物作用48 h后,细胞密度下降,部分细胞形态发生改变,细胞内空泡开始增多,表明细胞贴壁性减弱,出现死细胞迹象;与TW组相比,CaCl2组Caco-2细胞中空泡细胞增多,HepG2细胞圆点增多。提取物浓度增加至0.180 mg/mL时,细胞数量进一步减少,细胞明显变圆缩小。结果表明,不同浓度的西兰花芽提取物可使Caco-2和HepG2细胞形态发生明显变化。
2.2 西兰花芽提取物对Caco-2和HepG2细胞增殖的影响
西兰花芽提取物对Caco-2和HepG2细胞增殖的影响见图2。
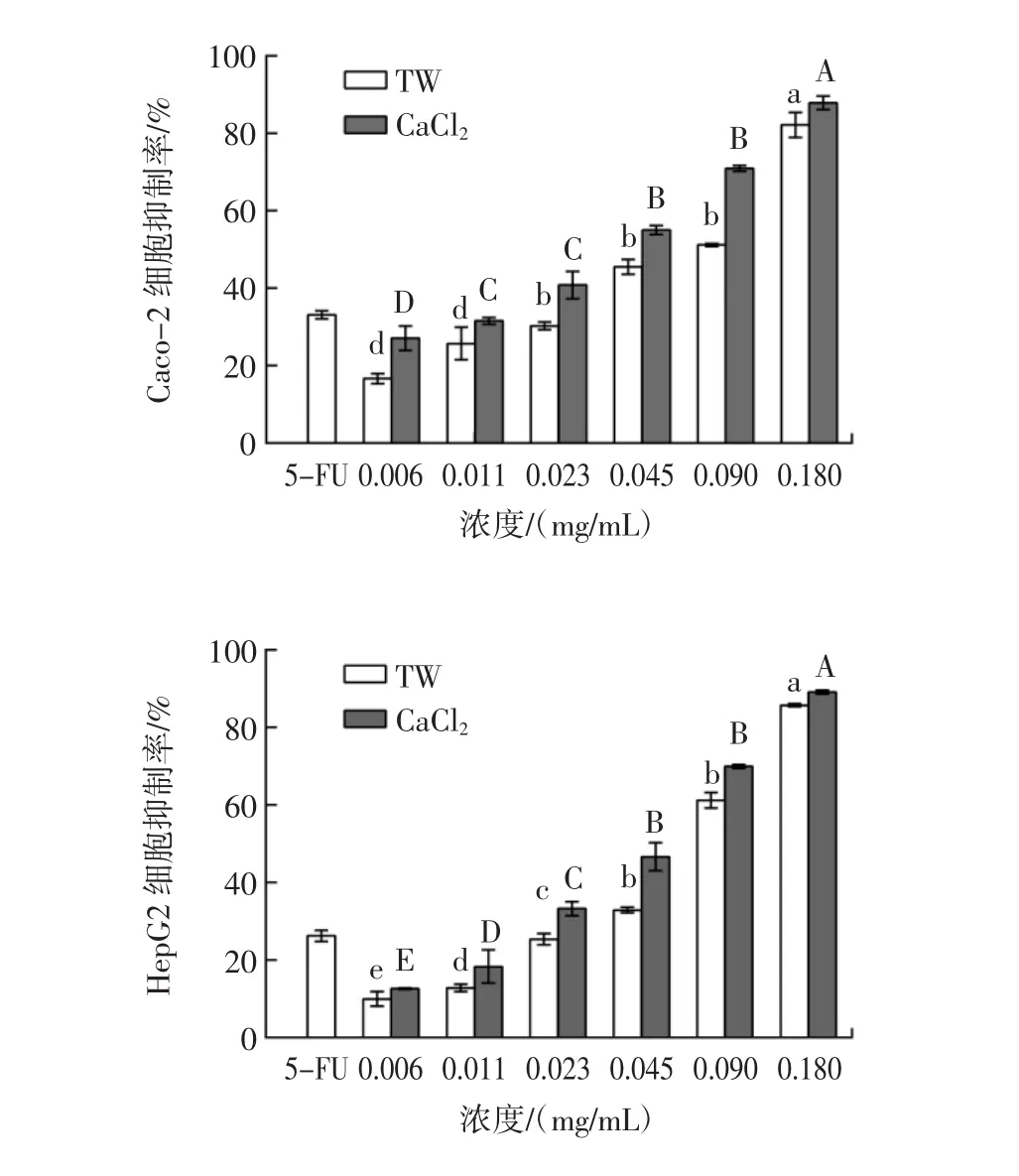
图2 西兰花芽提取物对Caco-2和HepG2细胞增殖的影响Fig.2 Effects of broccoli sprouts extracts on the proliferation of Caco-2 and HepG2 cells
由图2可知,西兰花芽提取物使Caco-2和HepG2细胞生长受到抑制,且呈浓度依赖效应。与TW组相比,CaCl2组西兰花芽提取物对Caco-2和HepG2细胞的抑制作用增强。TW组对Caco-2和HepG2细胞的IC50值分别为(0.053±0.004)、(0.060±0.003)mg/mL,而CaCl2组的 IC50值分别为(0.030±0.002)、(0.043±0.004)mg/mL。对照组5-FU对Caco-2和HepG2细胞的抑制率分别为33.14%和26.27%,抗增殖效果优于同浓度西兰花芽提取物。Pako等[29]研究冻干西兰花和西兰花芽对肝癌HepG2细胞和结直肠癌SW480细胞的毒性,结果表明1 mg/mL~2.5 mg/mL西兰花芽和西兰花均显著降低了HepG2和SW480的细胞活力,且对前者的作用更明显。Le等[18]研究表明西兰花芽乙醇提取物可以抑制A549(肺癌细胞)、HepG2和Caco-2细胞增殖,且IC50值分别为0.117、0.168、0.189 mg/mL。此外,Xu等[30]从西兰花中分离纯化出水溶性多糖,当西兰花水溶性多糖浓度为2 mg/mL时,可抑制肝癌HepG2细胞、宫颈癌Siha细胞和乳腺癌MDA-MB-231细胞增殖,本研究所用西兰花芽提取物对Caco-2和HepG2细胞具有更低的IC50值。
2.3 西兰花芽提取物对Caco-2细胞凋亡率的影响
西兰花芽提取物对Caco-2细胞凋亡率的影响见图3。
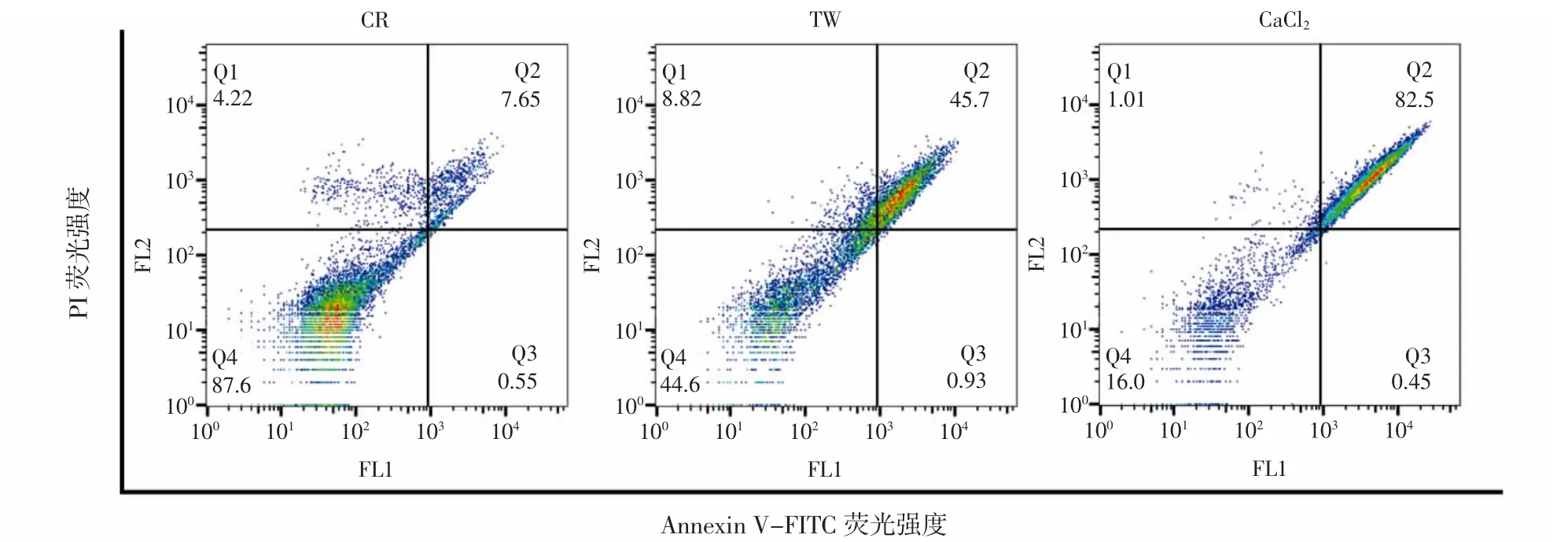
图3 高浓度西兰花芽提取物对Caco-2细胞凋亡的影响Fig.3 Effects of high concentration broccoli sprouts extracts on apoptosis of Caco-2 cells
采用Annexin-VITC/PI双染色法对处于凋亡各阶段的细胞进行定量检测。如图3所示,经过西兰花芽提取物处理后,西兰花芽提取物显著诱导Caco-2细胞发生凋亡,TW和CaCl2组凋亡细胞的比例分别为46.63%和82.95%,此外,晚期凋亡细胞数量高于早期凋亡细胞。Pako等[29]研究2.5 mg/mL西兰花和西兰花芽甲醇提取物对结直肠癌SW480细胞和肝癌HepG2细胞的影响,发现西兰花芽提取物对SW480细胞具有显著的促凋亡(77.4%)作用,对HepG2细胞毒性作用较大(坏死50%,凋亡20.9%)。与其不同的是,本研究发现西兰花芽提取物浓度在0.180 mg/mL时显著促进Caco-2细胞凋亡。
2.4 西兰花芽提取物对Caco-2细胞ROS水平的影响
西兰花芽提取物对Caco-2细胞ROS水平的影响见图4。
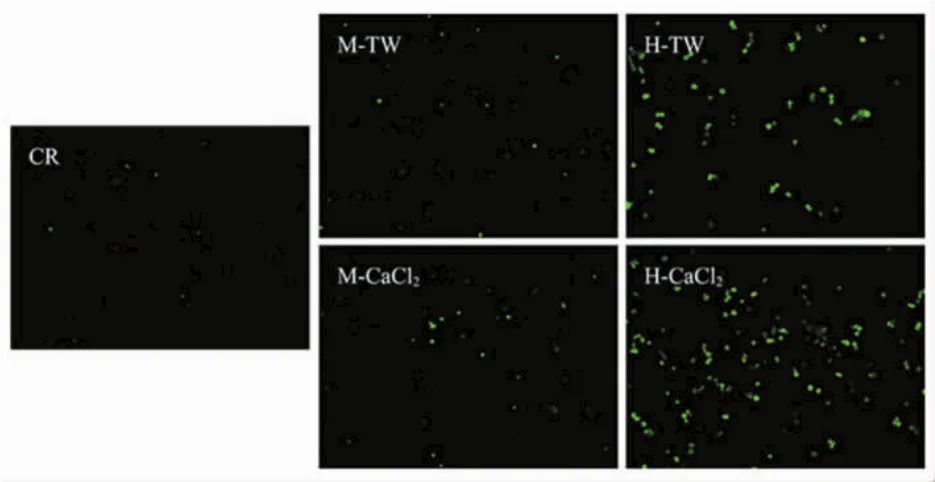
图4 中高浓度西兰花芽提取物诱导Caco-2细胞产生ROSFig.4 Medium and high concentration broccoli sprouts extracts induce Caco-2 cells to produce ROS
ROS水平已被证明是影响细胞死亡和存活的因素,ROS代谢紊乱时可能导致细胞蛋白质、脂质和DNA损伤并引发神经退行性疾病[31]。研究表明,ROS可以激活肿瘤抑制蛋白p53,下调促凋亡蛋白Bcl-2、Bcl-XL、IAPs和survivin[32],上调促凋亡因子,增强线粒体膜的通透性[33]。通过荧光染色的方法检测西兰花芽提取物作用后胞内ROS的水平。如图4所示,与对照组相比,加入西兰花芽提取物后,胞内ROS生成增多,且呈浓度依赖效应;与TW组相比,CaCl2组诱导Caco-2细胞产生的绿色荧光增强,结果表明,西兰花芽提取物可能通过诱导Caco-2细胞产生ROS来抑制细胞增殖并促进细胞凋亡。
2.5 西兰花芽提取物对Caco-2细胞线粒体膜电位的影响
西兰花芽提取物对Caco-2细胞线粒体膜电位的影响见图5。
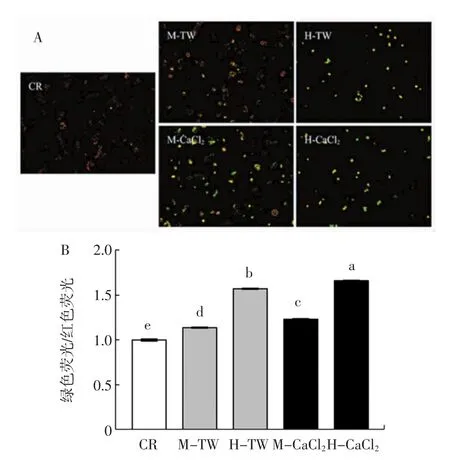
图5 中高浓度西兰花芽提取物对Caco-2细胞线粒体膜电位的影响Fig.5 Effects of medium and high concentration broccoli sprouts extracts on mitochondrial membrane potential of Caco-2 cells
线粒体膜电位下降是细胞线粒体早期损伤的特征之一,由于呼吸链电子转移,大多数ROS产生于线粒体中[34],ROS与线粒体调控凋亡通路的激活密切相关。线粒体来源的ROS可使线粒体mtDNA氧化损伤,mtDNA损伤会损害电子传递链相关蛋白的mtRNA转录,损伤呼吸链功能,进一步增加ROS的产生,引起线粒体膜电位改变,造成ATP合成受损,从而导致细胞凋亡[35]。
由图5A可知,随着西兰花芽提取物浓度升高,绿色荧光细胞增多,红色荧光细胞减少;高浓度样品组分布着发绿光的细胞,与对照组相比,几乎不出现红色荧光,且细胞数量减少,与形态学观察结果一致。如图5B所示,与对照组相比,中高浓度TW组绿色荧光/红色荧光比值显著提高1.14倍和1.57倍(p<0.05),即线粒体膜电位降低,线粒体出现功能损伤。CaCl2组西兰花芽提取物可进一步显著降低线粒体膜电位,绿色荧光/红色荧光比值分别提高1.23倍和1.66倍。该结果表明,西兰花芽提取物可通过诱导Caco-2细胞线粒体出现功能损伤来抑制细胞增殖,诱导细胞发生凋亡。
3 结论
本试验研究了西兰花芽提取物对结肠癌Caco-2细胞和肝癌HepG2细胞的影响,观察细胞形态发现,0.180 mg/mL西兰花芽提取物可使Caco-2和HepG2细胞贴壁性减弱,细胞密度下降,并呈现死细胞迹象。西兰花芽提取物作用24 h后,可显著抑制Caco-2和HepG2细胞增殖,TW组对Caco-2和HepG2细胞的IC50值分别为(0.053±0.004)、(0.060±0.003)mg/mL,而CaCl2组为(0.030 ± 0.002)、(0.043 ± 0.004)mg/mL。细胞凋亡结果显示,CaCl2组细胞发生凋亡的比例为82.95%。此外,结肠癌Caco-2细胞对西兰花芽提取物敏感,西兰花芽提取物通过诱导细胞产生ROS,降低线粒体膜电位,可造成细胞线粒体功能损伤,激活线粒体凋亡途径,最终导致Caco-2细胞凋亡。综上所述,西兰花芽提取物具有显著抑制结肠癌Caco-2细胞和肝癌HepG2细胞增殖及促进Caco-2细胞凋亡的作用,西兰花芽可以作为具有抗癌作用的植物性食品,用于功能食品的开发。
