白云石制备似立方体状方解石型碳酸钙晶体及其机理研究
2022-05-17邓晓阳曲笑原凡远洋刘海利曹笑宁
邓晓阳,郑 强,曲笑原,凡远洋,刘海利,曹笑宁,岳 岩,李 雪,2
(1.沈阳化工大学化学工程学院,辽宁省化工应用重点实验室,沈阳 110142;2.辽宁精细化工协同创新中心,沈阳 110142)
0 引 言
白云石的化学式为CaMg(CO3)2,其资源储量丰富,是重要的钙镁原料[1]。白云石的主要应用领域包括建材、化学、农业、环保等[2-4]。然而现阶段白云石的利用程度仍较低,典型利用方式,如机械破碎为石粉、煅烧后做土壤改良剂或气体吸附剂[5-6]会造成钙镁资源的流失。为提高白云石资源利用价值,需对白云石进行精深加工,生产高端镁钙材料,例如碳酸钙晶须和似立方体状碳酸钙等。
碳酸钙有三种晶型,分别为方解石型(calcite)、文石型(aragonite)、球霰石型(vaterite)[7]。其中方解石型在热力学上最稳定,而球霰石与文石型均不稳定,易发生晶型转化[8]。而在方解石型碳酸钙家族中,似立方体状碳酸钙很受市场欢迎。用其作为无机填充材料具有分散性好、粒度均匀等优异特性,所以被广泛地用于橡胶、造纸、医药等领域[9-11]。目前似立方体状碳酸钙的合成方法主要有碳酸化法、间隙鼓泡法、消化法等[12-14]。然而上述方法均使用了晶型控制剂,工艺复杂,工业化难度大。本实验在不使用晶型控制剂的情况下,以轻烧白云石矿粉为原料,氯化铵为浸取剂,CO2为沉淀剂,采用气液接触法制备出了形貌规整、粒径分布均匀的似立方体状碳酸钙晶体,为高值化利用白云石资源提供参考。
1 实 验
1.1 产品制备
原料:白云石粉、氯化铵(99.8%)、蒸馏水、CO2气体(99.9%)。
先将白云石粉置于马弗炉中以850 ℃煅烧4 h,将得到的轻烧白云石粉(成分如表1所示)与氯化铵溶液混合,反应后过滤得到滤渣与精制液。然后向精制液中通入固定流量的CO2一定时间,在预设的温度和搅拌速率下进行反应,反应完成后进行陈化。将得到的料浆过滤,用蒸馏水多次洗涤。将滤饼置于105 ℃的烘箱内干燥12 h,得到碳酸钙产品。

表1 轻烧白云石粉的组成Table 1 Composition of light calcined dolomite powders
1.2 样品表征
(1)表征分析
使用德国Bruker公司的D8型X射线衍射(XRD)仪测定样品物相组成,测试条件: Cu靶,K射线,步长是0.05(°)/s,扫描范围为5°~90°,管电压为40 kV,管电流为40 mA。
采用日立SU8010 N型扫描电子显微镜(SEM)测定样品微观形貌。
(2)碳酸钙中各晶型含量的测定
利用Kontoyannis公式,根据各晶型的特征衍射峰:文石晶型的(221)面、方解石晶型的(104)面和球霰石晶型的(110)面所对应的积分强度计算出CaCO3中各晶型的摩尔含量(%)[15]。
对于文石型与方解石型所组成的碳酸钙晶体,文石型与方解石型的相对含量可由公式(1)进行计算。
(1)
对于球霰石型与方解石型所组成的碳酸钙晶体,球霰石型与方解石型的相对含量由公式(2)进行计算。
(2)
对于球霰石型、文石型与方解石型这三相所组成的碳酸钙晶体,其中各晶型相对含量由公式(3)进行计算。
(3)

2 结果与讨论
图1为轻烧白云石粉与氯化铵溶液蒸氨反应后所得滤渣的XRD图谱。图中只有MgO与Mg(OH)2的衍射峰,未发现其他杂质的衍射峰。这说明白云石中的钙元素已被提取,此反应产物可以在镁建材等领域充当原料。

图1 滤渣的XRD图谱Fig.1 XRD pattern of residue
2.1 反应温度对于碳酸钙晶体形貌的影响
溶液中钙离子浓度0.35 mol/L,通气速率100 mL/min,搅拌速率400 r/min,改变反应温度为30 ℃、35 ℃、40 ℃、45 ℃和50 ℃进行实验。结果如图2~4所示。

图2 不同反应温度所制得的碳酸钙SEM照片Fig.2 SEM images of calcium carbonate prepared at different reaction temperatures
从图3中可以看出,三种不同形态晶体的化学成分均为碳酸钙。在反应温度为30 ℃时(见图2(a)),产品由球霰石型碳酸钙和方解石型碳酸钙组成,球状晶体的粒径较大,约为10 μm;在反应温度为35 ℃时(见图2(b)),样品中出现不规则块状晶体,其表面有少量碎晶;反应温度为40 ℃时(见图2(c)),样品中可观察到似立方体状碳酸钙,此时晶体形貌较35 ℃所制得的晶体形貌更加规整且分散性更好,晶体粒径为5~10 μm;反应温度为45 ℃时(见图2(d)),碳酸钙晶体变得不规整而且团聚严重;反应温度为50 ℃时(见图2(e)),生成了花团状文石晶型碳酸钙,团聚现象有所减轻。

图3 三种形貌碳酸钙SEM照片(a)~(c)和EDS谱图(d)~(f)分析结果Fig.3 SEM images (a)~(c) and EDS spectra (d)~(f) of three morphologies of calcium carbonate
碳酸钙等化合物的结晶过程需要一定能量来克服其本身结晶所需的最低能量[16]。由于球霰石的稳定性小于文石与方解石,所以更高的温度利于文石与方解石的生长。从图4可以看出:在反应温度为30 ℃时,碳酸钙晶型为球霰石型;而反应温度为35 ℃至45 ℃时,碳酸钙晶型为方解石型。说明反应温度的升高利于方解石的生成而不利于球霰石的生成,这与此前研究[17-18]的结论基本一致。当温度升高时,反应速率与晶体的生长速率会随之提高[19],球霰石型不稳定易转化为其他晶型。因此温度变化造成了晶型变化,这与Feng等[20-21]的结论相同。当反应温度进一步升高至50 ℃时,在图2(e)中观察不到似立方状晶体,样品为文石型的花团状CaCO3,这说明更高的反应温度利于文石的形成。结合以上结论,选取40 ℃为最佳反应温度。
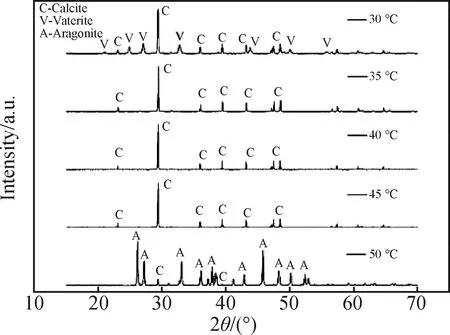
图4 不同反应温度对于碳酸钙晶体的晶型影响Fig.4 Effect of different reaction temperature on crystal form of calcium carbonate
2.2 Ca2+浓度对于碳酸钙晶体形貌的影响
为探究溶液中Ca2+浓度对碳酸钙晶体形貌的影响,设定反应温度40 ℃,通气速率100 mL/min,搅拌速率400 r/min,改变溶液中Ca2+浓度进行实验。当Ca2+浓度低于0.025 mol/L时,浓度极低,应用价值不高,同时反应速率较低,反应推动力不足,实验价值较低。故本实验选取Ca2+浓度最低值为0.025 mol/L。将实验得到的碳酸钙产品进行表征,结果如图5~7所示。

图7 不同Ca2+浓度制得的碳酸钙晶体中各晶型的组成Fig.7 Composition of various crystal forms in calcium carbonate crystal prepared with different Ca2+ concentration
从图5(a)~(c)可以看出:在Ca2+浓度为0.95 mol/L至0.45 mol/L时,碳酸钙晶体由大晶块和小碎晶块混合而成,而且晶体的分散性不好,形貌不规整;当Ca2+浓度为0.30 mol/L时(见图5(d)),能观察到样品中存在近似立方状小碎晶块;当Ca2+浓度为0.15 mol/L时(见图5(e)),虽然样品中仍存在少量碎晶,但是较大晶体的形貌较为规整;当Ca2+浓度为0.05 mol/L时(见图5(f)),此条件下碳酸钙晶体的形貌最规整;当Ca2+浓度为0.025 mol/L时(见图5(g)),碳酸钙的形貌变化不大。从图6、7中可以看出,在Ca2+浓度为0.90 mol/L至0.15 mol/L时,其产物碳酸钙均为方解石型,其特征衍射峰强度大,方解石型含量均为100%(摩尔分数,下同);反应物浓度降低至0.05 mol/L时,样品中存在极少量的文石型碳酸钙,其含量为2.24%;当反应物浓度为0.025 mol/L时,样品中文石晶型含量有所上升,为3.27%。
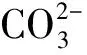
在Ca2+浓度为0.05 mol/L与0.025 mol/L的情况下,有形貌规整的方解石晶型碳酸钙出现。而Ca2+浓度为0.025 mol/L时,样品中文石晶型含量较高,同时考虑应用价值,所以选择Ca2+浓度0.05 mol/L为最佳实验条件。
2.3 通碳速率与搅拌速率对于碳酸钙晶体形貌的影响
2.3.1 通碳速率对于碳酸钙成晶的影响
为探讨通碳速率对碳酸钙晶体的影响,设定反应温度40 ℃,Ca2+浓度0.05 mol/L,搅拌速率400 r/min,改变通碳速率进行实验。结果如图8~10所示。
从图8(a)与图8(b)中可以看出,当通碳速率为25 mL/min与50 mL /min时,样品由针状碳酸钙和似立方状碳酸钙组成,同时样品的分散性不好;当通碳速率为100 mL /min时(见图8(c)),能观察到样品为形貌规整的似立方体碳酸钙;通碳速率增加至150 mL /min时(见图8(d)),样品由似立方状碳酸钙与球状碳酸钙组成,且样品的堆积程度较高;通碳速率为200 mL /min时(见图8(e)),样品中球状碳酸钙所占比例上升,几乎观察不到似立方体状碳酸钙。
综合图9与图10可以看出,碳酸钙各晶型含量随通碳速率变化发生了较大变化。在低通碳速率范围(≤100 mL/min)下,碳酸钙由文石晶型和方解石晶型组成。文石晶型含量随通碳速率升高而降低,直至消失。方解石晶型含量随通碳速率升高而先升高后下降,在通碳速率为100 mL/min时其含量最高,此时样品中不存在其他晶型。同时从图10中可以看出,碳酸钙中球霰石晶型只在通碳速率大于100 mL/min时出现,继续提高通碳速率时球霰石晶型含量明显上升。而方解石晶型的含量在通碳速率高于100 mL/min时明显下降,故选择100 mL/min为最佳通碳速率。
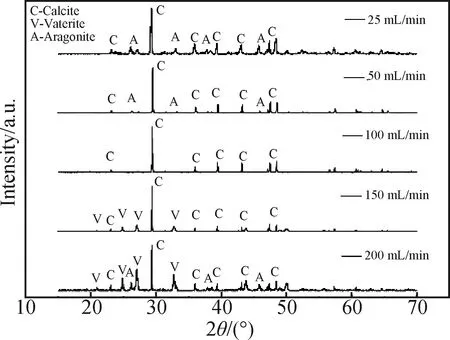
图9 不同通碳速率制得的碳酸钙晶体的XRD图谱Fig.9 XRD patterns of calcium carbonate crystal prepared at different carbon passing rates
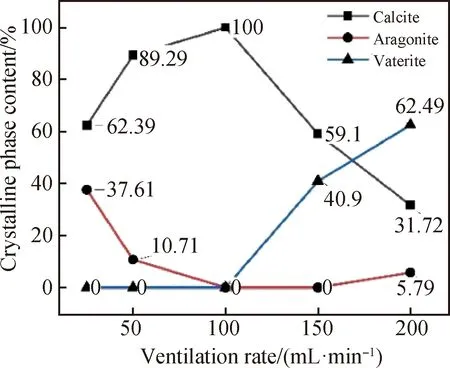
图10 不同通碳速率制得的碳酸钙晶体中各晶型的组成Fig.10 Composition of various crystal forms in calcium carbonate crystal prepared at different carbon passing rates
2.3.2 搅拌速率对于碳酸钙成晶的影响
为探讨搅拌速率对碳酸钙晶体的影响,设定反应温度40 ℃,Ca2+浓度0.05 mol/L,通碳速率100 mL/min,改变搅拌速率进行实验,结果如图11~13所示。
第二阶段:占比急速下降阶段.这一阶段指从1992年开始至1996年.在这5年中世界甘薯总产量相对稳定,但中国甘薯总产量有所下滑,导致中国甘薯出口占世界甘薯出口贸易额的比重急速下降,由90%左右降至1996年的12.5%.

图11 不同搅拌速率制得的碳酸钙晶体SEM照片Fig.11 SEM images of calcium carbonate crystal prepared at different stirring rates
在搅拌速率100 r/min的条件下(见图11(a)),出现了枝状碳酸钙与似立方体状碳酸钙;调节搅拌速率为200 r/min与300 r/min时(见图11(b)、(c)),此时样品由碳酸钙微球和似立方体碳酸钙构成,这两种结构中均存在空洞,同时晶体的形貌不规整;搅拌速率为400 r/min时(见图11(d)),碳酸钙晶体的形貌规整,粒径均匀;从图11(e)与图11(f)中可以看出,当搅拌速率高于400 r/min时,产物由球状碳酸钙与似立方状碳酸钙混合而成,同时样品粒径不均匀。
搅拌速率对碳酸钙的晶型组成有很大影响。图12为不同搅拌速率制得的碳酸钙的XRD图谱,图13为其各晶型组成。可以看出,在搅拌速率为100 r/min时,样品由枝状文石型碳酸钙与方解石型碳酸钙组成,文石晶型含量为46.29%,方解石晶型含量为53.71%;搅拌速率为400 r/min时,碳酸钙均为方解石晶型。当搅拌速率高于400 r/min时,样品中球霰石晶型含量逐渐上升,方解石晶型含量逐渐下降,文石晶型含量一直保持极低水平。综合以上实验结果,选取400 r/min为最佳反应条件。
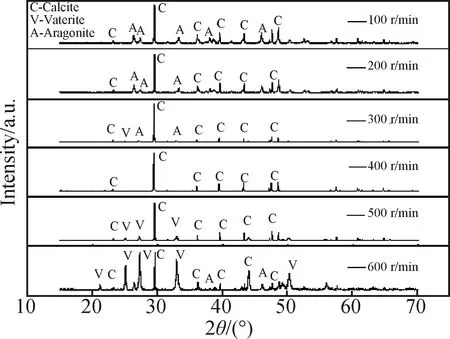
图12 不同搅拌速率制得的碳酸钙的XRD图谱Fig.12 XRD patterns of calcium carbonate crystal prepared at different stirring rates
2.3.3 通碳速率与搅拌速率对于碳酸钙晶体形貌的影响机理分析
在此体系中碳酸钙的形成过程中主要有以下反应。
CO2由气相转变为液相:
CO2(g)→CO2(aq)
(4)
NH3·H2O在溶液中的解离:
(5)
CO2的第一步反应:
(6)
碳酸氢根反应形成碳酸根:
(7)
碳酸钙沉淀的生成:
(8)
由反应式(4)~(8)的反应方程式,可以看出:碳酸钙沉淀生成的动力学主要由CO2(aq)与OH-的浓度来决定。本体系中的溶液pH值≥11,而CO2(aq)的浓度取决于CO2溶解速率,因此CO2的溶解速率决定了本体系的反应动力学。
(1)在较高溶液过饱和度的情况下
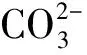
(9)
式中:γ为晶体与溶液间界面能的平均值;η为形状因子,其值决定于溶质分子所形成胚团的形状;k为波尔兹曼常数;T为温度;C0为恒温恒压下体系的饱和溶液浓度;C为相同体系的过饱和溶液浓度。分析此公式可得到结论:在恒温恒压的溶液体系中,不同晶型晶核的形成难易程度ΔG与溶液过饱和浓度有关,当溶液中过饱和度上升时,临界晶核形成能ΔG较低,更容易形成不稳定的晶胞。
根据以上分析,可得结论:较高溶液饱和度更容易生成不稳定的球霰石晶型,同时球霰石晶型在溶液饱和度达不到要求时无法稳定存在,碳酸钙会向更稳定的方解石型和文石型转化,这与前人的文献报道相一致[21,24]。此结论与转化流程符合Ostwald法则[25]。
(2)在较低溶液过饱和度的情况下
通碳速率<100 mL/min与搅拌速率<400 r/min时,溶液过饱和度低,此时临界晶核形成能对成晶过程影响较小,生成的晶体胚团形貌对成晶过程影响较大。
成核速率与过饱和度之间的关系可用Gibbs-Thomson[26-27]方程进行表达:
(10)
式中:J为晶体成核速率;S为溶液中CO2过饱和度;A为常数;B表示形成临界大小晶核的热力学能垒。当溶液的过饱和度较低,晶体成核速率低,导致生成的方解石晶型和文石晶型负离子配位多面体的量很少。但由于文石晶型胚团的生成优先级较高,因此较低溶液过饱和度下生成文石晶型晶核的趋势大于方解石[23]。
根据晶体的生长理论[27],晶体尺寸与晶体恢复至平衡形状的驱动力成反比。当晶体尺寸大于微米级时,晶体恢复至平衡形状的驱动力较低,晶体生长的最低驱动力大于上述相反方向驱动力,晶体生长的过程决定了最后生成的晶体形态。而本实验生成的产物为微米级,符合此规律。由于文石晶核尺寸长,所以文石晶型的晶核溶解转化的动力小于继续生长的动力,导致本实验在较低溶液过饱和度条件下得到的样品中存在一定含量的文石晶型。当通碳速率为100 mL/min、搅拌速率为400 r/min时,溶液过饱和度有明显上升,反应速率与晶核生成速率上升。生成的方解石晶型负离子配位多面体增多,会进行互相叠合,叠合后的方解石晶核稳定性大于文石型[23]。所以在此条件下,方解石晶型所占的比例高。
综合以上分析,在较高通气速率与搅拌速率下,溶液不饱和度升高,更倾向于生成不稳定的球霰石。在搅拌速率与通碳速率降低至400 r/min与100 mL/min的情况下,体系倾向于生成更加稳定的方解石。通气速率与搅拌速率进一步降低时,体系更倾向于生成文石晶型碳酸钙。在本体系中,碳酸钙的球霰石晶型含量随气液相传质速率上升而增加,文石晶型含量随气液相传质速率上升而降低。方解石晶型含量则随气液相传质速率上升而先增加后减少。
2.4 陈化时间对于碳酸钙晶体形貌的影响
晶体的生长需要时间,为考察陈化时间对碳酸钙晶型及形貌的影响,设定反应温度40 ℃,Ca2+浓度0.05 mol/L,通碳速率100 mL/min,搅拌速率400 r/min,改变陈化时间进行实验,得到结果如图14~16所示。
由图14可见,增加陈化时间对于似立方体状碳酸钙晶体的表面光滑度有一定改善作用,也会增加碳酸钙中方解石晶型的含量。在陈化30 min到60 min时(见图14(a)与图14(b)),晶体表面的极小晶块数量有所减少,同时形貌也更规整;在陈化时间为120 min时(见图14(c)),晶体表面更光滑,同时形貌规整,分散性也较好;延长陈化时间至180 min(见图14(d)),样品形貌并无较大变化,同时碎晶体略有增加。在整组实验中,碳酸钙晶体的粒径均为5~10 μm。从图15与图16中可以看出,在陈化时间为30 min时,样品中方解石型与文石型的含量分别为98.58%与1.42%。当陈化时间大于30 min时,样品中不存在文石晶型。综合形貌与晶型含量两种因素,选择120 min为最佳陈化时间。

图14 不同陈化时间制得的碳酸钙晶体的SEM照片Fig.14 SEM images of calcium carbonate crystal prepared for different aging time
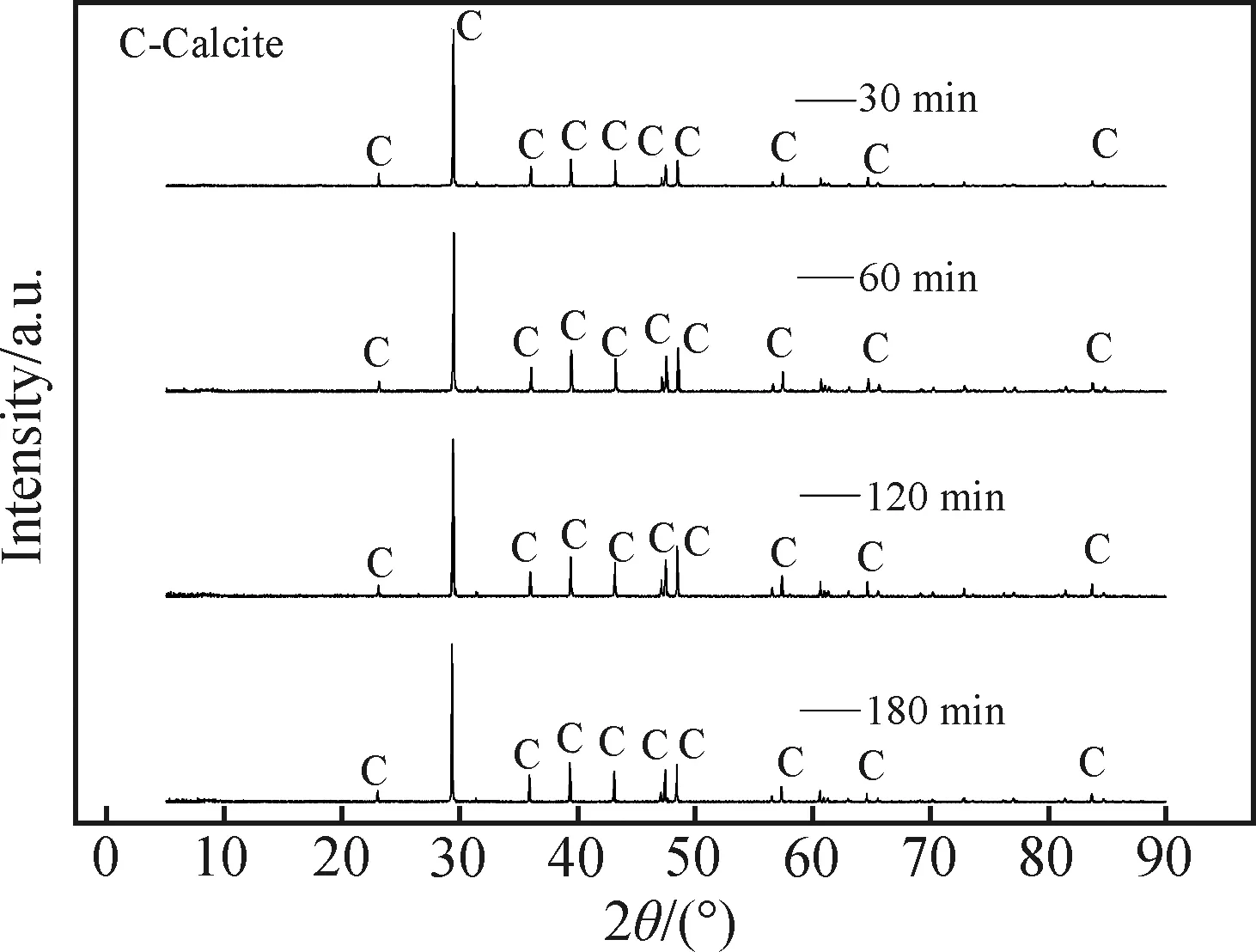
图15 不同陈化时间制得的碳酸钙晶体的XRD图谱Fig.15 XRD patterns of calcium carbonate crystal prepared for different aging time
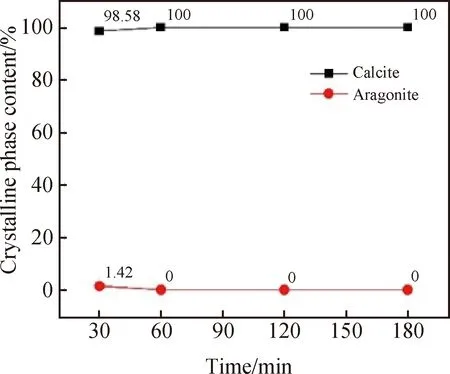
图16 不同陈化时间制得的碳酸钙晶体中各晶型的组成Fig.16 Composition of each crystal form in calcium carbonate crystal prepared for different aging time
在此体系中,较低温度并且陈化30 min时,样品中存在极微量的文石晶型碳酸钙,延长陈化时间后,由于此时溶液的不饱和度依然较高,文石晶型碳酸钙的溶解动力较大,其吉布斯自由能大于方解石晶型吉布斯自由能,所以文石晶型会自动转化为方解石晶型,同时此结果也符合Ostwald原理[25]。
3 结 论
以轻烧白云石为原料,通过单因素控制变量法研究了沉钙过程中反应温度、溶液Ca2+浓度、通碳速率、搅拌速率以及陈化时间对碳酸钙中各晶相含量及形貌的影响。此研究详细分析了流程中反应条件的影响机理并且为工业上高效利用白云石提供了新思路。
(1)最佳反应条件为:反应温度40 ℃,Ca2+浓度0.05 mol/L,通碳速率100 mL/min,搅拌速度400 r/min,陈化时间2 h。在此条件下,制备出形貌规整、平均粒径为5~10 μm,分布均匀的似立方体碳酸钙晶体。
(2)溶液不饱和度对于碳酸钙的晶型变化有较大影响。随着气液相传质速率的上升,溶液的不饱和度会相应增大,而高不饱和度利于球霰石晶型的生成。较低不饱和度下球霰石并不稳定,利于文石晶型与方解石晶型的生成。
相比其他传统方法,此项研究在不使用晶型控制剂的情况下,制备出了相比于其他方法形貌更规整且分散性好的方解石晶型碳酸钙。另外,该工艺是循环工艺,工艺中的废液仍可循环参与反应。因此,此流程在工业上有较广阔的应用前景。
