一种基于香豆素酰腙识别Cu2+的荧光探针
2022-05-16尹纪臣王海滨
薛 蕾,徐 新,尹纪臣,张 杨,王海滨*
(宁夏师范学院化学化工学院,宁夏固原 756000)
在人体必需金属元素中,铜是仅次于铁和锌之后的第三大微量元素,它参与细胞呼吸、新陈代谢等重要生理活动.然而,铜离子含量异常会影响人类健康.若其含量过多,可引起一系列神经退行性疾病,如阿尔茨海默症[1]、门克氏病[2]、威尔逊病和帕金森症[3-4].若其含量过少,会导致肠胃紊乱[5]、癌症[6]等疾病.因此,Cu2+含量检测对维持人类健康有着至关重要的现实意义.
目前,可用于检测Cu2+离子的方法包括伏安法和电位计[7-8]、电感耦合等离子体原子发射光谱法、电感耦合等离子体质谱法[9-10]、原子吸收光谱法[11]等.与这些方法相比,荧光探针因灵敏度高、简便易行、响应迅速等优点被广泛应用于金属离子的检测中[12-14].其中,席夫碱除成本低、易合成、产率高等优点外,特征基团(HC=N—或—RC=N—)N原子杂化轨道上具有孤对电子,使其对金属离子具有良好的配位能力[15].因此,在荧光探针的设计中,常用席夫碱反应对荧光基团进行修饰与改造[16].
近年来,构建可用于检测Cu2+的荧光探针备受关注[17-21].香豆素及其衍生物是一类具有内脂环结构的化合物,有良好的荧光性能且易于在其结构上对官能团进行修饰.咪唑并[2,1-b]噻唑是一种潜在的荧光核,且杂环上有可为金属离子提供配位位点的N与S,由此可作为良好的荧光基团或识别基团应用于荧光探针的设计与合成[22-23].因此,通过多荧光团的连接构建可应用于检测Cu2+的荧光探针具有重要的理论与现实意义.
文中在咪唑并[2,1-b]噻唑基团中引入香豆素荧光团构建一个新型高效识别Cu2+的荧光探针L,合成路线见图1,并通过紫外-可见吸收光谱、荧光光谱、核磁共振波谱、高分辨质谱以及密度泛函理论(DFT)计算,研究其对Cu2+的检测性能.
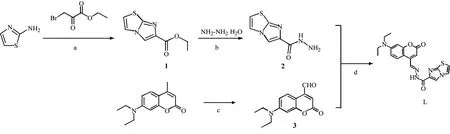
反应条件:a THF/乙醇,25 ℃/回流,24 h/4 h;b 乙醇,室温过夜;c 1,4-二氧六环,回流14 h;d 乙醇,室温过夜.
1 实验部分
1.1 试剂和仪器
2-氨基噻唑、四氢呋喃、3-溴丙酮酸乙酯、7-二乙氨基-4-甲基香豆素、水合肼(80%)均购于阿拉丁试剂(上海)有限公司;无水乙醇、乙腈、石油醚、乙酸乙酯、金属氯化盐、金属硝酸盐均为国产市售化学纯或分析纯,使用前未经进一步纯化,实验用水为去离子水.
ZF-2 型三用紫外仪(中国上海);Bruker Ascend 400 MHz 超导核磁共振仪(德国布鲁克);SGWX-4 显微熔点仪(中国上海);岛津 UV-1750 型分光光度计(日本岛津);RF-5301PC型荧光光谱仪(日本岛津);LTQ XL线性离子阱质谱仪(美国赛默飞).
1.2 探针L的合成
1.2.1 咪唑[2,1-b]噻唑-6-羧酸乙酯(1)的合成 根据文献[24]报道的方法合成化合物1.如图1所示,向2-氨基噻唑(1.00 g,10 mmol)的四氢呋喃溶液(100 mL)中慢慢滴加3-溴丙酮酸乙酯(2.68 g,11 mmol),溶液呈棕色,室温搅拌24 h,有沉淀生成,过滤沉淀并用四氢呋喃淋洗3次,得白色粉末.将其溶于50 mL无水乙醇中,回流4 h,减压过滤,经乙醇重结晶得0.86 g褐色固体1,产率46.95%.m.p.:87~88 ℃;1HNMR(400 MHz,DMSO-d6)δ:8.43(s,1H),7.97(d,J=4.5 Hz,1H),7.47(d,J=4.5 Hz,1H),4.27(q,J=7.1 Hz,2H),1.29(t,J=7.1 Hz,3H).
1.2.2 咪唑并[2,1-b]噻唑-6-酰肼(2)的合成 根据文献[24]报道的方法合成化合物2.将褐色固体1(0.86 g,4.4 mmol)加入无水乙醇(5.0 mL)中,逐滴加入80%水合肼(2.20 g,35 mmol),室温下反应过夜,过滤得0.32 g白色块状固体2,产率40.00 %.m.p.:204~205 ℃;1HNMR(400 MHz,DMSO-d6)δ:9.30(s,1H),8.17(s,1H),7.93(d,J=4.5 Hz,1H),7.36(d,J=4.5 Hz,1H),4.38(d,J=3.3 Hz,2H).
1.2.3 7-二乙氨基-4-醛基香豆素(3)的合成 根据文献[25]报道的方法合成化合物3.将0.23 g(1.0 mmol) 7-二乙氨基-4-甲基香豆素和0.171 g(15.0 mmol)SeO2溶解于5.0 mL 1,4-二氧六环中,搅拌下加热回流14 h,减压蒸馏除去有机溶剂得粗产物,然后用硅胶进行柱层析分离(V(石油醚)∶V(乙酸乙酯)=20∶1),得180.3 mg红色固体3,产率73.5%.m.p.:84~85 ℃;1HNMR(400 MHz,CDCl3)δ:10.03(s,1H),8.31(d,J=9.2 Hz,1H),6.63(dd,J=9.2,2.6 Hz,1H),6.53(d,J=2.6 Hz,1H),6.46(s,1H),3.43(q,J=7.1 Hz,4H),1.22(t,J=7.1 Hz,6H).
1.2.4 探针(E)-N′-(7-(二乙氨基)-2-氧代-2H-苯并吡喃-4-基亚甲基)咪唑并[2,1-b]噻唑-6-酰肼(L)的合成 在50 mL干燥的茄形瓶中依次加入0.090 g(0.5 mmol)化合物2、0.135 g(0.55 mmol)化合物3和10.0 mL无水乙醇,加热回流过夜,薄层色谱(TLC)监测反应进程.反应完成后,将反应混合物冷却至室温,抽滤,用无水乙醇重结晶即得到0.120 g探针L,橙黄色片状固体,产率80.6%. m.p.:297~298 ℃;1HNMR(400 MHz,DMSO-d6)δ:12.18(s,1H),8.74(s,1H),8.44(s,1H),8.27(d,J=9.2 Hz,1H),8.00(d,J=4.5 Hz,1H),7.46(d,J=4.5 Hz,1H),6.77(dd,J=9.2,2.6 Hz,1H),6.56(d,J=2.6 Hz,1H),6.22(s,1H),3.45(q,J=7.0 Hz,4H),1.14(t,J=7.0 Hz,6H).13CNMR(101 MHz,DMSO-d6)δ:160.79(s),158.46(s),156.51(s),150.42(s),149.05(s),145.46(s),143.63(s),139.94(s),127.13(s),120.25(s),117.13(s),115.89(s),109.03(s),107.11(s),105.17(s),97.05(s),43.99(s),12.36(s).HRMS(ESI-MS)计算值(C20H19N5O3S)+:409.12,实测值409.00.
1.3 光谱测定方法
以无水乙醇为溶剂,将探针L配置成1.0×10-3mol·L-1的溶液备用,测试时移取40 μL用乙腈稀释至2.0×10-5mol·L-1,以无水乙醇配制金属离子(Li+,Na+,K+,Ag+,Ca2+,Mg2+,Zn2+,Ba2+,Co2+,Cd2+,Sn2+,Ni2+,Mn2+,Cu2+,Fe2+,Pb2+,Sr2+,Fe3+,Al3+,Cr3+)的盐酸盐或硝酸盐溶液(1.0×10-2mol·L-1)并用于紫外-可见光谱和荧光光谱测定.
荧光光谱测试条件:所用样品池为1 cm×1 cm×4 cm石英比色皿,室温下保持激发与发射狭缝宽度均为5.0 nm,激发波长λex为335 nm,于350~660 nm范围内测试荧光.
1.4 检测限计算
在相同条件下,测定10组空白样在462 nm处的荧光数据,并计算其标准偏差SD,将Cu2+的浓度与462 nm处待测样的荧光强度进行拟合得到斜率K,通过方程(LOD=3SD/K)计算得到探针L对Cu2+的检测限[26].
1.5 理论计算
采用密度泛函理论(DFT)对探针L和L-Cu2+分别进行几何优化和量子化学计算,并在Gaussian 09程序DFT/B3LYP/6-31G+(d)基组下进行结构优化和频率计算.利用含时密度泛函理论(TD-DFT)在相同基组下,得到最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的能级.采用Multiwfn3.8软件对分子轨道进行可视化及作图[27].
2 结果与讨论
2.1 探针L的设计、合成与结构表征
以2-氨基噻唑为原料,根据文献[24]方法合成咪唑并[2,1-b]噻唑-6-酰肼(2).其次以7-二乙氨基-4-甲基香豆素为原料,根据文献[25]方法合成7-二乙氨基-4-醛基香豆素(3),最后用化合物(2)和(3)合成一种新型酰腙荧光探针L.探针L的结构经核磁氢谱、核磁碳谱及质谱表征,证实为预期目标分子.
2.2 探针L对金属离子的选择性识别
首先研究了探针L在乙腈中对不同金属离子的识别,结果见图2.当激发波长为335 nm时,探针L(2.0×10-5mol·L-1)在568 nm处出现最大发射峰,当加入2×10-4mol·L-1各种不同金属离子(K+,Na+,Li+,Ag+,Ca2+,Mg2+,Zn2+,Ba2+,Co2+,Cd2+,Sn2+,Ni2+,Mn2+,Fe2+,Pb2+,Sr2+,Fe3+,Al3+,Cr3+)后,发射峰强度出现差异,但位置未发生明显变化;加入Cu2+后,探针L位于568 nm处的发射峰蓝移至462 nm,在365 nm紫外灯照射下溶液由橙色荧光变为蓝色荧光.由此说明,探针L对Cu2+具有高度选择性识别.
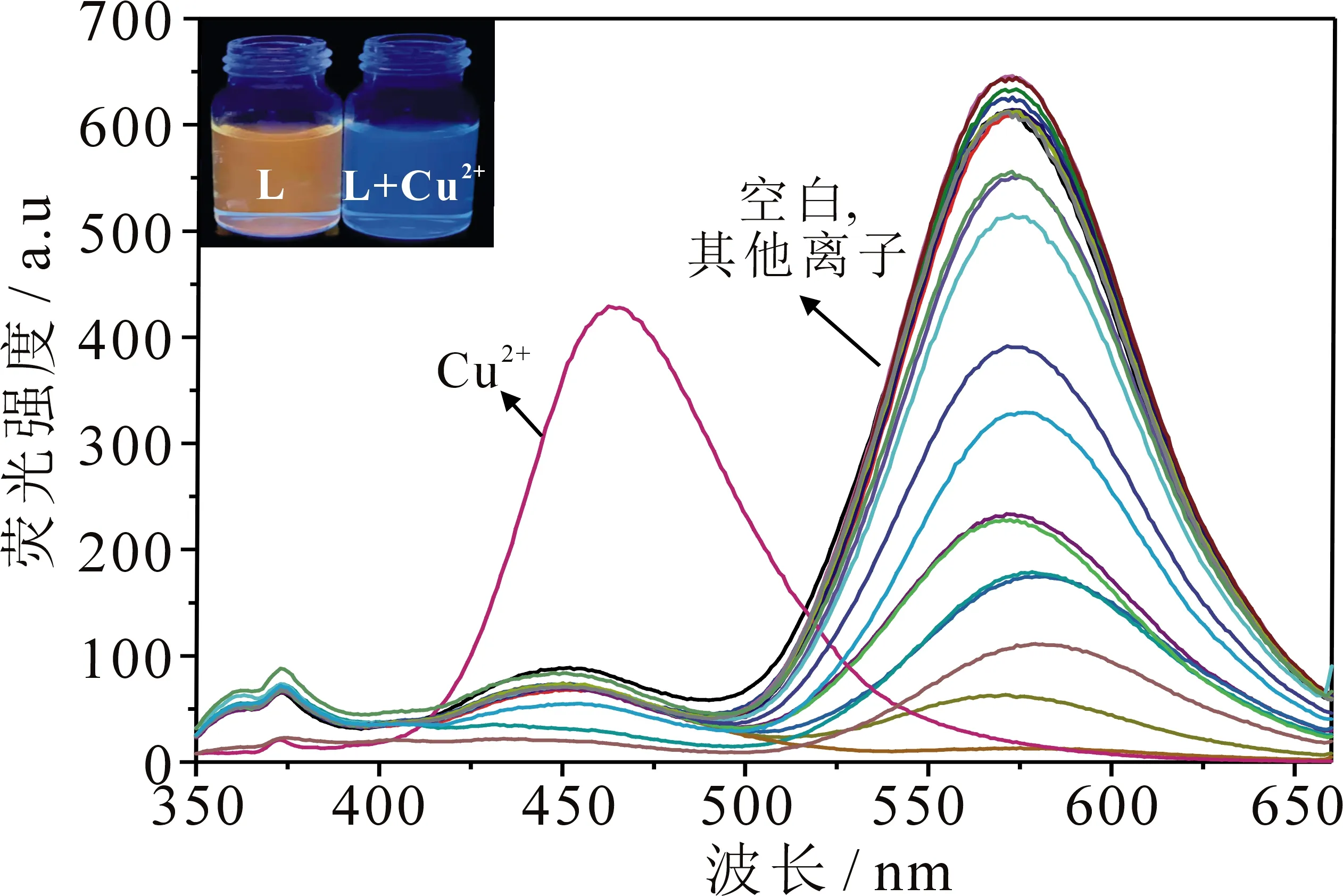
图2 向L的CH3CN溶液(2.0×10-5 mol·L-1)中加入2×10-4 mol·L-1 不同金属离子后的荧光强度变化(λex=335 nm, 插图为365 nm紫外灯下溶液颜色的变化)
2.3 探针L与Cu2+的紫外滴定实验
为探究探针L与Cu2+的结合特性,开展紫外滴定实验,如图3所示.在乙腈中,随着Cu2+浓度(0~20 μmol·L-1)的增加,探针L(2.0×10-5mol·L-1)在256和497 nm处的吸收值逐渐增强,同时在280,316和428 nm处的吸收值逐渐降低,且在268和474 nm处出现等吸收点,表明探针L与Cu2+形成了稳定络合物.
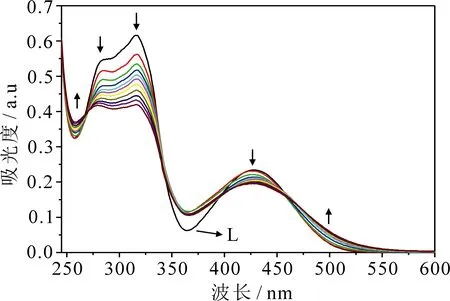
图3 探针L的CH3CN溶液(2.0×10-5 mol·L-1)中加入不同浓度 Cu2+(0~20 μmol·L-1)的紫外-可见吸收光谱
2.4 探针L与Cu2+的荧光滴定实验
为探究不同浓度的Cu2+对探针L荧光光谱的影响,开展了荧光滴定实验,如图4所示.向探针L溶液中逐渐加入Cu2+(0~70 μmol·L-1)时,随着568 nm处荧光发射峰的降低,在462 nm处出现了一个新的荧光发射峰.并且探针L在462 nm下的荧光强度与Cu2+浓度在20~50 μmol·L-1呈现良好的线性关系,经拟合得到线性回归方程为:y=6.1212x-14.622,R2=0.9946(图5).通过Benesi-Hildebrand 方程计算得到络合常数为1.32×104L·mol-1(图6).以探针L的10次荧光强度相对标准偏差计算得到探针L对Cu2+的检测限为6.90×10-8mol·L-1,世界卫生组织(WHO)规定饮用水中Cu2+的最大含量(20 μmol·L-1)[28].实验所得检测限低于WHO所规定饮用水中Cu2+含量的安全值.由此表明,探针L可用于饮用水中Cu2+的定量检测.

图4 探针L的CH3CN溶液(2.0×10-5 mol·L-1)中加入不同浓度 Cu2+(0~70 μmol·L-1)的荧光发射光谱(λex=335 nm)

图5 荧光强度与Cu2+浓度在乙腈溶液中的线性关系

图6 探针L与Cu2+的Benesi-Hildebrand曲线
2.5 常见金属离子的干扰
为考察探针L与Cu2+络合后的抗干扰能力,在探针L的乙腈溶液中先加入2.0×10-5mol·L-1其他金属离子(K+,Na+,Li+,Ag+,Ca2+,Mg2+,Zn2+,Ba2+,Co2+,Cd2+,Sn2+,Ni2+,Mn2+,Fe2+,Pb2+,Sr2+,Fe3+,Al3+,Cr3+),再加入2.0×10-5mol·L-1Cu2+,混合均匀后,测试荧光强度变化,结果见图7.在其他金属离子存在下,Fe3+,Mn2+,Sn2+,Fe2+对其荧光部分猝灭,而其他金属离子均无明显干扰.因此,探针L对Cu2+的识别具有较强的抗干扰能力.

图7 其他金属离子(2.0×10-5 mol·L-1)和Cu2+(2.0×10-5 mol·L-1)共存时探针 L(2×10-5 mol·L-1)在CH3CN中的荧光发射光谱(λex=335 nm).
2.6 探针L与Cu2+的络合比
采用Job’s Plot[29]方法探究了探针L与Cu2+之间的络合比,随着Cu2+摩尔分数的不断改变,体系在462 nm处的荧光强度随之变化.如图8所示,当Cu2+摩尔分数为0.5时,体系在462 nm处的荧光强度最大,由此表明,探针L与Cu2+的络合比为1∶1.

图8 探针L和Cu2+的Job曲线(λex=335 nm)
为进一步确定探针L与Cu2+之间的络合比,通过电喷雾质谱分析(ESI-MS),结果见图9,得到了探针L与Cu2+结合的分子离子峰472.83(理论计算[L+Cu2+-H+]+=472.01),从而证实了探针L与Cu2+的络合比为1∶1.
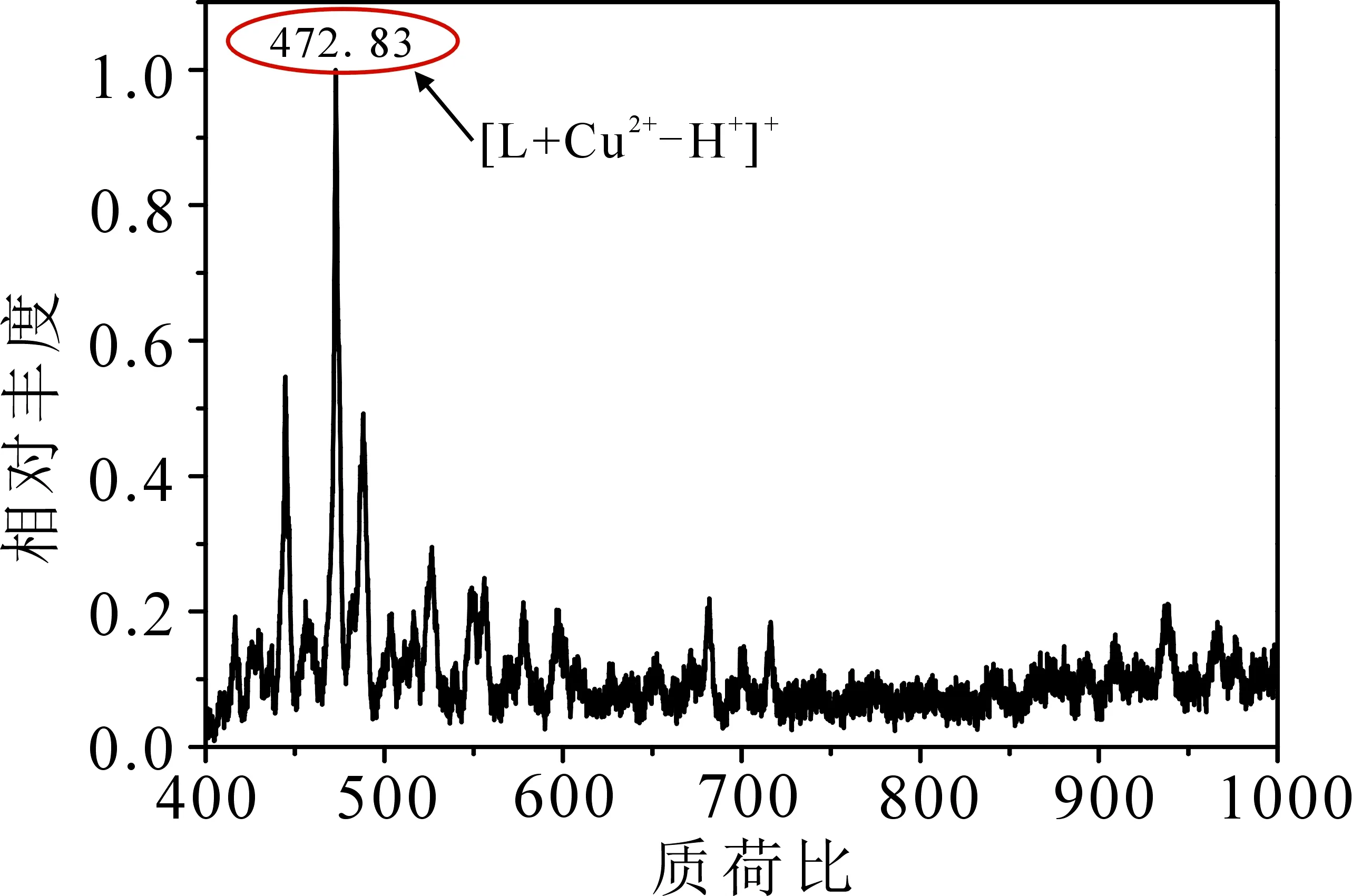
图9 加入 Cu2+(50 mmol·L-1)时探针L (10 mmol·L-1 )的阳离子ESI-MS谱
2.7 1HNMR滴定
通过累计滴加法,对探针L与Cu2+的络合机理进行了初步探究,探针L(20 mmol·L-1)在DMSO-d6中的1HNMR 滴定实验如图10所示.探针L在δ=12.18,8.74和8.44处出现3个单峰,分别归属于NH(Ha),CH=N(Hb)和咪唑环上(Hc)的质子信号峰.随着Cu2+浓度的增加,Ha,Hb和Hc信号峰均移向低场.当加入20 mmol·L-1的Cu2+时,Hb信号峰低移至δ8.99,Hc信号峰低移至δ8.53,而NH质子峰Ha在加入Cu2+后消失,说明NH与Cu2+发生了络合.当咪唑环上的N原子与Cu2+配位,会引起电子云密度降低,咪唑并噻唑环上的某些质子信号峰也向低场移动,促使探针L分子内电荷移动.这表明,探针L中酰胺基(—NHCOR)和咪唑环上的N与Cu2+发生了配位,结合ESI-MS谱可知形成1∶1配位的L-Cu2+络合物.
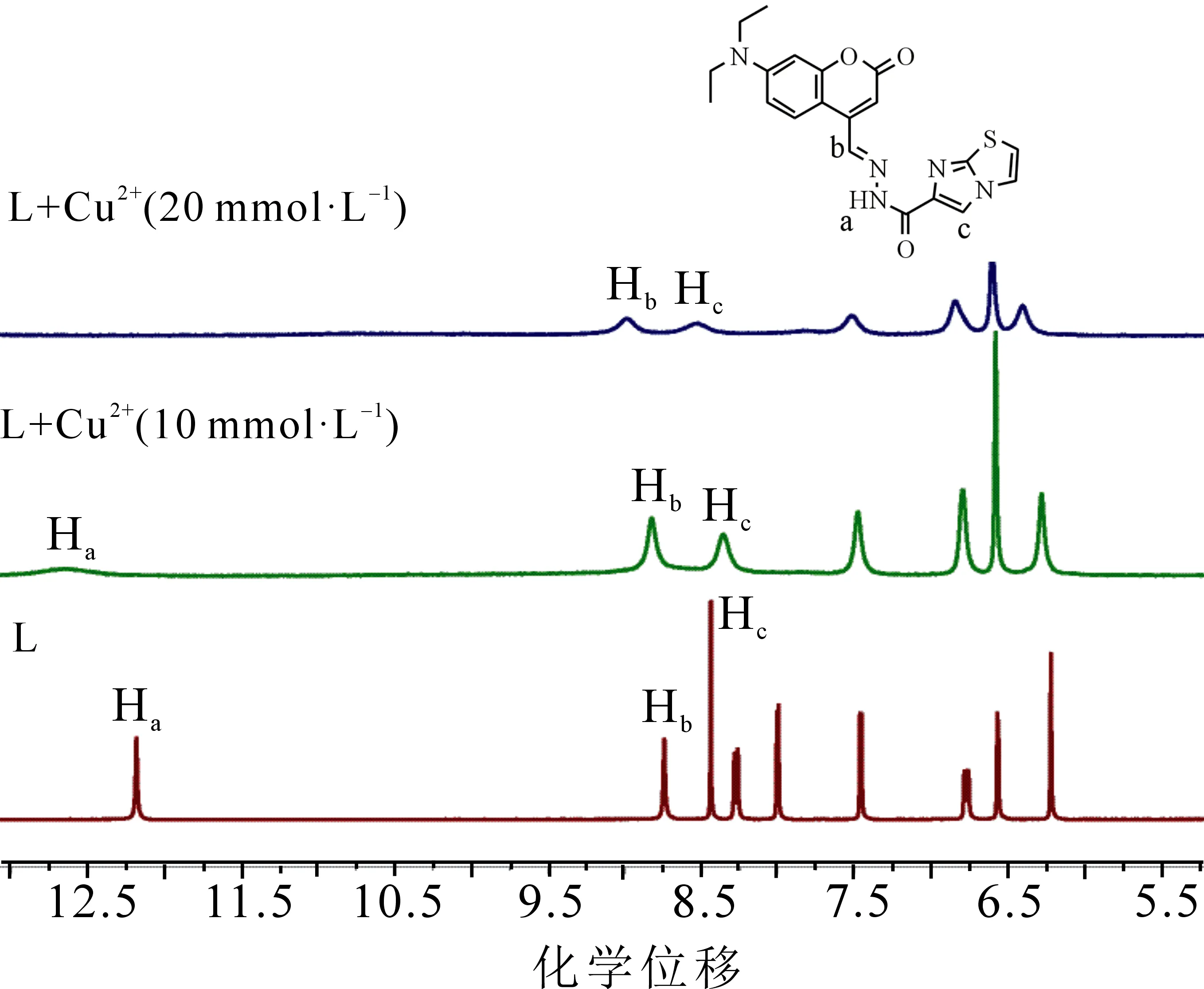
图10 在DMSO-d6中逐渐加入Cu(NO3)2·3H2O时 探针L的1HNMR谱
2.8 探针L与Cu2+的络合机理
为进一步探究探针L与Cu2+的络合机理,文中利用Gaussian 09程序DFT/B3LYP/6-31G+(d)基组对探针L及L-Cu2+配合物进行结构优化和密度泛函理论(DFT)计算.如图11所示,探针L结构中酰胺和咪唑环上的氮原子提供了络合位点,在两络合位点间形成一个空腔,可牢固包裹Cu2+,形成一个新的五元环.通常,探针的光谱性质与最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)之间的能隙值与电子云分布有关.结果显示,探针L的HOMO-LUMO能隙值为3.25 eV.探针L的HOMO电子云主要集中在苯并吡喃环上,有良好的共轭性.当受到电子激发后,苯并吡喃环上的电子云向酰肼结构转移.探针L与Cu2+配位后,L-Cu2+配合物的HOMO-LUMO能隙值为2.96 eV,能隙值降低0.29 eV,说明形成了稳定的复合物.L-Cu2+配合物的HOMO电子云分布与探针L相近,不同的是受到电子激发后,原本集中在苯并吡喃环的电子云,以铜离子为中心,大部分转移到酰肼与咪唑环上,荧光发射则表现为蓝移,我们认为这是因为探针L中的供体与Cu2+结合改变了探针L的电子云分布,发生了显著的分子内电荷转移效应(ICT),该结构中供电子基酰胺基(—NHCOR)和咪唑上N与Cu2+结合时,通过去质子化使得体系供电子能力减弱,共轭程度降低,所以发射波长发生蓝移.
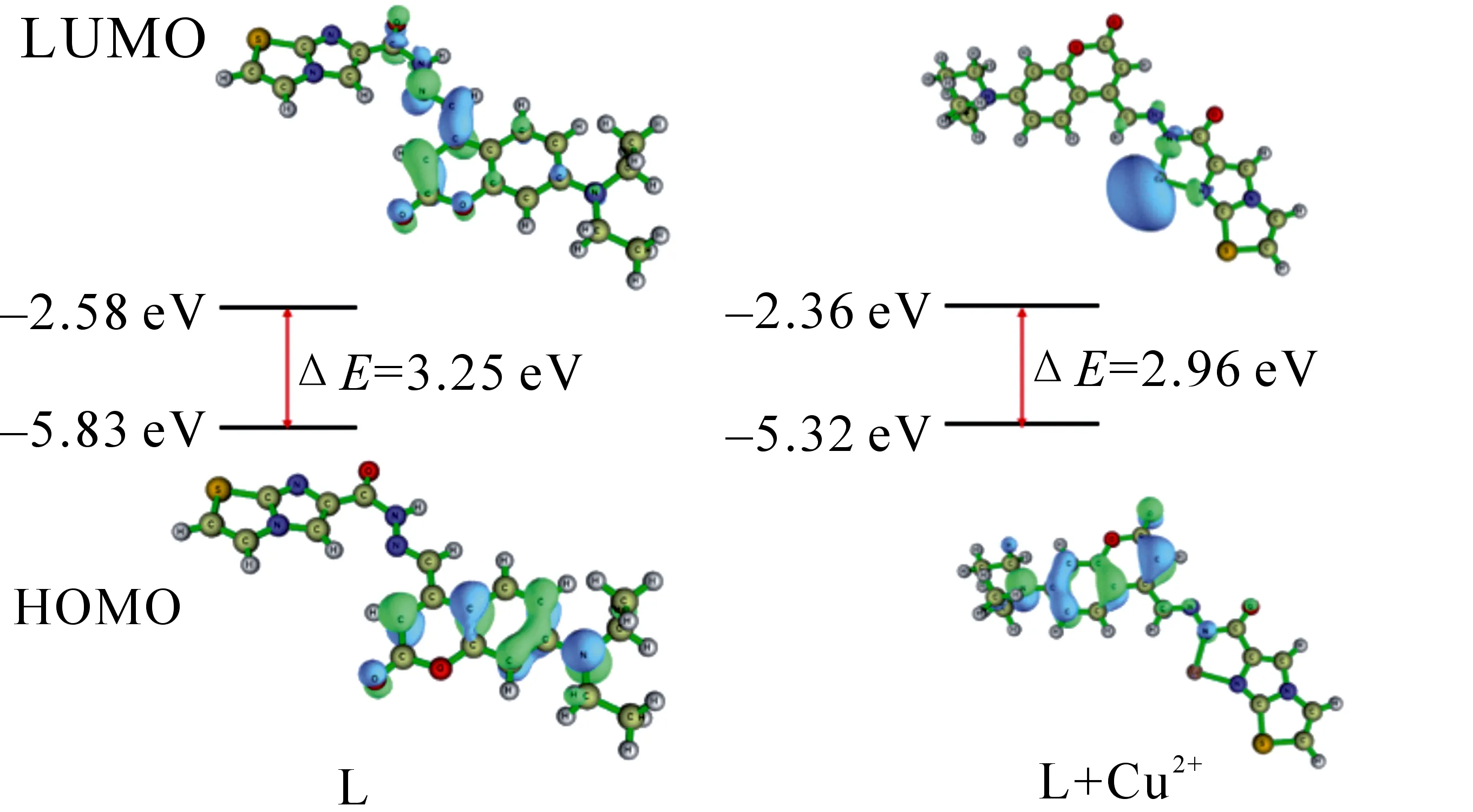
图11 探针L和L-Cu2+的前线分子轨道密度 分布图和能级间隙
根据上述UV-Vis和荧光光谱分析、ESI-MS分析、1HNMR滴定以及DFT计算,探针L与Cu2+的络合模式如图12所示.
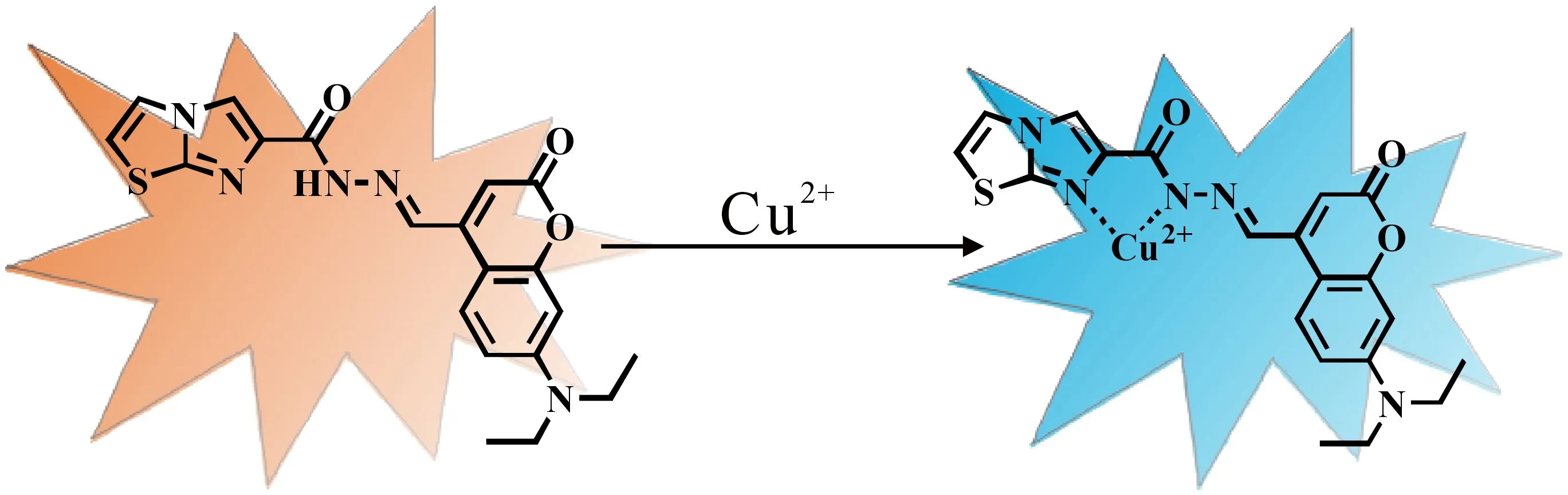
图12 探针L与Cu2+可能的识别机理
3 结束语
合成了一种基于香豆素酰腙的荧光探针L,并研究了其对金属离子的识别性能.实验结果表明,探针L在乙腈中可高效识别Cu2+,发射波长发生明显蓝移,且具有较强的抗干扰能力.Job’s曲线、ESI-MS及DFT计算结果表明,探针L与Cu2+形成了1∶1配合物,探针L与Cu2+的结合常数为1.32×104L·mol-1,检测限为6.90×10-8mol·L-1,低于WHO规定的饮用水中 Cu2+的最大含量(20 μmol·L-1).因此,探针L在检测水环境中Cu2+含量方面具有潜在的应用价值.
