小白芨内生真菌的分离鉴定及产酶情况初步筛选
2022-05-16郭洁樊竹青
郭洁,樊竹青
(普洱学院,云南普洱 665000)
植物内生真菌是指生活史的一定阶段生活于健康植物组织和器官的细胞内部,对植物自身没有引起明显的病害,并与植物自身建立密切关系的一类微生物[1-3]。植物内生真菌是宿主植物天然的微生态系统组成部分,对植物具有促生长的调控作用,可增强宿主植物的抗逆性。植物内生真菌能产生丰富的酶类和生物碱类、皂苷、芳香类等活性物质,对动植物及人病原菌体具有不同的抗菌性[3-5]。植物内生真菌产酶丰富,种类繁多,对酶工程的发展具有很大的潜在价值。作为一类重要的微生物资源,植物内生真菌为研究新型抗菌药提供了丰富的资源。
小白芨(Bletilla striata)是兰科植物多年生的草本药用植物,内含丰富的小白芨多糖和小白芨胶,具有抗菌、抗病毒、抗肿瘤、抗氧化等功效[6]。近年来,对小白芨的药理研究、化学成分分析、繁育栽培、多糖等提取的工艺研究方面较为广泛,但对小白芨内生真菌的研究报道资料相对较少。陈青青等[7]对湖北钟祥、陕西安康两地的野生白芨进行了分离鉴定,而云南产小白芨属植物内生真菌和酶活研究鲜有报道。本研究以云南宣威产小白芨为研究对象,采用形态鉴定和分子鉴定的方法,对小白芨内生真菌进行分析,增加宣威小白芨的基础数据,以期为云南产小白芨属植物内生真菌系统研究提供一定的理论基础。
1 材料与方法
1.1 菌种的来源
菌株分离自宣威所产无病虫害的小白芨(Bletilla striata),供试菌株共2株,保存于普洱学院微生物学实验室。
1.2 试剂
100 mL TE缓冲液,北京索莱宝科技有限公司;PCR扩增剂,福州生物公司; Tris-HCl,碧云天生物公司;100 mL 1×TAE缓冲液,上海麦克林公司;8200 Triton X-100,北京索莱宝科技有限公司;100 mL 6×Loading Buffer,北京索莱宝科技有限公司;500 μL核苷酸染料(GeneFinder染料),北京生物科技有限公司;100 mg DNA Marker(DL2000),上海研生有限公司;50T真菌基因组DNA提取试剂盒,德国QIAGEN;上游引物ITS1:5'-TCCGTAGGTGAACCTGCGG-3',250 μL,杭州星群仪器公司;下游引物ITS4:5'-TCCTCCGCTTATTGATATGC-3',250 μL,杭州星群仪器公司。
1.3 仪器与设备
L96G型PCR扩增仪,杭州朗基科学仪器有限公司;DYY-8C型电泳仪,北京六一仪器厂;TL2600型生物显微镜,上海缔伦光学仪器有限公司;SC-3616型离心机,安徽中科中佳科学仪器有限公司;DNA自动测序仪,昆明硕擎生物公司;HZQ-X300型摇床,上海一恒科学仪器有限公司;GXZ-300B型恒温培养箱,宁波东南仪器有限公司;SW-CJ-IF型超净工作台,托普仪器有限公司;QL-901型旋涡振荡器,海门市其林贝尔仪器制造有限公司;CP224C型电子天平,上海奥豪斯仪器有限公司;Starter2C型pH计,上海奥豪斯仪器有限公司;LDZX-75KBS型立式高压灭菌锅,上海申安医疗器械厂;EPED-20TJ型纯水仪,易普易达公司。
1.4 培养基的配制
马铃薯葡萄糖琼脂培养基(分离纯化培养基):马铃薯(去皮)200 g、葡萄糖20 g、琼脂10~12 g,水1 000 mL,pH自然。
淀粉培养基:淀粉 10 g、马铃薯200 g、琼脂11~12 g,水1 000 mL,pH自然。
油脂培养基:蛋白胨10 g、牛肉膏5 g、氯化钠5 g、花生油或香油10 g、琼脂15~20 g、1.6%中性红水溶液1 mL,水1 000 mL,pH6.9~7.1。
酪蛋白培养基:酪蛋白10 g、牛肉浸粉3 g、氯化钠5 g、磷酸二氢钾2 g、琼脂15 g,水1 000 mL,pH7.3~ 7.5。
果胶培养基:果胶5 g、酵母膏5 g、硫酸镁(MgSO4·7H2O)2 g、磷酸氢二钾(K2HPO4)1 g、琼脂20 g、刚果红0.15 g,pH7.0~7.2。
1.5 内生真菌的分离纯化
小白芨表面消毒法参照刘悦等[9]对刺五加的表面消毒法。菌种的分离纯化采用3点种植法,用接种针挑取内生真菌的孢子或少量气生菌丝接种于PDA培养基平板,接种的3个点成三角形,倒置于26~28 ℃的培养箱中培养4~5 d,观察3个点菌落形态,直至3个菌落形态相同,并与原始记录相符,则完成纯化,将真菌转接到斜面保存备用。
1.6 菌种的鉴定
1.6.1 内生真菌的形态学鉴定
将纯化后的菌株接种在PDA培养基上,在培养3 d、7 d、15 d后分别观察并记录菌落形态,包括菌株的大小、颜色、质地、菌落边缘和有无渗出物等情况。用插片法培养菌株5~7 d后,在显微镜下观察盖玻片上的菌丝形态,重点观察菌丝是否有隔,分生孢子的形态、大小、着生情况、聚集方式和分生孢子梗的形态,观察的同时进行拍照,对照《真菌鉴定手册》[8]进行初步形态鉴定。
1.6.2 2株真菌产酶情况初筛
将经过分离纯化的真菌分别接种至淀粉培养基、油脂培养基、蛋白质培养基和果胶培养基中,在28℃培养。每天观察菌株的生长情况及是否有透明圈的产生,筛选具有明显透明圈的真菌。
1.6.3 内生真菌的分子鉴定
选出具有明显透明圈的2株真菌,进行分子鉴定。
1.6.3.1 内生真菌细胞总DNA材料的获得
(1)25 mL PDA液体培养基分装于50 mL的摇瓶中,121 ℃灭菌30 min备用。
(2)将菌株接种到无菌的PDA液体培养基中,28 ℃、180 r/min、摇床培养2~3 d后将菌体收集在1.5 mL Eppendorf管中。
(3)将收集好的菌体在8 000 r/min下离心4 min,倒掉上清液,用冰冷的等体积无菌水洗涤,再离心。
(4)用200 μL的裂解液重悬上一步中得到的细胞沉淀,混匀后加入2匙石英砂,苯酚、氯仿各200 μL,涡旋振荡 5 min,加入 200 μL TE 缓冲液,充分混匀。
(5)13 000 r/min离心5 min,将上层水相转移到干净的Eppendorf管中,加入400 μL氯仿并翻转混匀(轻混)。
(6)重复步骤(5),加入1 mL无水乙醇,充分混匀,13 000 r/min离心2 min。
(7)弃上清液,用1 mL 70%乙醇洗涤沉淀,13 000 r/min离心3~5 min。
(8)完全弃上清液,并将沉淀在烘箱中干燥至沉淀发白无酒精味。
(9)加入50 μL TE缓冲液重悬沉淀,4 ℃冰箱中过夜溶解,-20 ℃保存。
1.6.3.2 测定DNA浓度
为了提高实验效果和缩短实验时间,在PCR扩增前测定DNA浓度。用核酸测定仪测量波长260 nm的吸光值,然后直接在仪器上转化成浓度、纯度的读数。
1.6.3.3 rDNA-ITS基因序列的PCR扩增
扩增程序:94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。PCR结束后,用DNA琼脂糖凝胶电泳检测PCR产物。
琼脂糖凝胶电泳步骤如下。(1)取1.6 g琼脂糖置于三角瓶中,加入75 mL 1×TAE缓冲液,瓶口盖一块布或者倒扣一个小烧杯,放在微波炉中加热直到琼脂糖溶解,待溶液冷却至60 ℃左右时加入一滴GeneFinder染料,轻轻混匀,倒入制胶槽,待有机玻璃板表面形成均匀的胶层。(2)室温下静置20~25 min,胶层完全凝固后,将凝胶和内槽一起放在含有1×TAE缓冲液的电泳槽中,将准备好的梳子轻轻地插入胶层上,再轻拔出梳子,制成均匀的胶板样品孔。(3)用移液器分别将2个样品将各取9 μL PCR产物与1 μL 6×Loading Buffer混合后点样加入胶板的样品孔,待全部加完样品后即可通电进行电泳(电压200 V,电流200 mA)。电泳结束用紫外凝胶成像分析系统进行观察拍照。DNA测序结果用Blast数据库进行鉴定检验,构建进化树,根据进化树分析2株内生真菌之间的亲缘关系和遗传距离。
2 结果与分析
2.1 小白芨内生真菌的特征与鉴定
经过PDA培养基的分离纯化,最终获得纯正的2个菌株,编号为M15和PDAX2,菌落形态见图1、图2、图3。2株内生真菌根据形态鉴定到属,初步确定内生真菌M15、PDAX2为青霉属(Penicillium)菌株。
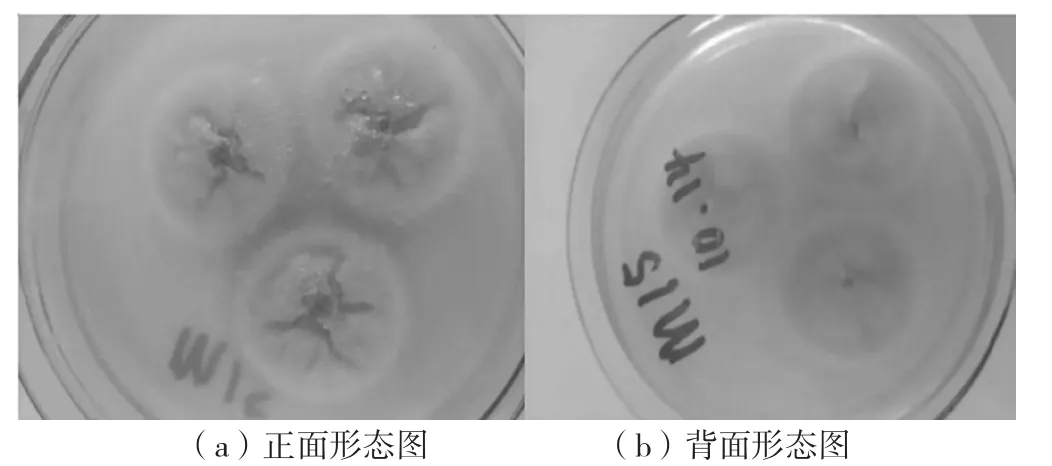
图1 菌株M15培养7 d的宏观菌落形态图

图2 菌株PDAX2培养7 d的宏观菌落形态图

图3 菌株培养7 d的微观菌落形态图

表1 M15菌株菌落形态及显微镜下的形态特征

表2 PDAX2菌株菌落形态及显微镜下的形态特征
2.2 产酶情况初筛
经过培养观察,菌株M15在蛋白质培养基、果胶培养基和脂肪培养基中产生透明的水解圈,PDAX2在淀粉培养基、蛋白质培养基和果胶培养基中产生透明圈。说明M15能产生蛋白酶、果胶酶和脂肪酶,PDAX2能产生淀粉酶、蛋白酶和果胶酶(见图4、图5)。
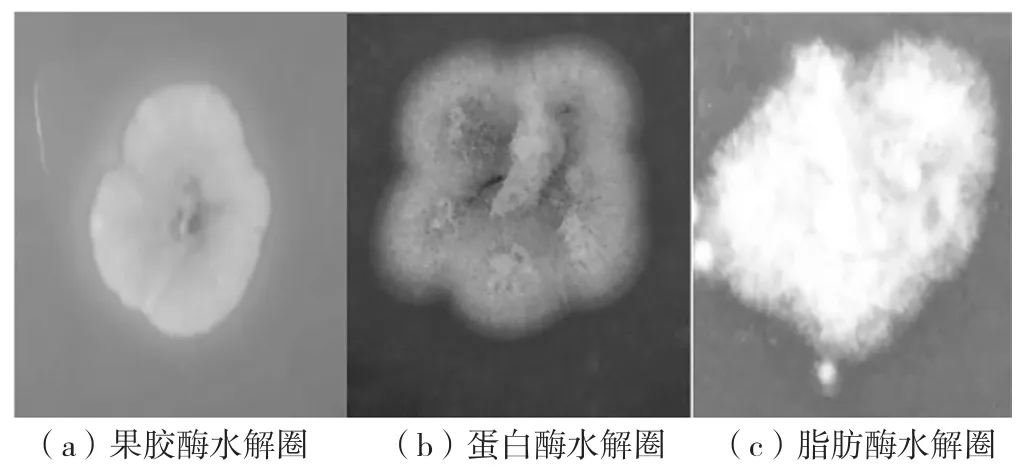
图4 菌株M15出现水解圈的情况
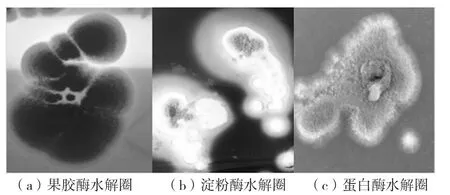
图5 菌株PDAX2出现水解圈的情况
2.3 小白芨内生真菌的分子生物学鉴定
根据基因序列构建的菌株M15、PDAX2系统发育进化树如图6所示。供试的2株真菌M15、PDAX2的DNA成功提取并扩增,将纯化的DNA扩增结果送由昆明硕擎生物公司进行测序。将测序结果与GenBank中生物序列进行比对,比对序列输入Mega5软件,进行鉴定并构建系统发育树,其鉴定结果如下:M15鉴定为青霉属雷斯青霉菌(Penicillium raistrickii);PDAX2鉴定为青霉属波兰青霉(Penicillium polonicum)菌。
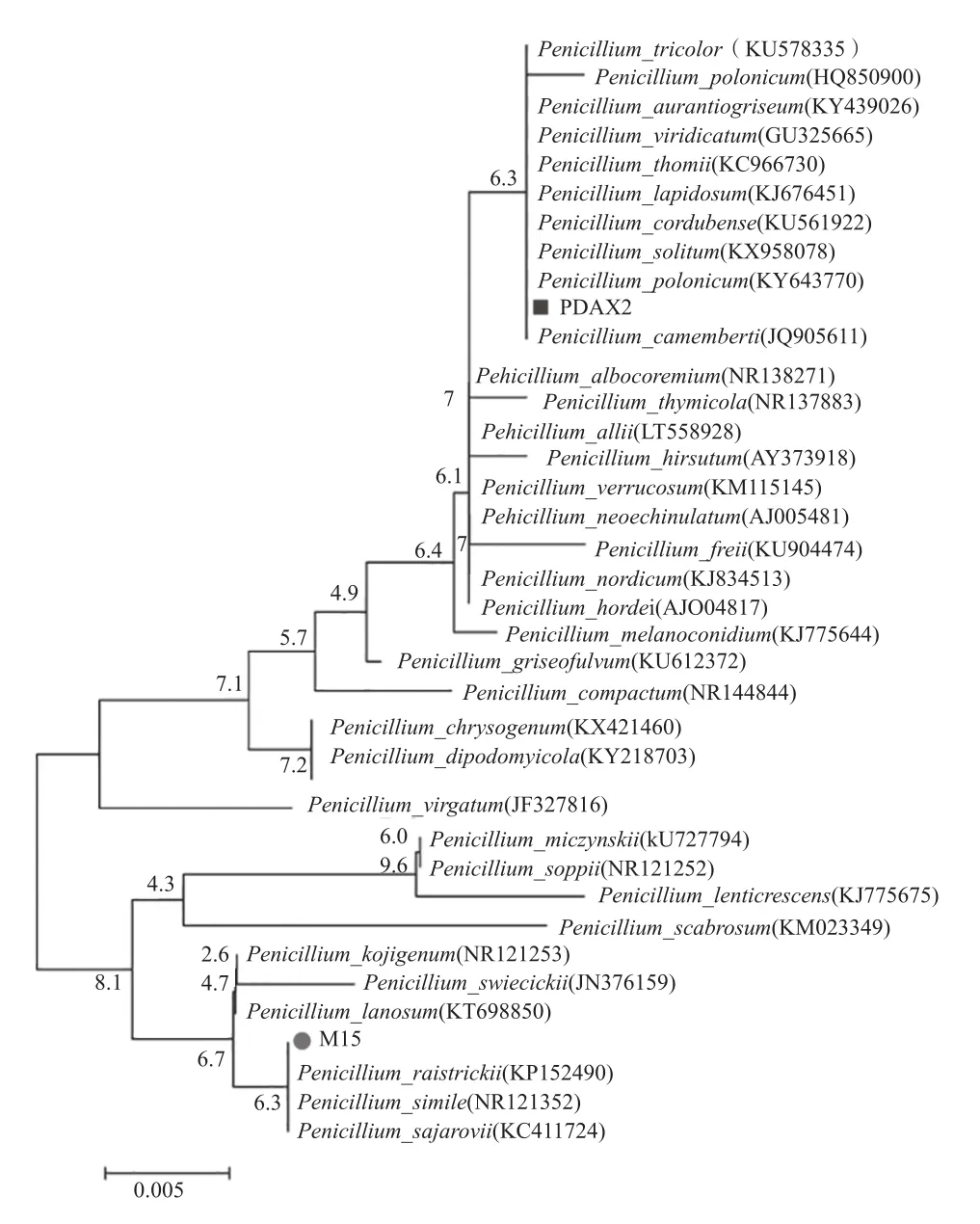
图6 根据基因序列构建菌株M15、PDAX2系统发育进化树
在Blast的结果中,与M15比对上的序列是Penicillium raistrickii,与PDAX2相似度最高的是Penicillium polonicum菌株。在进化树的结果中,序列之间亲缘性与Blast结果相符合。同时,此次实验测到的M15与PDAX2序列分别位于不同分支,其遗传距离较大。
3 讨论
我国国土辽阔,植物资源丰富,很多植物内生真菌的研究表明,每种植物中都蕴藏着丰富的内生真菌资源,但是由于特殊的环境和很多药用植物内生真菌在人工培养基上无法生长,使得我国的植物内生真菌研究还不是很深,因此植物内生真菌亟待开发和挖掘[7]。现有基因工程和生物技术的快速发展,为研究植物内生真菌提供了便利,进一步加强了人类对植物内生真菌的探究,同时在寻找新的抗菌抗癌物质新药、寻找酶类等方面具有深远的意义[2]。
在本次的研究中,只是进行了形态鉴定和分子鉴定,对于小白芨研究还有很大的空白需要填充,内生真菌的资源非常丰富,由于条件有限,本研究只分离鉴定到2株。陈青青等[7]以湖北钟祥、陕西安康的小白芨为样品,分离到内生真菌24株,其分离到的菌株种类更多,与本实验的研究结果相差较大,经分析,出现差异的原因可能如下:(1)二者的实验材料地域结构相差较大,小白芨的内生环境、生理状况相差较大,造成内生真菌相差较大;(2)实验材料采集的季节不同,造成内生真菌的种类也不同;(3)二者所采实验样本数量的不同也会造成很大的差异。小白芨内生真菌研究很多关键性的问题有待解决,特别是应该加强内生真菌的鉴定这一方面,充分了解内生真菌和宿主的关系,提高小白芨种的药用价值和经济价值,同时也为保护小白芨的种质资源做好基础性工作。
4 结论
通过对云南宣威产小白芨的研究,分离和鉴定出2株真菌,均为青霉属菌株。通过分子生物学鉴定到种,M15为青霉属雷斯青霉(Penicillium raistrickii),PDAX2为青霉属波兰青霉(Penicillium polonicum)。M15产生蛋白酶、果胶酶和脂肪酶,PDAX2产生淀粉酶、蛋白酶和果胶酶。
