儿童1 型糖尿病的诊治与展望
2022-05-16罗飞宏
罗飞宏
复旦大学附属儿科医院内分泌遗传代谢科(上海 201102)
糖尿病是危害儿童健康的重大基础疾病,尽管近年来儿童2 型糖尿病发病率快速上升,但从世界范围来看,目前儿童糖尿病中约80%~90%为仍为1型糖尿病(type 1 diabetes mellitus,T1DM)。由于儿童T1DM起病早、生活不规则、自控性差,血糖控制困难,导致患者长期生存受到严重威胁。研究提示,0~10岁患T1DM的患者全因死亡率的危险比为4.11,心血管死亡率的危险比为7.38,非心血管死亡率的危险比为3.96;10岁之前患病的女性预期寿命减少17.7岁,男性预期寿命减少14.2岁[1],因此加强儿童T1DM的管理十分重要。
1 儿童T1DM的流行变迁及其特征
世界糖尿病联盟根据2019 年的资料估计全世界15岁以下儿童T1DM年新发病例为98 200例,患病人数约为600 900例,年平均增幅为3%左右,由于全世界范围内只有45%的国家报告过T 1 DM 的发病率,因此实际发病率和发病人数应该更高[2]。T 1 DM 发病率在不同的地区差别甚大,总体欧洲发病率较高,芬兰是世界上儿童T 1 DM 发病率最高的国家,1953年其估计发病率为12.5/10万人年,至2006年已达到64.9/10万人年[3];欧洲其他国家如法国稍低,2015年儿童T1DM的发病率为19.1/10万人年,年平均增幅为4%[4]。近年来,西方国家T 1 DM 儿童发病率有逐渐放缓的趋势,如新西兰1977至2006年儿童T1DM的年平均增幅为2.9%,但2006至2019年年平均增幅仅为0.3%,其中0~4岁儿童发病率在2003—2009年间未出现显著增加,提示发病有放缓趋势[5]。30多年前我国儿童T1DM的发病率是全世界有报道的国家和地区中最低的,以上海为例其发病率仅为0.96/10万人年[6]。随着我国经济的发展,我国儿童T1DM发病率出现了快速升高,2014 年笔者团队调查上海儿童T 1 DM 长达15 年的长期流行病学变迁,发现10 年间年平均发病率为3.1/10万人年,年平均增速达14.2%,增长速度是国际平均增幅的3倍多,4岁以下儿童占新发患儿比例达22%,提示T 1 DM 的低龄化趋势[7]。同期浙江2007—2013 年的数据分析表明,浙江儿童T1DM的发病率已达2.02/10万人年(95%CI:1.92~2.12),年平均增福为12%[8]。北京地区最新的资料显示0~14岁儿童T1DM发病率已达4.21/10万人年,在儿童至成年的各年龄段中,10~14岁是高发年龄,研究认为我国T1DM发病率存在低估的现象[9]。总体上我国近期报道的较大规模人群研究与日本相近,日本2013—2018报道0~19岁儿童青少年的T1DM发病率为3.94/10万人年[10]。
2 儿童T1DM的病因及易感因素
儿童T1DM区别于2型糖尿病在于其胰岛β细胞的自身免疫性破坏。T 1 DM 初发患者通常存在一种或多种自身抗体如胰岛素抗体、胰岛细胞抗体、谷氨酸脱羧酶抗体、蛋白质酪氨酸磷酸酶样蛋白抗体、锌转运体8抗体等抗体存在,新发患者抗体阳性率通常在95%以上。儿童出现胰岛的自身抗体通常预示着T1DM的起始,研究发现血清抗胰岛自身抗体阳性,通常6个月后转化为胰岛的自身免疫反应,在携带有T1DM遗传易感风险增加的儿童中,血清自身抗体阳性转化为胰岛自身免疫的峰值出现在12~24个月之间[11];约70%患有多种自身抗体的儿童在血清转化后的10 年内发展为T 1 DM[12]。人类白细胞抗原(HLA)区域的遗传变异在T 1 DM 遗传风险中占主导地位,风险最高的HLA单倍型是HLA DR 4-DQ 8 和HLA DR 3-DQ 2[13],在小年龄糖尿病患者环境决定因素(The Environmental Determinants of Diabetes in the Young,TEDDY)研究中,发现芬兰T1DM的发病率比美国高78%,即使在调整HLA基因型、家族史和非HLA 易感位点也是如此;研究也提示在过去的20~40年间,具有最高风险HLA基因型(DR4-DQ8或DR3-DQ2)的T1DM儿童比例有所下降,而具有中等风险HLA基因型的比例有所增加,这一发现可能是因为随着环境风险因素暴露的增加,中度风险HLA基因型的外显率随着时间的推移而增加。笔者和国内其他单位合作的多中心研究,在中国人群中也发现了多种免疫调控有关的基因单独或者与HLA基因存在相互作用并与T 1 DM 发病有关,如KIR基因及HLA-C基因相互作用增加儿童T1DM的易感性[14]、固有免疫系统Toll样受体[15]、PTPN22基因启动子区域[16]、BTN3A1和GATA3等基因多态性和儿童T 1 DM 存在相关性[17];有研究也提示胎儿HLA和母亲KIR基因存在相互作用,可能为儿童T1DM早期起病的机制[18]。在各种环境因素中,与发病密切的主要是饮食、营养因素。有前瞻性研究表明,儿童期牛奶摄入的增加会增高T 1 DM的风险,每增加1 g奶粉摄入相对危险度(HR)增加1.05倍[19],摄入每增加16 g奶粉从胰岛自身免疫发展为T 1 DM 的HR 增加1.59 倍[20]。病毒感染如肠道病毒、呼吸道病毒、小核糖核酸病毒、母亲病毒感染等均曾报道与T1DM的产生有关,但不同的研究相关性存在不一致性。DAISY 研究提示血清中肠道病毒的存在增加胰岛自身免疫发展为T 1 DM 的风险[21],但TEDDY 研究发现粪便肠道病毒B 持续时间长,胰岛发生自身免疫的风险约增高3~4 倍,但与T1DM是否发生无关[22]。关于T1DM与“新型冠状病毒”流行的关系:罗马尼亚研究提示T 1 MD 发病率增加16.9%[23];英国多中心研究提示新发患者增加80%且糖尿病酮症酸中毒发病率高达70%[24];但德国的研究提示德国儿童T 1 DM 总体发病率变化不显著[25]。生命早期环境的卫生程度也与T1DM发病有关,据推测,早期接触微生物产品和感染可以刺激免疫系统,降低过敏和自身免疫性疾病的风险。减少接触寄生虫,如蛲虫,被认为是免疫介导疾病增加的原因;抗生素的使用导致肠道菌群紊乱,但儿童期抗生素的暴露与T 1 DM 的关联性尚未证实[26]。其他如疫苗接种、环境内分泌干扰物、毒物接触等与T1DM发病的关联性也有报道,但重复性存在一定的差异,未来随着宏基因、代谢组学等多组学研究的引入,也许能更详细地阐述潜在的环境风险因素。
3 糖尿病慢性并发症
糖尿病慢性并发症(diabetic chronic complications,DCC)是影响儿童长期生存质量的关键因素。儿童DCC 的临床常见类型有糖尿病肾病(diabetic nephropathy,DN)、糖尿病眼部并发症、糖尿病神经病变和大血管并发症。在T1DM的自然病程中,DN发生率约为25%~40%,约占终末期肾脏疾病的50%,约20%~30%患者在T1DM平均病程15 年时出现微量白蛋白尿[27]。美国青少年T 1 DM平均发病3.2年后有20%存在不同程度糖尿病眼病,20岁以上T1DM,糖尿病病程<10年眼病发生率为20.53%,10~20年增至55.55%,儿童青少年增殖性眼病的发病率从低于10%到高达27%不等[28]。T 1 DM 病程5 年以上儿童糖尿病神经病变超过50%,新诊断患者中超过25%存在神经传导速度异常。对糖尿病DCC的影响因素的长程队列研究表明,糖尿病眼病的最大危险因素依次为平均HbA 1 c 升高、T1DM持续时间延长、尿白蛋白排泄率升高和平均舒张压升高,其中起最大关键作用的还是HbA1c的水平[29]。在一些血糖控制较好的国家如丹麦儿童T1DM患病12、15、18年的糖尿病眼病发病率分别仅为0.9%、2.3%、3.1%[30]。在血糖控制比较差的发展中国家如巴西发病年龄为(8.9±4.3)岁、平均病程为(8.1±4.3)年的13~19岁儿童中,DCC总患病率高达31.4%,其中慢性肾脏疾病为14.0%,心血管自主神经病变为12.5%,糖尿病眼病8.5%,神经病变4.9%[31]。近年来,血糖控制不佳与儿童精神发育的关联性也得到重视,瑞典分析了1990—2013年全国T1DM儿童的精神运动发育发现血糖控制不佳儿童(HbA1C>8.5%)罹患精神运动发育疾病的风险为OR=1.51(95%CI:1.13~2.03),注意缺陷风险为OR=2.31(95%CI:1.54~3.45)[32]。研究发现近年来,我国儿童T1DM的血糖控制较20世纪90年代显著好转。翁建平等[33]报道广州儿童T 1 DM平均HbA1c为8.2%±2.0%,41.55%患儿血糖控制达标;笔者团队通过双中心研究发现,城市户籍儿童的HbA1c(7.9%)显著好于流动人口(8.4%),提示国内在加强城市儿童T 1 DM 血糖控制的同时,对流动人口儿童也需要设法加强[34]。
4 儿童T1DM发病过程自然病程及诊断
T1DM目前公认其发病过程经历3个阶段(表1),第一阶段主要为患者经促发因素诱发免疫异常,随后逐渐发展为糖尿病临床期,由于目前T1DM国内外均无经济可行的群体筛查研究,因此通常情况下T1DM一旦发现均为典型的临床期[35]。
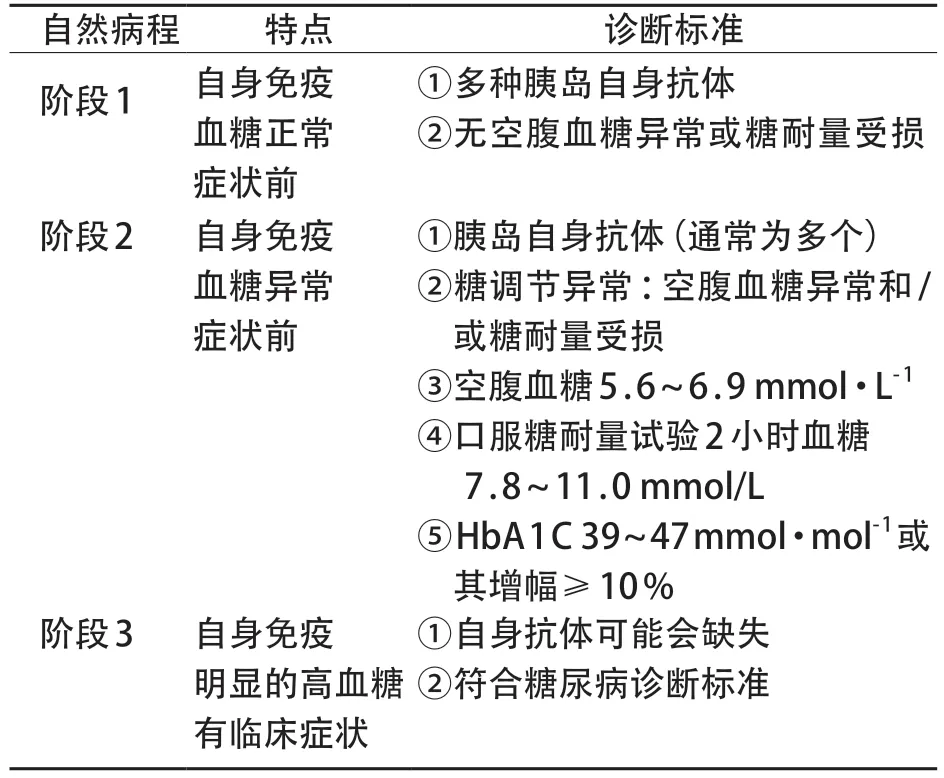
表1 T1DM发病的自然病程
1980年世界卫生组织(World Health Organization,WHO)首次颁布了糖尿病诊断标准,2019 年WHO又颁布了糖尿病最新分型标准[36],符合下述4条中的1条可诊断糖尿病:(1)空腹血糖值≥7.0 mmol/L(至少8 小时无热量摄入);(2)口服糖耐量试验(OGTT)糖负荷后2小时血糖值≥11.1 mmol/L(葡萄糖1.75 g/kg,最大75 g);(3)HbA1c≥6.5%(测定方法需National Glycohemoglobin Standardization Pogram认证);(4)随机血糖值≥11.1 mmol/L且伴糖尿病症状体征或高血糖危象;符合上述标准但对于在无症状者建议在随后的一天重复检测以确认诊断。此外,血糖5.6~6.9 mmol/L为空腹血糖受损,OGTT 2 h血糖 7.8~11.0 mmol/L为糖耐量受损。由于我国HbA 1 c 测定方法普遍未参与美国糖化血红蛋白标准化计划认证,因此第3 条不建议作为日常临床诊断标准。关于糖尿病的分型,目前常采用WHO标准、美国糖尿病协会标准。2022年,国内在2019 年版WHO 标准[36]基础上,周智广等[37]撰写了糖尿病分型诊断中国专家共识,建议根据病因将糖尿病分为T1DM、单基因糖尿病、继发性糖尿病、GDM、未定型糖尿病和2 型糖尿病共6 种类型;美国糖尿病协会建议将糖尿病分为T 1 DM、糖尿病前期和2型糖尿病、囊性纤维化相关糖尿病、移植后糖尿病、单基因糖尿病综合征(新生儿糖尿病、成年起病的青年型糖尿病)、胰腺糖尿病或外分泌胰腺疾病背景下的糖尿病、妊娠期糖尿病[38]。中华医学会儿科学分会内分泌遗传代谢学组2020年专家共识[39]建议我国儿童糖尿病分型采用WHO 分型标准[36],其中涉及儿童的主要为T1DM、2型糖尿病、特殊类型糖尿病和未分类糖尿病,未分类糖尿病仅在病程初期无法分型时采用。WHO 标准和美国ADA 标准诊断T 1 DM 有显著的不同点在于是否存在特发性T 1 DM,美国ADA 标准认为有些类型的T 1 DM 没有已知的病因,此类患者有永久性胰岛素缺乏症,易患酮症酸中毒,但没有证据表明存在胰岛β 细胞自身免疫,只有少数T 1 DM 患者属于这一类;在非洲或亚洲血统的自身抗体阴性T 1 DM 患者可能患有偶发性糖尿病酮症酸中毒,并在发作期间表现出不同程度的胰岛素缺乏(可能是酮症倾向性糖尿病);具有强烈的遗传性,与HLA 无关;患者对胰岛素替代治疗的绝对需求可能是间歇性的,WHO 标准认为此类患者实际上在临床上基本不存在,因此T1DM只有自身免疫型一个分类。笔者从个人临床诊疗经验出发认为文献描述的特发性T 1 DM 临床十分罕见,且符合单基因糖尿病的特点,既往由于基因测序技术落后可能难以明确病因,未来加强病因研究有可能发现明确的病因。经典的自身免疫性T 1 DM 多数起病急,可伴酮症酸中毒;通常病初C肽低于正常或检测下限;抗谷氨酸脱羧酶(GAD65)、胰岛抗原-2(IA-2)、ZnT 8 转运体或胰岛素抗体阳性;无黑棘皮病;T 1 DM 阳性家族史2%~4%。可伴其他自身免疫性疾病,如Graves 病、桥本甲状腺炎等。
5 T1DM的治疗
T 1 DM 不论是儿童还是成年患者,其总体治疗方案经过30多年的探索、完善形成了一个相对固定的综合疾病管理模式,包括药物治疗、血糖监测、健康教育、运动和营养管理5个方面。国际上发达国家比较强调对T1DM的多学科管理,特别是对心理行为的教育,笔者根据国情,整理了美国糖尿病协会2022年度儿童糖尿病标准化管理指南中的多学科管理要点,见表2[38]。

表2 美国糖尿病协会2022年度儿童糖尿病标准化管理指南[38](节选)
儿童T1DM胰岛素剂量需要按照病程不同的阶段和特点个体化选择胰岛素种类、剂量和注射方法,合理的剂量是指在不引起明显低血糖的情况下,使血糖控制达到最佳水平以确保儿童的正常生长和发育[39]。一般新发T1DM患儿每日胰岛素总量为0.5~1.0 IU·kg-1·d-1,但3岁以下建议0.5 IU ·kg-1·d-1起始;蜜月期通常小于0.5 IU·kg-1·d-1;缓解期患者青春期前为0.7~1.0 IU·kg-1·d-1;青春期为1.0~1.5 IU·kg-1·d-1,个别可达2 IU ·kg-1·d-1。儿童不建议使用动物源性胰岛素和预混胰岛素。胰岛素注射的次数常用三餐前短效+睡前中效胰岛素或三餐前速效+睡前长效胰岛素。除了常规笔式注射器外,胰岛素泵治疗通过人工智能控制的持续皮下输注胰岛素可最大程度模拟生理性胰岛素分泌模式,但长期有效性受生活方式、运动等多因素的影响。血糖控制的标准需差异化、个体化;对使用胰岛素泵(CSII)、有能力进行规则血糖监测或使用动态血糖监测的患儿以及具有部分残存β 细胞功能的新发T 1 DM 患儿,建议HbA 1 c 控制目标值<7%;对于不能准确识别低血糖及较频繁低血糖、既往有严重低血糖或医疗资源落后地区的T 1 DM 患儿,建议HbA1c控制目标值<7.5%。血糖控制目标为平均葡萄糖水平<6.6 mmol/L,目标范围3.9~10.0 mmol/L 内时间≥70%;血糖<3.9 mmol/L 时间低于4%,血糖<3.0 mmol/L 时间低于1%,血糖>10.0 mmol/L 时间低于25%[40]。
6 T1DM治疗的未来方向及潜在新技术
6.1 人工胰腺技术
美国青少年糖尿病研究基金会于2005 设立人工胰腺技术(artificial pancreas,AP)研究项目,AP融合了血糖自动测量和胰岛素调整技术,第一代AP 系统可以显著改善胰岛素低血糖发生的频率,但餐后高血糖控制欠佳。2019 年美国FDA 批准了新一代混合半自动AP 系统,具有低血糖预测功能并提前停止胰岛素注射和在血糖上升时同时开启胰岛素泵的功能,在输入进餐的碳水化合物信息后可能自动注射大剂量餐时胰岛素,批准用于治疗年龄≥7 岁的T 1 DM 儿童。在7~13 岁的儿童研究中,发现65.0%±7.7% 的时间可以将血糖控制在目标范围内,血糖低于3.9 mmol/L 的时间为<1.6%~3.0%[41]。
后续尚有多种AP系统在研发改进中。儿童使用AP 系统存在的最大问题是进食和活动习惯比较难以预测,甚至忘记餐前量输入,存在生长发育的动态变化,对低血糖识别和表述能力欠佳。随着人工智能技术的不断进展相信未来有可能出现更智能化的人工胰腺技术[42]。
6.2 干细胞移植治疗
T 1 DM 的胰岛β 细胞被广泛的破坏,因此胰岛β 细胞功能替代治疗是其治愈的希望。由于人类胰岛β细胞的稀缺性,干细胞移植是目前研究的重点。研究的路径主要有:从胚胎干细胞和诱导性多能干细胞(iPSCs)生成胰腺祖细胞,从胚胎干细胞和iPSCs生成胰岛类器官/胰岛,从胰腺干细胞生成胰腺嵌合体,成体干细胞向胰岛分化等,但由于T 1 DM 本身的自身免疫特征,因此诱导分化的胰岛细胞仍有被破坏的可能,需要未来进一步研究[43]。
6.3 免疫治疗
直接针对T1DM产生的自身免疫机制,进行靶向干预,也是目前国内外T1DM新型治疗方法的研究重点。免疫治疗包括细胞定向干预,针对T效应细胞的抗体,如抗CD3抗体teplizumab和otelixizumab对β细胞功能的丧失有一定的抑制作用;细胞因子靶向干预如使用英夫利昔单抗、阿达木单抗或受体融合蛋白依那西普阻断或拮抗促炎细胞因子TNF-α可改善血糖控制和C 肽分泌;抗原疫苗接种,通过β细胞抗原疫苗调控自身攻击性T效应细胞和自身抗原特异性调节性T细胞之间的平衡诱导免疫耐受,促进下调促炎性抗原递呈细胞等。目前为止免疫治疗T1DM活性已经开展了多项临床研究,但取得的效果往往是暂时的或者部分有效,因此还有待未来进一步研究[44]。
总之,儿童T1DM的快速增长对儿童健康成长构成重大威胁,低龄化的倾向导致其管理尤为困难,个体化综合管理是儿童T1DM良好血糖控制的重要保障。不断加强儿童T1DM的病因和致病机制研究有可能发现潜在的干预方法,胰岛细胞的替代治疗和免疫干预等新方法的研究有可能为未来糖尿病提供全新的治疗。
