13号染色体三体、嵌合体及单亲二体的临床特征及产前诊断
2022-05-16谢天薛婷刘维强章钧田琪
谢天薛婷刘维强 章钧田琪
(1.中山大学附属第三医院 产科产前诊断中心,广东广州 510630;2.深圳市龙岗区妇幼保健院 中心实验室,广东 深圳 518172)
13号染色体为D组近端着丝粒染色体,全长共115 169 878个碱基,编码基因1454个,其中OMIM注释基因279个(https://www.gena.tech/)。13号染色体涉及的染色体病包括:13号染色体三体综合征,13号染色体部分遗传物质的不平衡易位(包括单体和三体),13号染色体遗传物质异常的嵌合体以及13号染色体的单亲二体(uniparental disomy,UPD)。本综述将分别介绍疾病的流行性特点、临床表型、检测方案与临床应对策略,以期对遗传发育相关的基础研究工作者和临床遗传咨询工作者有所帮助。
1 13号染色体三体综合征
1.1 13三体的发现及流行病学 13-三体综合征又称Patau综合征,遗传学表现为13号染色体整条拷贝数增多。13号染色体三体在产前和产后均有案例报道,女性明显多于男性。13三体的发病率约为1/10 000,且发病率有增加的趋势,与预产期大于35岁孕妇的比例增加有关[1-3]。约50%的13-三体患儿发生自然流产或宫内死亡,而活产的13-三体多在出生后1个月内死亡,平均存活时间为130天[4, 5],有少量案例报道通过借助辅助医疗设备可延长患儿生存期[6]。
1.2 13-三体的发生机制 80%的13-三体核型表现为47,XN+13,称为标准型,发生机制是由于生殖细胞减数分裂过程中发生染色体不分离,产生13号染色体二体配子,其中90%标准型13-三体为卵细胞减数分裂异常所致,通常发生在M1期,与孕妇年龄有关。约16%的13-三体为罗伯逊易位型,以13号和14号染色体易位多见,核型表现为46,XN,der(13:13)(q10:q10)或46,XN,der(13:14)(q10:q10),通常为新发变异。另有少部分表现为嵌合型13-三体,由于受精卵在早期有丝分裂过程中染色体不分离所致。
1.3 13-三体的临床表型 13-三体患儿表现为多器官畸形,产前超声可提示。特征性表现包括全前脑畸形、枕骨区头皮缺陷、心脏畸形、轴后多指(趾)和眼、唇畸形[7]。具体表现如下:①中枢神经系统发育异常:中度小头畸形,全前脑畸形,伴不同程度的嗅神经和视神经发育不良,幸存者有严重的智力障碍;②头面部发育异常:枕骨区头皮缺陷,小眼、眼距宽,鼻梁低,唇腭裂,耳廓畸形;③手脚发育异常:60%有通贯掌,手指弯曲,轴后多指(趾),摇椅形足底等;④心脏发育畸形:80%以上患儿有先天性心脏病,主要表现为室间隔缺损,其余为房间隔缺损、动脉导管未闭和心脏右移位等;⑤生殖器发育异常:80%的男性可有隐睾及阴囊畸形,女性可有双角子宫及双阴道;⑥可涉及其他多脏器畸形:脐疝、腹疝、多囊肾等[8, 9]。
1.4 13-三体的治疗及再发风险 13-三体目前尚无有效的治疗手段。出生后的患儿预后差,约80%在出生后1个月内死亡,生存期取决于畸形的严重程度、气管内插管等生命支持,手术纠正畸形可适当延长患儿生存期[10]。几乎所有的标准型13-三体综合征都属新发,目前暂无证据表明标准型13-三体的再发风险会高于正常人群。父母之一为非同源染色体罗氏易位携带者的再发风险为1%~5%,若为13号同源染色体罗氏易位携带者,早期流产风险极高。嵌合型13-三体综合征发生在受精卵第一次有丝分裂后,再发风险低。有13-三体流产史的正常夫妇在下次妊娠时需行介入性产前诊断,送检胎儿染色体核型分析和染色体微阵列分析(chromosomal microarray analysis,CMA)检测。
2 13号染色体嵌合体
2.1 流行病学 13-三体可以是完全的、部分的或嵌合的,嵌合型13-三体指在一些个体中,一部分细胞为13-三体,而其余细胞均为整倍体。这种嵌合型三体占13-三体总数大约5%。
2.2 嵌合型13-三体临床表现度差异 与完全型13-三体相比,嵌合型13-三体的患者,表现度存在差异[3, 11],可能包括异常的皮肤色素沉着和更长的存活时间。这种变异的原因在于表型是根据细胞在特定组织中的分布而改变的。但是,并不能完全的归咎于这一因素。因此,13-三体嵌合体患者的表型和预后尚未得到很好的定性[12]。从严重缺陷并早期死亡(类似于完全13-三体的表型)到少量正常发育伴畸形特征等均可出现[13]。
Griffith等[14]研究13-三体嵌合体49例(文献复习47例,新发2例)。最常见的畸形包括耳廓畸形、唇腭裂和各种先天性心脏病。患者智力发育存在差异,智力正常(6例)到明显的智力发育迟缓均可出现。13-三体细胞比例与智力水平无明显相关性。另一方面,患者中三体细胞有多样化的表达,这些特点使临床诊断和预后困难。
2个13-三体嵌合体的病例报道提示[46]:嵌合比例分别是24%和40%,第1例为10岁男性自闭症谱系障碍、轻度智力障碍患儿,诊断为中枢神经系统结构改变;第2例女性患儿,新生儿3个月死亡。虽然在这两个新病例中,三体细胞的比例均低于整倍体细胞,但临床表现严重,需要详尽的医学随访。
2.3 嵌合型13三体产前、产后临床表现 2019年Cammarata-Scalisi等[15]以完全型13-三体的表型为对照,发表嵌合型13-三体2例,并总结其出生后的详细表型。
2.3.1 新生儿女性,细胞遗传学结果为46,XX[33]/47,XX,+13[11],嵌合比例为17.5%,孕期超声产前诊断表现为唇腭裂,35周剖宫产低出生体重儿,出生体重2200g(10~50百分位),身高45cm,她因多发先天畸形和败血症入院,接受抗生素治疗,黄疸需要光疗,2次出现心肺骤停,12天体检发现轻度紫绀、头围31.4cm(小头畸形)、前囟门2cm×2cm、眼低、单鼻孔、鼻中隔缺失、唇腭裂、短颈、漏斗胸、胸腹部收缩期杂音Ⅲ/Ⅵ级;神经系统检查发现肌张力增高。经超声显示Ⅲ级脑基质出血,在大脑层面没有发现其他中线异常。双眼均发现有小角膜和核心斜视。心血管检测到2.3mm的持续动脉导管和3.6mm的房间隔缺损。腹部肾脏B超提示左肾盂扩张。实验室检查显示血小板计数低、低血糖和高尿酸血症伴无代偿性代谢性酸中毒。病儿出生18d出现心肺骤停,对复苏措施没有反应去世。家族史背景为母亲28岁第3次怀孕,曾生育一男婴于出生时死于急性胎儿窘迫;一女婴为健康的近亲结合产物。妊娠末期出现子痫前期和尿路感染。
2.3.2 另1例新生儿女性,细胞遗传学结果为46,XX[34]/47,XX[12],嵌合比例为15%,宫内发育迟缓、无前脑和唇腭裂。32周患儿顺产,出生体重1850g(10~50百分位),身高44cm(25~50百分位)。第1分钟和第5分钟Apgar评分5分和7分,需要复苏。多发性先天畸形、发烧和败血症风险而住院,抗生素治疗。出生6天的体格检查:皮肤粘膜色素沉着,小头,头围30.6cm(<3%),前囟门3cm×2cm,后囟门1cm×2cm,眼低,单鼻孔,鼻中隔缺如,中腭裂,短颈,胸腔积液,胸腹脐疝。神经系统检查发现张力增高。额叶区、肩部、后胸部和双臂多毛(图1)。经颅B超提示脑实质变薄,无回旋,脑结构异常,严重的无前脑。心室重度扩张,心血管评估显示心脏结构健康,腹部超声未见异常。实验室检查:低血糖、高胆红素血症和低钙血症。家族史背景为母亲31岁,第4次怀孕,2个健康的孩子,第3次生产先天性心脏病患儿28天后死亡,非血缘结合。
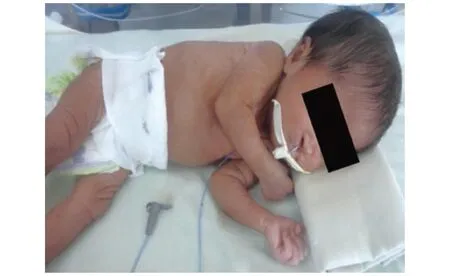
图1
2.4 双非整倍体嵌合(与13+相关) 2种不同非整倍体细胞系的双非整倍体嵌合体现象是非常罕见的。迄今为止的三体组合包含13号染色体已发表的有chr13和18、chr13和21、chr13和X、以及chr13和7[16-19]。Karin等于2012年第一次发表描述了一个7号和13号染色体双重三体嵌合体,75%的细胞为13-三体,均为母源减数分裂不分离导致,胎儿多发畸形、生长受限、双侧唇腭裂(7/13)、严重小颌畸形(13)。头颅表现为轻度短头畸形,小脑池扩大(>95百分位)(7/13)。左手小指弓形(13),有轻微的棒状足(7/13)。拒绝血清学唐氏筛查、颈项透明层厚度(nuchal translucency,NT)筛查,羊膜腔穿刺术原位培养的羊水细胞核型分析提示为:mos47,XX,+7[6]/47,XX,+13[18],女婴22+2周终止妊娠。出生后体格检查提示:双侧唇上颚裂以及下颌后突(7/13),左上腹部消化道旋转不良(13),双角子宫(13)。生长发育水平在特定胎龄的正常范围。X光显示骨骼系统未见异常。大脑发育未见异常,小胶质细胞上调,缺氧损伤,胎盘轻微退化。
完全型13-三体存在的临床表现及13-三体患儿各表现出现的频率[45],低于20%的2例嵌合型13-三体存在这其中的表型如表1所提示。
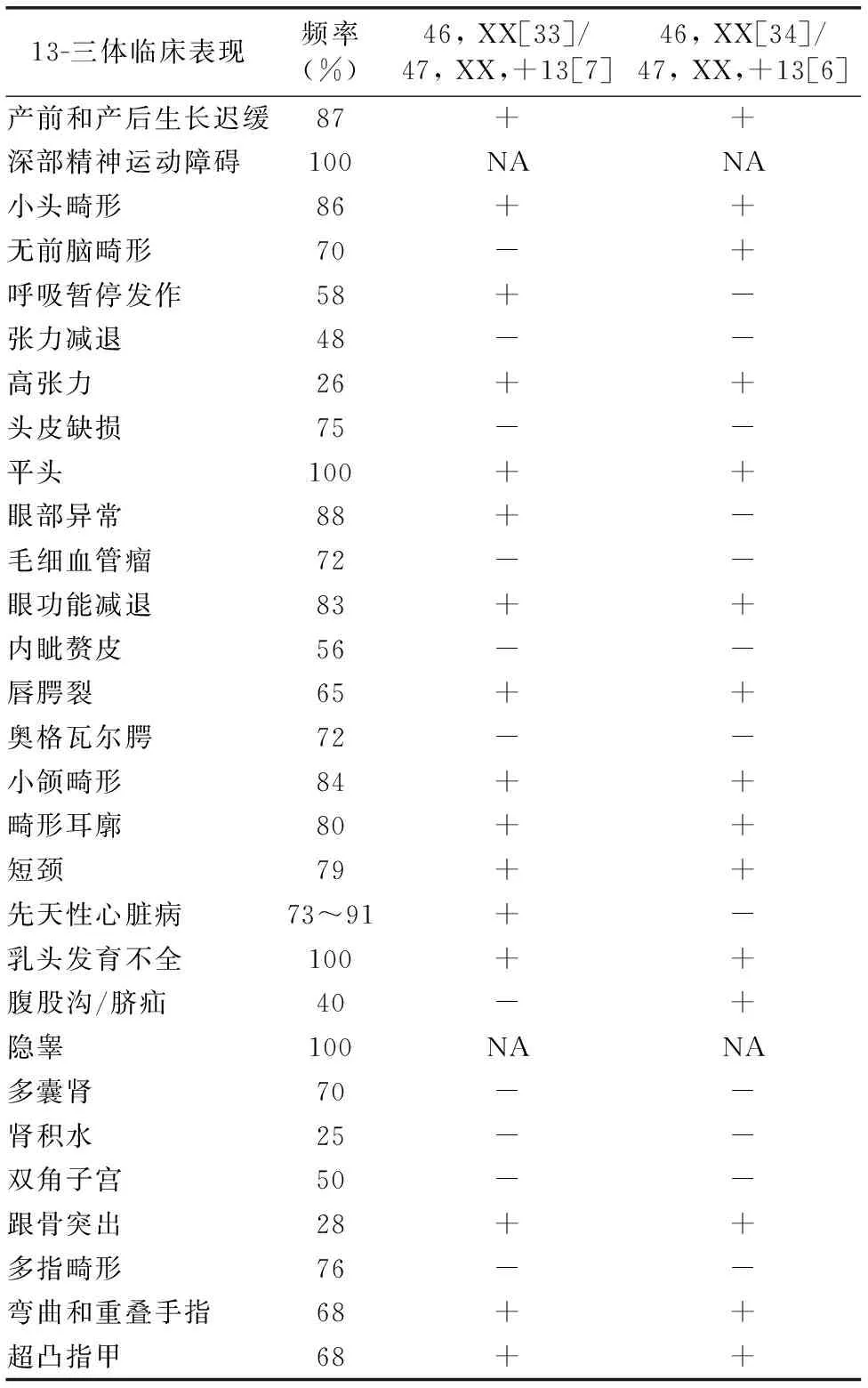
表1 嵌合型13-三体临床表现频率
2.5 产前诊断羊膜腔细胞13三体嵌合的预后及临床表现 Wilson等[20]在6000份羊膜穿刺术样本中,发现Ⅲ级嵌合体占比0.2%。Hsu等[21]在22 000例羊膜穿刺术标本中发现50例(0.23%)真正的嵌合染色体,仅2例为真嵌合13-三体。Hsu等[22]发表羊膜穿刺术标本179 663例中真正的嵌合染色体555例,占0.31%。
Chen等[3]于2017年报道1例羊膜腔细胞嵌合13-三体,预后良好。35岁,孕18周,因高龄而接受羊膜穿刺术。羊水染色体核型结果为47,XY,+13[5]/46,XY[20],嵌合比例20%;微阵列比较基因组杂交(array-based comparative genomic hybridization,aCGH)分析提示arr[GRCh37](13)×3[0.10],(X,Y)×1,10%的13-三体嵌合,产前超声检查未见明显异常,孕21周重复羊膜穿刺术,对未培养的羊膜细胞进行间期荧光原位杂交(fluorescent in situ hybridization,FISH)分析显示:13-三体嵌合比例为10%(10/100细胞)。对未培养的羊膜细胞进行aCGH分析,结果与10%的嵌合体水平相符,常规细胞遗传学分析显示23/23个46,XY的核型菌落。孕37周,分娩3600克的正常男婴,8个月随访婴儿身体状况良好,精神运动和生长发育正常。外周血核型为46,XY,对未培养的尿细胞进行间期FISH分析,显示出4.4%(2/45细胞)的三体细胞。
未培养和培养的羊膜细胞之间存在细胞遗传学差异。案例表明,未培养的羊膜细胞aCGH和FISH分析有助于快速确认重复羊膜穿刺术时13-三体的低水平真嵌合。羊水低水平的真性13-三体嵌合存在有利的胎儿结局。Hsu等[22]发表45%(5/11例)的羊水13-三体嵌合体具有非正常的表型。Wallerstein等[23]报告40%(10/25例)的羊水13-三体嵌合体具有非正常的表型,包括5例多发先天畸形、2例宫内生长受限、3例宫内死亡。Wallerstein等[23]在低于50%比例的13-三体嵌合羊水样本中,有26.7%(4/15)的异常表型的风险,10例高于50%比例的13-三体嵌合羊水样本中,存在60%(6/10)异常表型的风险。Wallerstein等[23]发现羊水嵌合型13-三体的患者中,平均嵌合比例为58% (范围:6%~94%),而在正常出生的情况下,平均嵌合比例为9.3%(范围:5%~13%)。
羊水嵌合型13-三体可正常或接近正常出生,Delatycki[24]报道了2例羊水嵌合型13-三体病例结局很好。均为II级嵌合,为3岁6个月及17月龄正常正常儿。Di Giacomo等[25]报道了1例羊水嵌合型13-三体预后良好,至2岁时没有畸形特征,羊水提示70.6%(24/34)嵌合比例,脐血提示10%(10/100细胞)嵌合比例,新生儿血中有10.3%(11/107)嵌合比例,外周血2岁时血液有15.8%(18/114)嵌合比例,口腔黏膜细胞、皮肤成纤维细胞、尿路细胞FISH分析显示为0%(0/103),5%(29/575)及23%(13/56)。Etoubleau等[26]报道了1例真性13-三体嵌合体患者,6岁时表现正常。2例羊水13-三体嵌合比例为14.3%(3/21)和0%(0/14),间期FISH分析重复羊膜穿刺术显示6%(14/235)花叶病三体13、脐血取样显示核型正常儿童颊部涂片的马赛克少于1%(2/203)13-三体。
两次羊膜穿刺术提示嵌合比例为14.3%(3/21)和0%(0/14),重复羊膜穿刺间期FISH分析显示6%(14/235)嵌合比例、脐血显示核型正常,儿童颊粘膜嵌合比例少于1%(2/203)。
Chen等[27]报告了1例羊水高比例嵌合13-三体综合征,耳位低,第12肋缺失,室间隔缺损,8个月大时发育正常,两次羊膜穿刺术显示13-三体阳性率为77.4%(24/31)和78.3%(36/46)。脐带血取样显示13-三体比例为14%(14/100)。6月龄时皮肤、心脏组织和外周血细胞核型正常。
综上所述,羊水13-三体的低水平嵌合并无超声异常胎儿可能预后良好,未培养的羊膜细胞间期FISH和aCGH分析有助于快速确认13三体低水平真嵌合。
2.6 产前诊断绒毛膜绒毛取样(chorionic vellus sampling,CVS)细胞13-三体嵌合的预后及临床表现 Fryburg等[28]检测1724份绒毛穿刺样本,提示20例13-三体嵌合的病例,其中仅1例为真13-三体胎儿嵌合病例。Chen等[29, 30]综合25例绒毛穿刺术13-三体限制性胎盘嵌合的病例,15例为正常表型出生;10例为异常表型,异常患儿中胎盘嵌合比例由0~96%不等(重复穿刺),出生后验证结果仅有2例,嵌合比例分别为6%、11%。叶状黑色素沉着症与嵌合型13-三体有关[28]。
2.7 双胎之一13-三体嵌合的预后及临床表现 Ramsey[31]等报告了1例单卵双胞胎,羊水细胞核型不一致,B超提示A胎为(47,XY,+13),B胎正常(46,XY),出生前后进行合子测试为单合性。A胎出生后给予生命支持6d死亡, B胎出生后50个受检细胞中有5个是13-三体,具有比例为20%的13号三体嵌合。体格检查无异常,出生评分好。
3 13号染色体 UPD
3.1 13号染色体发生机制及概况 UPD是指来自父母一方的染色体片段被另一方的同源部分取代,或一个个体的两条同源染色体都来自同一亲本,前者通常称为片段性单亲二体,后者则是完全性单亲二体。导致单亲二体的机制通常包括[32]:①三体挽救,即减数分裂早期染色体不分离形成三体合子,三体合子丢失一条染色体形成单亲二体;②单体自救,即通过复制单体染色体,导致整个染色体为同源染色体;③配子互补,即合子来自于二体配子和无体配子的结合;④有丝分裂异常,即正常受精后染色体间交换,导致染色体单体分离重组后染色体中存在纯合区域,进而形成片段性单亲二体。目前的研究表明13号染色体上无父系印迹基因,理论上父源性13号染色体单亲二体无不良临床表现;印迹基因网站记载(www.geneimprint.com)13号染色体长臂存在两个母系印迹基因,即RB1和ATP5EP2基因,但该基因甲基化异常可导致的临床表现有待进一步研究积累[33],也有既往病例报道母源性单亲二体临床表型正常[34]。虽然母源性或父源性13号染色体单亲二体无严重临床表现,但13号染色体单亲二体可增加隐性遗传病的发病风险[35-37]。
3.2 13号染色体单亲二体的临床特征 产前及产后均有研究报道父源及母源性13号染色体单亲二体,多数均无严重临床表现。Soler等[38]报道了1例产前13号父源性UPD的病例:产前诊断检测绒毛样本的核型为46,XX,-13,der(13,13),羊水及脐血标本的核型为45,XX,der(13,13),父母核型均正常,该女孩在孕39周时出生,表型正常,3个月大时生长发育及精神运动发育均正常,脑部、腹部检查及超声心动图均正常。Jarvela等[39]报道了1例产前羊水染色体核型为:45,XY,-13,-13,+ i(13)(q10),经短串联重复序列检测技术(short tandem repeat,STR)位点验证,羊水13q染色体均来自母亲,孩子在孕40周时出生,表型正常。Berend等[40]报道了2个病例,病例1胎儿的核型为45,XX,der(13;13)(q10;q10),妊娠20+周的超声检查显示双侧第五指中指骨发育不全可能,胎儿超声心动图正常,30+周的超声评估发现间隔期发育良好,但羊水量减少,因此胎儿提前3周娩出,孩子出生体重2466克,在1min和5min时Apgar评分分别为8分和9分,新生儿期未发现异常,患者在3个月时评估发现有双侧小指轻微倾斜,视力和听力均正常,喂养良好。病例2是1例染色体核型为45,XY,der(13;13)(q10;q10)的胎儿,母亲是rob(13;14)(q10;q10),父亲核型正常。胎儿出生时表型正常,15岁时随访未见异常。Slater等[41]描述了1例染色体核型为45,XY,-13,-13, + t(13;13)( p11.2; p11.2)的男性,表型正常,他的t(13;13)( p11.2; p11.2)遗传自母亲,表型正常。文献提示13号染色体上可能缺乏父系或母系关键的印迹基因[42]。文献提示13号染色体上可能缺乏父系或母系关键的印迹基因[43]。
13号染色体单亲二体增加了隐性遗传病的发病风险。Silverstein等[44]报告了1例女性儿童精神分裂症、多动症和运动抽搐障碍患者,其核型为45,XX,i(13)(q10q10),13号染色体均为父源性来源,该患者临床表现可能与精神分裂症相关基因DAOA和5-HTR2A的纯合状态有关。有文献报道[38,39,45],13号染色体单亲二体可能造成慢性淋巴细胞白血病,该疾病的发生可能与 13q14上的MIRN15A/MIRN16-1基因的纯合缺失相关。Berend等[40]发现2例母源13号染色体单亲二体患者,均因携带GJB2基因35delG纯合突变导致听力损失。Coffey等[37]报道了1例因13号染色体母源片段性单亲二体的病例,因ATP7B基因纯合变异导致肝豆状核变性疾病。
3.3 13号染色体单亲二体预后再发风险评估及遗传咨询 目前尚无充足证据表明13号染色体单亲二体可导致严重的临床表现,通常预后较好,甚至表型正常。但因13号染色体单亲二体导致的隐性遗传病需对症治疗。
13号染色体单亲二体的再发风险与夫妻双方是否携带有13号染色体罗伯逊易位相关,有文献报道[48]rob(13q;14q)携带者(母亲或父亲)中,胎儿产生UPD的风险约为0.65%;若产前诊断为13号染色体单亲二体,建议完善隐性遗传病相关检测,以便为孕妇及家属提供更详细的遗传咨询及可能的预后结果。
