PCR-荧光探针法检测婴幼儿和儿童人鼻病毒的初步评估*
2022-05-14甘正飞欧顺婧邓国珍黄晓雪罗弘志
甘正飞,欧顺婧,邓国珍,黄晓雪,罗弘志,郑 杨,查 何
遵义医科大学第三附属医院(遵义市第一人民医院)检验科/中心实验室,贵州遵义 563000
人鼻病毒(HRV)属于小核糖核酸病毒科肠道病毒属,是一组单股正链小分子RNA病毒,是引起人类呼吸道感染的最常见病原体之一[1]。HRV是婴幼儿和儿童上呼吸道感染的重要病原体,感染HRV后大多数患儿急性起病,表现为咳嗽、流清涕、鼻塞、喷嚏、声音嘶哑等普通感冒症状。近年来,有研究表明,HRV还可引起婴幼儿及儿童的下呼吸道感染,包括支气管炎及肺炎[2],是儿童哮喘性疾病的独立危险因素及加重的主要原因[3-4]。且HRV还可引起成人的慢性阻塞性肺疾病或伴免疫功能减弱者的下呼吸道感染[5-6]。临床对于HRV的诊断多基于血清学诊断结果,但其检测花费时间长,往往会延误患儿病程和增加医疗成本[7]。随着分子生物学技术的迅猛发展,快速、准确的分子诊断技术成为临床首选。目前测序法被公认为基因检测的“金标准”[8]。本研究主要探讨了PCR-荧光探针法相较于Sanger测序法对HRV的检测能力,并简要分析了HRV载量对婴幼儿和儿童临床指标的影响。现报道如下。
1 资料与方法
1.1一般资料 选取2019年5—7月遵义医科大学第三附属医院收治住院的有呼吸道感染症状的患儿175例为研究对象,并收集其鼻咽拭子标本和临床病例资料,其中男111例(63.43%),女64例(36.57%),年龄1月至13岁。纳入标准:(1)选取临床疑似为HRV感染的呼吸道感染病例,包括肺炎、支气管炎等;(2)性别不限,年龄≤13岁。排除标准:(1)样本量不足以检测;(2)不符合纳入标准;(3)病情危重,不能配合采集标本;(4)登记表记录核心信息不完整;(5)标本因收集或保存不当不能用于检测或检测失败。对于同一病例在不同时期采集的同类标本不得重复入组。本研究经遵义医科大学第三附属医院伦理委员会批准。
1.2仪器与试剂 核酸提取或纯化试剂盒与HRV核酸检测试剂盒(PCR-荧光探针法)均购自中山大学达安基因股份有限公司。ABI Prism 7500实时荧光PCR仪购自美国应用生物系统公司(Applied Biosystems)。
1.3方法
1.3.1标本采集和保存 将棉拭子轻轻转动,缓缓插入患儿鼻孔至颚部,停留片刻后缓慢转动退出,将鼻咽拭子置入无菌采样管,密封送检。所采集的标本可立即用于测试,或长期保存于-70 ℃冰箱中,也可以保存于-20 ℃冰箱中待测,保存期为6个月,标本应避免反复冻融。标本运送采用0 ℃冰壶或以泡沫箱加冰密封,低温运输时间不应超过8 h。
1.3.2检验指标 在175份标本中139例为普通病区住院患儿,36例为儿童ICU住院患儿。来自儿童ICU的患儿因不同病因导致其病情严重,因此本研究仅对普通病区住院,经PCR-荧光探针法判读为阳性的41例患儿的住院天数、入院前最高体温、发热天数、白细胞计数、淋巴细胞百分比、降钙素原及超敏C反应蛋白进行初步探讨。
1.4PCR-荧光探针法
1.4.1核酸提取 严格按照核酸提取或纯化试剂盒说明书进行操作。
1.4.2实时荧光定量PCR(RT-qPCR) 根据HRV核酸检测试剂盒说明书将HRV PCR反应液A与B室温融化后振荡混匀,8 000 r/min离心5~10 s后使用,按照所需将HRV PCR反应液A(17 μL)+HRV PCR反应液B(3 μL)加入总EP管振荡混匀并短时离心,然后分装到各PCR反应管中,向其中加入提取后的待测标本核酸、阴性质控品核酸、阳性质控品核酸5 μL,盖紧管盖,8 000 r/min离心5~10 s后扩增检测。ABI Prism 7500实时荧光PCR仪(美国ABI公司)设置扩增程序如下:50 ℃ 15 min,1个循环;95 ℃ 15 min,1个循环;94℃ 15 s→55 ℃ 45 s(采集荧光),共40个循环。
1.4.3质量控制 (1)HRV阴性质控品:FAM检测通道无扩增曲线,VIC检测通道有扩增曲线。(2)HRV阳性质控品:FAM检测通道有扩增曲线且Ct值≤32,VIC检测通道有或无扩增曲线。以上要求需在同一次试验中同时满足,否则,本次试验无效,需重新进行。
1.4.4结果判读 (1)若检测标本的FAM检测通道无扩增曲线,且该VIC通道有扩增曲线,可判标本为HRV阴性。(2)若检测标本的FAM检测通道有扩增曲线且Ct值≤40,VIC检测通道有或无扩增曲线,可判标本为HRV阳性。
1.5Sanger测序法 将PCR扩增后的标本外送华大基因公司(中国,广州)进行Sanger测序法测序,并将结果进行对比分析。
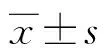
2 结 果
2.1两种方法检出结果比较 采用PCR-荧光探针法在175份标本中检出阳性标本51份(29.14%),阴性标本124份(70.86%)。采用Sanger测序法在175份标本中检出阳性标本48份(27.43%),阴性标本127份(72.57%)。两种方法检出率比较,差异无统计学意义(χ2=0.127,P>0.05)。见表1。与Sanger测序法比较,PCR-荧光探针法检测HRV的灵敏度和特异度分别为100.00%和97.64%,阳性预测值和阴性预测值分别为94.12%和100.00%,两种方法的一致率为95.80%,见表2。此外,有3份标本采用PCR-荧光探针法检出结果Ct值位于37~40,被判为阳性,而Sanger测序法检出为阴性。
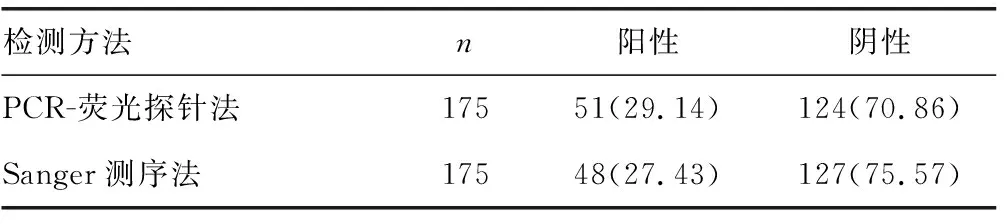
表1 两种检测方法检出结果比较[n(%)]
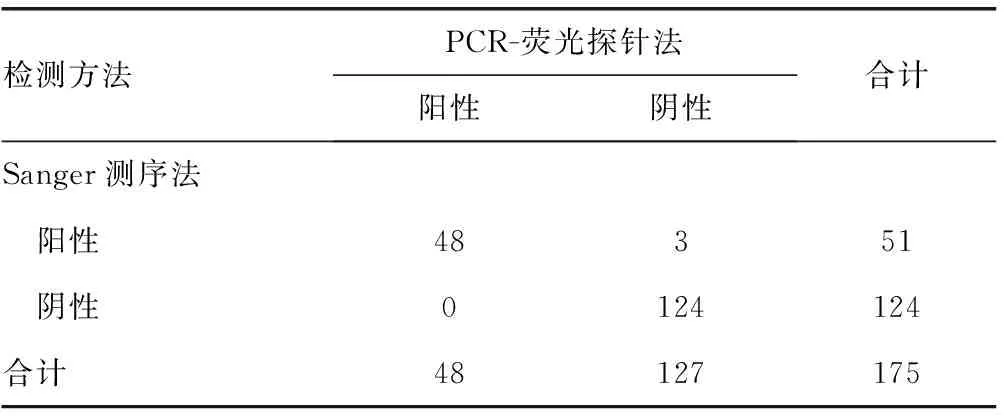
表2 PCR-荧光探针法与Sanger测序法的一致性评价(n)
2.2HRV载量对患儿临床指标的影响 以患儿HRV平均Ct值(31.03±4.87)为分界线,将Ct值<31的患儿作为高载量病毒组,31≤Ct值≤40的患儿作为低载量病毒组。两组住院天数、入院前最高体温、发热天数、白细胞计数、淋巴细胞百分比及降钙素原比较,差异无统计学意义(P>0.05),超敏C反应蛋白比较,差异有统计学意义(P<0.05)。见表3。
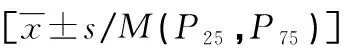
表3 41例普通病区住院患儿住院天数和相关感染指标的情况
3 讨 论
据研究报道,HRV通常感染人类的上呼吸道,还可向下蔓延导致下呼吸道感染,其甚至是诱发儿童哮喘性疾病的重要原因[2-4]。由于传统检测方法的限制,HRV在婴幼儿和儿童急性呼吸道感染中的作用可能被低估,因此早期、快速、准确地检出HRV对临床疾病的评估意义重大。本研究以HRV基因编码区的高度保守区为靶区域,设计特异性引物及荧光探针,进行一步法RT-qPCR扩增,用于标本中HRV RNA的定性检测。另外,扩增体系中带有内标物质,用于对核酸提取过程及PCR扩增过程的监控,可减少假阴性结果的出现。本研究结果显示,与Sanger测序法相比,PCR-荧光探针法检测HRV具有较高的灵敏度、特异度、阳性预测值和阴性预测值,两种方法的一致率为95.90%。两种方法HRV检出率比较,差异无统计学意义(P>0.05),与赖建辉等[7]、陈淑丹等[9]报道的PCR荧光探针法检测HRV的有效率基本一致,说明PCR-荧光探针法具有快速、灵敏度高、特异度高等优点,适用于HRV的快速检测。
Sanger测序法是传统的第一代DNA测序技术,被公认为基因测序的“金标准”,但其灵敏度低,实际检测中易出现假阴性结果[10-11]。在本研究PCR-荧光探针法检测结果中,有3份标本结果与Sanger测序法不一致,其Ct值位于37~40,提示当Ct值偏大时,PCR-荧光探针法对HRV的检测结果应判为可疑,需再次复查。但总体上两种方法的检出率比较,差异无统计学意义(P>0.05)。
各地区、各年龄段、各季节HRV的检出率均有差异。蔡晓莹等[12]报道汕头大学医学院第二附属医院住院的2 900多例呼吸道感染患儿中单一HRV检出率为5.85%,患儿各年龄段中以婴儿期组检出率最高。张明新等[13]报道首都医科大学附属北京同仁医院收治的479例呼吸道感染患者临床标本中检出率较高的为甲型流感病毒H1型(22.76%),HRV为4.80%,但HRV在不同年龄段检出率比较,差异无统计学意义(P>0.05),原因可能是没有纳入婴幼儿和儿童患儿的临床标本。余光清等[14]报道深圳地区急性上呼吸道感染患者中HRV的检出率为18.27%;HRV感染以幼儿检出率最高,其次为婴儿和学龄前儿童;此外,HRV主要在春季、夏季、秋季检出,冬季检出较少。王丰等[15]报道自贡市第四人民医院收治的急性呼吸道感染患者中HRV的检出率为8.31%;呼吸道合胞病毒(RSV)秋季、冬季检出率高,HRV春季、夏季检出率高。从以上报告中可以看出,HRV的检出率存在地区、年龄,甚至季节的差异,分析其原因可能与样本量的多少、样本收集的时间段,各年龄段纳入人群量有关,还可能与不同地区温度、湿度及气候等差异有关,多种因素均可能影响病毒的易感性。而本研究收集标本的时间段为肠道病毒高发季节[16],纳入人群、样本量有限且未考虑肠道病毒的混合感染,因此本研究仅探讨HRV的检出情况。HRV在本院的总体检出情况还需长时间、大样本量的补充;而HRV在本地区的感染情况,还需多个哨点医院的数据参与评估。
婴幼儿和儿童身体器官和免疫功能尚未发育成熟,当机体遭受病原体入侵时,其症状与成人患者大相径庭,因此本研究仅对婴幼儿和儿童感染HRV后的临床参数进行对比分析。在实验室指标方面,本院感染HRV的患儿白细胞计数、淋巴细胞百分比、超敏C反应蛋白及降钙素原等均超过正常范围,高载量病毒组与低载量病毒组超敏C反应蛋白水平比较,差异有统计学意义(P<0.05),与邓敏等[17]报告的情况有偏移,这可能与本研究患儿病情较重有关。
综上所述,Sanger测序法虽具有准确性高且特异度高的优点,但因其检测周期长、检测费用昂贵等问题,目前其仅能在设备齐全、资金雄厚的基因检测公司和国家级实验室使用,在普通医院的实验室很难被推广和应用于临床。而PCR-荧光探针法检测HRV具有灵敏度高、特异度高、检测周期短、费用较低、操作简便快捷等优点,可替代Sanger测序法在临床检测HRV感染,并能被广泛推广和应用。此外,高载量HRV的婴幼儿和儿童的超敏C反应蛋白水平较低载量HRV的婴幼儿和儿童更高。
