lncRNA HOTAIR通过miR-126/ADAMTS-4轴抑制口腔鳞状细胞癌细胞增殖与侵袭的机制研究*
2022-05-14邱乐宏
邱乐宏,邓 伟,王 涛
海南省人民医院/海南医学院附属海南医院口腔科,海南海口 570311
口腔鳞状细胞癌(OSCC)是常见的口腔癌,每年大约有50万人死于口腔癌。目前仍有超过60%的OSCC病例直到晚期才被确诊。研究表明,OSCC的病因与原癌基因的激活和过表达相关[1-2]。长链非编码RNA(lncRNA)是一种非蛋白编码RNA转录本,其失调被认为是恶性肿瘤的潜在诊断靶点[3]。CAO等[4]发现,上调lncRNA-RMRP可促进膀胱癌迁移。lncRNA CDKN2BAS通过miR-153-5p促进肝癌转移[5]。lncRNA HOTAIR(HOX反义基因间RNA)定位于第12条染色体,转录自HOXC位点的反义链。ZHAO等[6]发现,lncRNA HOTAIR异常表达与癌症进展密切相关,lncRNA HOTAIR通过miR-20a-5p/HMGA2轴影响乳腺癌细胞的生长、迁移、侵袭和凋亡。此外,lncRNA HOTAIR通过下调miRNA-34a促进结肠癌的发生[7]。但lncRNA HOTAIR调控口腔癌进展的具体机制尚不明确。本研究主要分析了lncRNA HOTAIR在OSCC中的表达和调控OSCC进展的作用机制。
1 材料与方法
1.1标本来源 2020年10月至2021年6月本院行手术切除的患者提供OSCC组织标本36份,经组织病理诊断为OSCC,20份相邻癌旁正常组织标本。所有病例术前均未进行放射治疗和化疗。本研究经本院医学伦理委员会批准,且所有患者知情同意,所取标本立即在冰箱中快速冷冻。
1.2方法
1.2.1细胞培养及其细胞转染 人OSCC细胞系(TSCCA、Tca8113)和人口腔角质形成细胞(HOK)从中国科学院(中国上海)获得。细胞株在添加10%胎牛血清(美国Life Technologies公司)、青霉素(100 U/mL)和链霉素(100 mg/mL)的DMEM/F12培养基中培养,在37 ℃和5% CO2的潮湿空气中生长。由GenePharma (中国上海)合成并获得干扰对照质粒(siRNA NC)、HOTAIR干扰质粒(HOTAIR siRNA)、ADAMTS-4干扰质粒(ADAMTS-4 siRNA)、过表达对照质粒[pcDNA-3.1(+)]和HOTAIR过表达质粒(pcDNA-HOTAIR)及模拟物对照(mimics NC)、miR-126模拟物(miR-126 mimics)、抑制剂对照(inhibitor NC)、miR-126抑制剂(miR-126 inhibitor)。用Lipofectamine 2000(美国Life Technologies公司)进行细胞转染。48 h后,收集细胞进行后续试验。
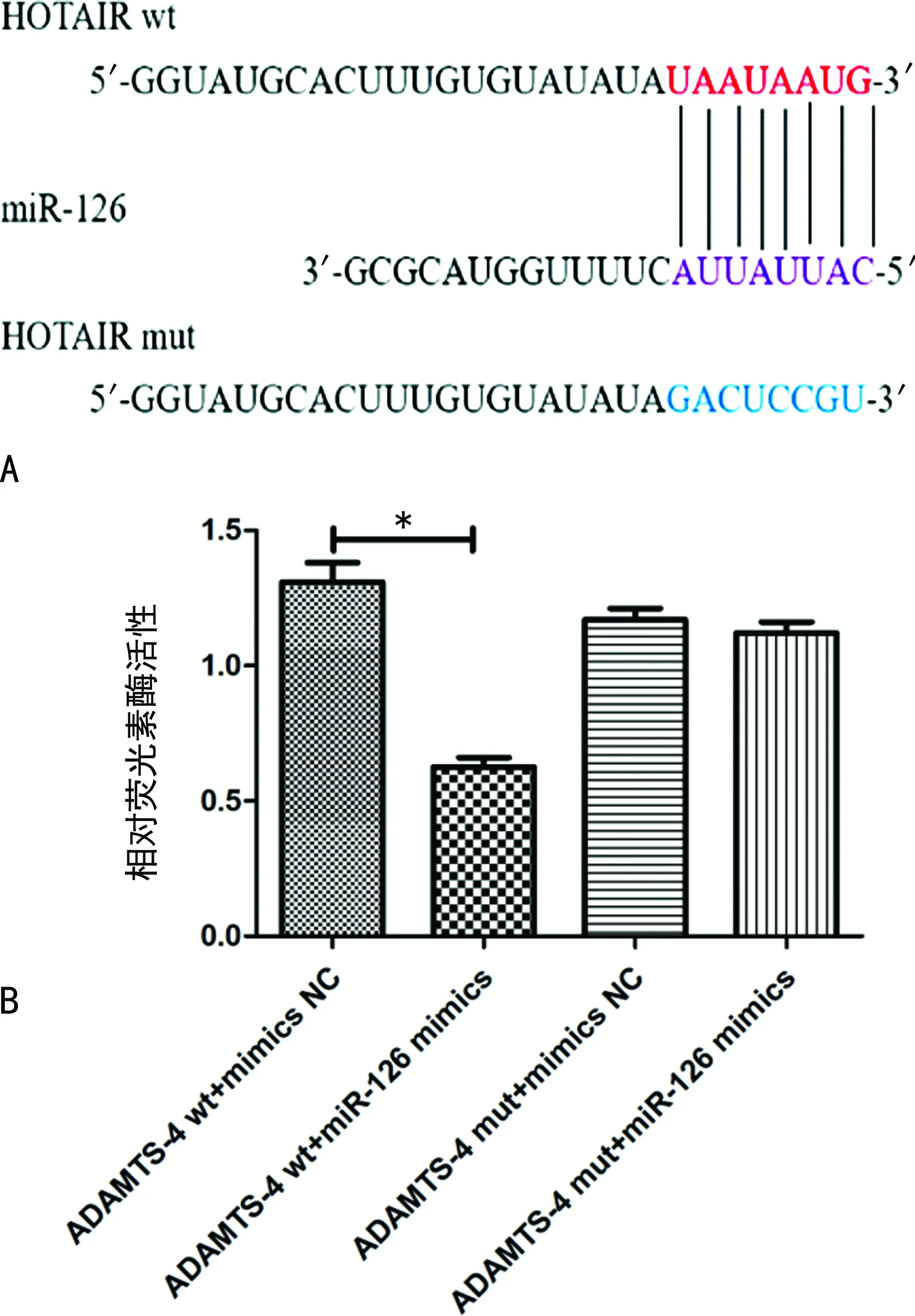
1.2.2双荧光素酶试验 利用靶基因预测软件(TargetScan和miRcode)预测靶基因。该位点的DNA片段在体外合成,序列插入到psi-CHECKTM-2载体下游,构建lncRNA HOTAIR野生型质粒(HOTAIR wt)和ADAMTS野生型质粒(ADAMTS-4 wt)。设计引物对与lncRNA HOTAIR、ADAMTS-4 3′UTR结合的种子序列区域进行突变,构建lncRNA HOTAIR突变型质粒(HOTAIR mut)和ADAMTS-4突变型质粒(ADAMTS-4 mut)。转染的细胞分为两大组,每组分为4小组,(1)A组:lncRNA HOTAIR wt+mimics NC;B组:lncRNA HOTAIR wt+miR-126 mimics;C组:lncRNA HOTAIR mut+mimics NC;D组:lncRNA HOTAIR mut+miR-126 mimics。(2)A组:ADAMTS-4 wt+mimics NC;B组:ADAMTS-4 wt+miR-126 mimics;C组:ADAMTS-4 mut+mimics NC;D组:ADAMTS-4 mut+miR-126 mimics。分别转染至细胞中,采用双荧光素酶检测试剂盒(E1910,Promega,Madison,WI)检测肾细胞荧光素酶活性,萤火虫荧光素酶活性作为内参。
1.2.3CCK-8法检测TCA8113细胞活力 为明确lncRNA HOTAIR、miR-126和ADAMTS-4对Tca8113细胞增殖活力的影响,转染的细胞分为以下3大组,(1)1组分为3小组:A为siRNA NC;B为HOTAIR siRNA;C为ADAMTS-4 siRNA;(2)2组分为两小组:A为inhibitor NC;B为miR-126 inhibitor;(3)3组分为4小组:A为pcDNA-3.1(+)+mimics NC;B为pcDNA-HOTAIR+mimics NC;C为pcDNA-3.1(+)+miR-126 mimics;D为pcDNA-HOTAIR+miR-126 mimics。转染成功后,将细胞(2×103)置于96孔板中培养48 h,每孔加入10 μL CCK-8溶液。细胞在37 ℃孵育2 h。用酶标仪在450 nm处检测吸光度,试验均为3个重复。
1.2.4Transwell试验检测细胞侵袭 取出基质在冰上融化,用不完全的DMEM培养基(1∶8)稀释。50 μL基质上室在细胞培养箱中培养4 h。各组细胞用无血清DMEM培养基洗涤2次。为明确lncRNA HOTAIR、miR-126和ADAMTS-4对Tca8113细胞侵袭的影响,将转染的细胞分为以下3大组,(1)1组分为3小组:A为siRNA NC;B为HOTAIR siRNA;C为ADAMTS-4 siRNA;(2)2组分为两小组:A为inhibitor NC;B为miR-126 inhibitor;(3)3组分为4小组:A为pcDNA-3.1(+)+mimics NC;B为pcDNA-HOTAIR+mimics NC;C为pcDNA-3.1(+)+miR-126 mimics;D为pcDNA-HOTAIR+miR-126 mimics,并进行相应质粒转染。48 h后将细胞密度调整至1×109/L;将100 μL的细胞接种到Transwell室中,将含10%胎牛血清的500 μL DMEM作为趋化因子加入24孔培养板的下室。8 h后取出腔体。用棉签拭除顶部残留的细胞,固定15 min,用0.1%结晶紫染色15 min,在光镜下计数。
1.2.5实时荧光定量PCR(RT-qPCR) 培养Tca8113细胞,将转染的细胞分为以下4组:A为pcDNA-3.1(+)+mimics NC;B为pcDNA-HOTAIR+mimics NC;C为pcDNA-3.1(+)+miR-126 mimics;D为pcDNA-HOTAIR+miR-126 mimics,进行相应质粒转染,转染成功后收取细胞RNA样。使用Trizol试剂(美国Life Technologies公司)从OSCC组织和细胞系中提取总RNA。RNA的浓度和质量由NanoDrop 2000(美国Quawell公司)测定。采用Super ScriptTMⅢ反转录酶试剂盒(美国Life Technologies公司)进行反转录。采用TaqMan Universal Master Mix Ⅱ进行RT-qPCR检测,循环次数记录为Ct。RT-qPCR:95 ℃处理15 s,60 ℃处理30 s,74 ℃处理30 min(40个循环),采用GAPDH作为内部控制。结果采用2-ΔΔCt方法进行分析。引物:lncRNA HOTAIR F(5′-3′):CAG TGG GGA ACT CTG ACT CG;R(5′-3′):GTG CCT GGT GCT CTC TTA CC。miR-126 F(5′-3′):GGC TCG TAC CGT GAG TAA T ;R(5′-3′):GTG CAG GGT CCG AGG T。ADAMTS-4 F(5′-3′):CCC AAG CAT CCG CAA TCC 3′;R(5′-3′):CAG GTC CTG ACG GGT AAA CA。GAPDH F(5′-3′):GAA GGT GAA GGT CGG AGT C;R(5′-3′):GAA GAT GGT GAT GGG ATT TC。
1.2.6流式细胞仪检测细胞凋亡 本研究使用凋亡检测试剂盒(中国南京凯基生物科技有限公司)。细胞培养与上述相同。为明确lncRNA HOTAIR、miR-126和ADAMTS-4对Tca8113细胞凋亡的影响,同1.2.3进行细胞转染。将细胞培养液吸收到适当的离心管中,用PBS冲洗贴壁细胞一次。细胞经适量胰酶(含EDTA)消化后移至离心管。用200 μL Annexin V-FITC结合缓冲液重悬细胞,加入5 μL Annexin V-FITC,室温黑暗孵育10 min。100 μL Annexin V-FITC结合缓冲液再固定细胞,加入10 μL PI,轻轻混匀,置于4 ℃黑暗中。流式细胞术检测30~60 min。Annexin V-FITC为绿色荧光,PI为红色荧光。
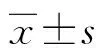
2 结 果
2.1lncRNA HOTAIR、miR-126和ADAMTS-4在OSCC中的差异表达与癌旁组织比较,OSCC组织中lncRNA HOTAIR、ADAMTS-4基因表达明显上调(P<0.05),miR-126表达明显降低(P<0.05);与HOK细胞比较,TSCCA、Tca8113细胞中lncRNA HOTAIR、ADAMTS-4基因表达明显上调(P<0.05),miR-126表达明显降低(P<0.05)。见图1。

注:A为lncRNA HOTAIR、miR-126和ADAMTS-4在OSCC组织和癌旁组织的基因表达;B为lncRNA HOTAIR、miR-126和ADAMTS-4在HOK、TSCCA、Tca8113细胞中的基因表达;*P<0.05。图1 lncRNA HOTAIR、miR-126和ADAMTS-4在OSCC中的差异表达
2.2HOTAIR siRNA对Tca8113细胞增殖、凋亡和侵袭的影响 lncRNA HOTAIR siRNA组Tca8113细胞内lncRNA HOTAIR基因表达明显低于siRNA NC组(P<0.01)。与siRNA NC组比较,HOTAIR siRNA组Tca8113细胞活力下调(P<0.01),细胞凋亡率上升(P<0.01),细胞侵袭数目减少(P<0.05)。见图2、表1。
注:A为RT-qPCR检测lncRNA HOTAIR的基因表达;B为CCK-8法检测细胞活力;C、D为流式细胞仪检测两组细胞凋亡率;E、F为Transwell试验检测两组细胞侵袭数目;*P<0.05。图2 HOTAIR siRNA对Tca8113细胞增殖、凋亡和侵袭的影响

表1 HOTAIR siRNA对Tca8113细胞增殖、凋亡和侵袭的影响
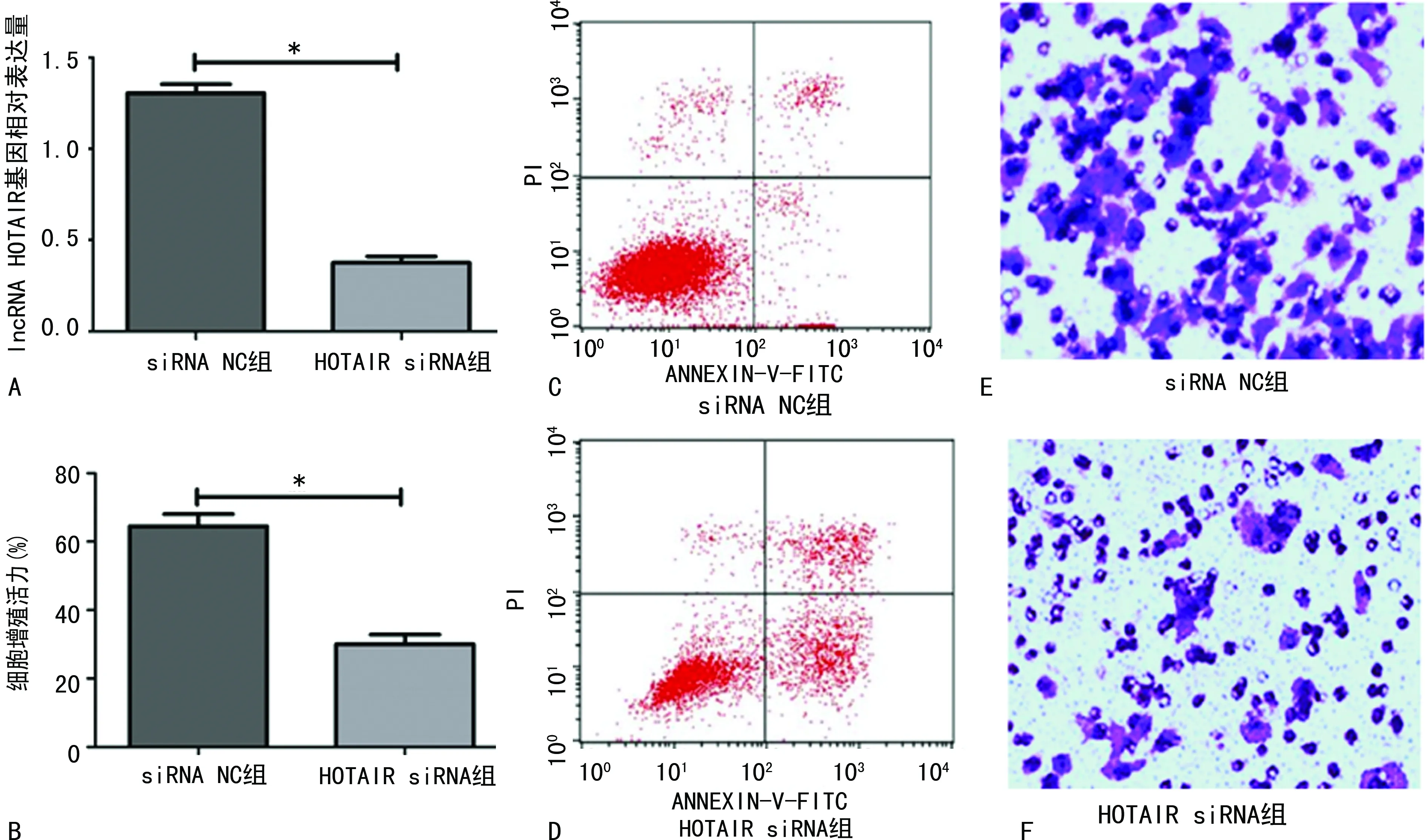
2.3lncRNA HOTAIR与miR-126的关系分析 结果显示,lncRNA HOTAIR 3′UTR和miR-126之间具有结合位点,见图3A。与HOTAIR wt+mimics NC组比较,HOTAIR wt+miR-126 mimics组细胞荧光素酶活性下调(P<0.01);与HOTAIR mut+mimics NC组比较,HOTAIR mut+miR-126 mimics组细胞荧光素酶活性差异无统计学意义(P>0.05),见图3B。
注:A为预测lncRNA HOTAIR与miR-126的结合位点;B为检测荧光素酶活性;*P<0.05。图3 lncRNA HOTAIR与miR-126的关系分析
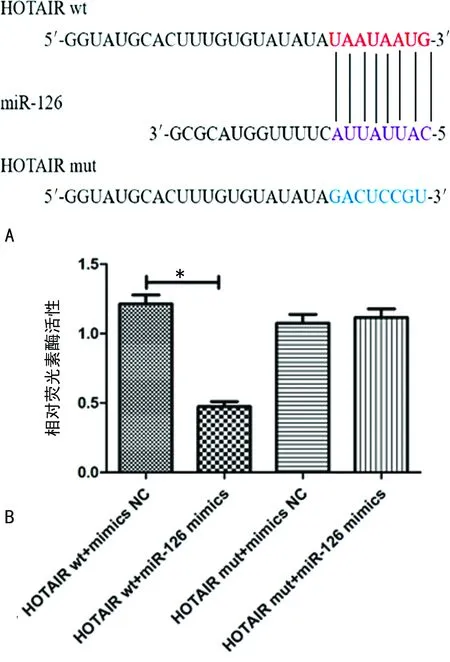
2.4miR-126 inhibitor对Tca8113细胞增殖、凋亡和侵袭的影响 miR-126 inhibitor组Tca8113细胞内miR-126表达低于inhibitor NC组(P<0.01)。与inhibitor NC组比较,miR-126 inhibitor组Tca8113细胞活力上调(P<0.01),细胞凋亡率降低(P<0.01),细胞侵袭数目增加(P<0.01),见图4、表2。
注:A为RT-qPCR检测 miR-126的基因表达;B为CCK-8法检测细胞活力;C、D为流式细胞仪检测两组细胞凋亡率;E、F为Transwell试验检测两组细胞侵袭数目;*P<0.05。图4 miR-126 inhibitor对Tca8113细胞增殖、凋亡和侵袭的影响

表2 miR-126 inhibitor对Tca8113细胞增殖、凋亡和侵袭的影响
2.5lncRNA HOTAIR靶向miR-126对Tca8113细胞的增殖、凋亡和侵袭的影响 与pcDNA-3.1(+)+mimics NC组比较,pcDNA-HOTAIR+mimics NC组细胞增殖活力上升(P<0.05),细胞凋亡率降低(P<0.01),细胞侵袭数目增加(P<0.01);与pcDNA-3.1(+)+mimics NC组比较pcDNA-3.1(+)+miR-126 mimics组细胞增殖活力下调(P<0.05),细胞凋亡率上升(P<0.01),细胞侵袭数目减少(P<0.01);与pcDNA-3.1(+)+miR-126 mimics组比较,pcDNA-HOTAIR+miR-126 mimics组细胞增殖活力上升(P<0.05),细胞凋亡率降低(P<0.01),细胞侵袭数目增加(P<0.01),见图5、表3。

注:A为CCK-8法检测细胞活力;B~E为流式细胞仪检测4组细胞凋亡率;F~I为Transwell试验检测4组细胞侵袭数目;*P<0.05。图5 lncRNA HOTAIR靶向iR-126对Tca8113细胞的增殖、凋亡和侵袭的影响

表3 lncRNA HOTAIR靶向miR-126对Tca8113细胞的增殖、凋亡和侵袭的影响
2.6miR-126与ADAMTS-4的关系分析 结果显示,ADAMTS-4 3′UTR和miR-126之间具有结合位点,见图6A。与ADAMTS-4 wt+mimics NC组比较,ADAMTS-4 wt+miR-126 mimics组细胞荧光素酶活性下调(P<0.01);与ADAMTS-4 mut+mimics NC组比较,ADAMTS-4 mut+miR-126 mimics组细胞荧光素酶活性差异无统计学意义(P>0.05),见图6B。
注:A为预测miR-126与ADAMTS-4的结合位点;B为检测荧光素酶活性;*P<0.05。
图6 miR-126与ADAMTS-4的关系分析
2.7lncRNA HOTAIR靶向miR-126对ADAMTS-4表达的影响 与pcDNA-3.1(+)+mimics NC组比较,pcDNA-HOTAIR+mimics NC组细胞内ADAMTS-4表达明显上调(P<0.01),pcDNA-3.1(+)+miR-126 mimics组细胞内ADAMTS-4表达明显下调(P<0.01);与pcDNA-3.1(+)+miR-126 mimics组比较,pcDNA-HOTAIR+miR-126 mimics组细胞内ADAMTS-4表达明显上调(P<0.01),见图7。

注:*P<0.05。图7 lncRNA HOTAIR靶向miR-126对ADAMTS-4表达的影响
2.8ADAMTS-4 siRNA对Tca8113细胞增殖、凋亡和侵袭的影响 ADAMTS-4 siRNA组Tca8113细胞内ADAMTS-4基因表达明显低于siRNA NC组(P<0.01)。与siRNA NC组比较,ADAMTS-4 siRNA组Tca8113细胞活力下调(P<0.05),细胞凋亡率上升(P<0.01),细胞侵袭数目减少(P<0.05)。见图8、表4。
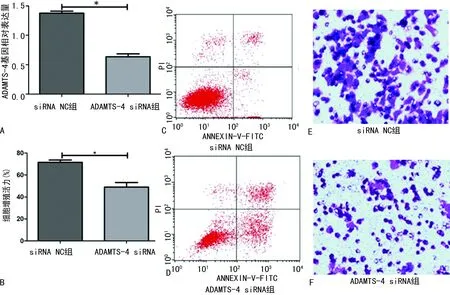
注:A为RT-qPCR检测ADAMTS-4的基因表达;B为CCK-8法检测细胞活力;C、D为流式细胞仪检测两组细胞凋亡率;E、F为Transwell试验检测两组细胞侵袭数目;*P<0.05。图8 ADAMTS-4 siRNA对Tca8113细胞增殖、凋亡和侵袭的影响

表4 ADAMTS-4 siRNA对Tca8113细胞增殖、凋亡和侵袭的影响
3 讨 论
发现新的、有效的用于OSCC诊断和预后的生物标志物将有助于改善患者的临床预后。有研究结果表明,lncRNA在肿瘤发生中发挥着关键作用,其被认为是OSCC等肿瘤诊断和判断预后的标志物[7]。本研究结果显示,lncRNA HOTAIR和ADAMTS-4在OSCC组织和细胞中明显上调,miR-126明显下调。lncRNA HOTAIR和ADAMTS-4沉默可抑制Tca8113细胞的增殖和侵袭,促进细胞凋亡。笔者还发现,lncRNA HOTAIR在OSCC组织中发挥致癌作用,并通过miR-126调节其靶蛋白ADAMTS-4的表达。
有研究结果表明,lncRNA的异常表达和功能障碍与OSCC等疾病的发生、发展密切相关[8]。JIANG等[9]发现,lncRNA HOTAIR下调可通过microRNA-130a降低胰岛素样生长因子1的表达,从而缓解大鼠多囊卵巢综合征。MA等[10]研究表明,lncRNA HOTAIR通过上调FASN参与鼻咽癌的发生。JIANG等[11]研究发现,lncRNA HOTAIR可通过调控STAT3/Cyclin D1轴抑制胃癌生长。另外还有研究发现,lncRNA UCA1通过抑制miR-184的表达促进OSCC细胞的增殖和顺铂耐药[12]。过表达lncRNA JPX通过miR-944/CDH2轴促进OSCC恶性发展[13]。本研究结果显示,lncRNA HOTAIR在OSCC组织中表达上调,敲减HOTAIR表达后,Tca8113细胞的增殖和侵袭能力明显受到抑制,细胞凋亡率明显升高,但lncRNA HOTAIR在Tca8113细胞中的作用及其分子机制尚需进一步研究。
HU等[14]研究表明,lncRNA TMPO-AS1通过海绵miR-126-5p加速胃癌进展和血管生成。WANG等[15]发现,lncRNA HOTAIR通过海绵miR-216和靶向ZEB1促进骨肉瘤的发展。LI等[16]研究结果表明,miR-126通过抑制癌细胞凋亡和自噬促进食管鳞癌的发生,提示miR-126在癌细胞增殖、迁移和侵袭发展过程中发挥了关键作用。本研究结果表明,miR-126与lncRNA HOTAIR具有结合位点,在OSCC细胞系中,lncRNA HOTAIR能够直接靶向结合miR-126。为了进一步探讨miR-126对OSCC组织Tca8113细胞发展的影响,笔者将miR-126 inhibitor转染Tca8113细胞并检测了细胞增殖、凋亡和侵袭情况,结果显示,下调miR-126表达明显促进了Tca8113细胞增殖与侵袭,抑制癌细胞凋亡,提示miR-126在OSCC细胞发展过程中具有明显的抑癌作用。本研究结果还表明,上调lncRNA HOTAIR表达能够通过海绵miR-126促进Tca8113细胞增殖和侵袭,抑制细胞凋亡,更进一步阐明了lncRNA HOTAIR的作用机制。然而,miR-126调控的靶基因尚不清楚。此外,本研究结果显示,miR-126与ADAMTS-4具有结合位点。敲减ADAMTS-4表达后,Tca8113细胞增殖和侵袭能力下降,细胞凋亡率上升。有研究表明,ADAMTS-4在人类肿瘤组织中普遍表达上调,在肿瘤发生过程中发挥致癌作用[17]。闫栋等[17]发现,浸润性乳腺癌组织中ADAMTS-4表达上调且癌细胞活性明显增强。本研究结果提示,ADAMTS-4可能通过lncRNA HOTAIR/miR-126整合通路调控,其异常表达参与了OSCC的恶性发展进程,这可能为OSCC的治疗提供新的思路。
综上所述,本研究结果表明,lncRNA HOTAIR在OSCC组织中表达上调,lncRNA HOTAIR基因敲除可抑制OSCC细胞的生长和转移,并通过miR-126/ADAMTS-4轴在OSCC细胞中发挥促癌作用,这些数据为OSCC发病机制的复杂调控网络提供了新的见解。虽然HOTAIR已被确定为癌基因,但lncRNA HOTAIR在OSCC组织中发挥致癌作用的可能机制仍有待进一步探索。
