几种外来动物病毒多重普通和实时荧光定量RT-PCR检测方法的建立及其初步应用
2022-05-14赵文华李富祥杨仕标
赵文华 , 李富祥 , 杨仕标
(云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室 , 云南 昆明 650224)
小反刍兽疫(Peste des petits ruminants,PPR)是以发热、腹泻、肺炎和口炎等为典型临床症状的羊类等小反刍动物的一种亚急性或急性烈性传染病[1-2],该病是因羊等易感动物感染小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)而引发。该病于2007年7月在我国西藏的阿里地区首次被发现并报道[3]; 2007年的PPR疫情基本局限于西藏地区,但该病在2013年底卷土重来,至2014年几乎蔓延遍布整个中国,时至今日仍不断有零星散发[4]。蓝舌病(Bluetongue,BT)则是由蓝舌病病毒(Bluetongue virus,BTV)感染而引起的易感动物山羊、绵羊、黄牛、水牛和鹿等家养和野生反刍动物类的一种非接触性虫媒传播疾病[1-2,5],该病的主要临床特征是鼻腔、口腔和胃肠道等部位发生溃疡性炎症变化。目前已发现27个BTV血清型。蓝舌病病毒血清8型(BTV8)于2006年在荷兰临床感染牛中首次被发现[5],研究显示BTV8发生遗传变异可使其毒力增强,对牛有强致病性。鹿流行性出血热病毒(Epizootic hemorrhagic disease virus,EHDV)是导致以鹿为主要易感动物的鹿流行性出血热病(Epizootic hemorrhagic disease of deer,EHD)的致病病原体。该病亦是严重影响野生和家养反刍动物健康的一类非接触性虫媒传染病,主要是经由昆虫库蠓属而传播,急性型感染动物死亡率极高[1-2,6]。非洲马瘟(African horse sickness,AHS)临床特征是以发热、血液循环系统和呼吸系统的病变为主,该病是一种急性或亚急性高致死性的马属动物的虫媒(库蠓)传染病,非洲马瘟病毒(African horse sickness virus,AHSV)是该病的致病病原体。AHSV 易感动物包括马、骡、斑马和犬等,其中马感染后的致死率甚至可超过 90%,对养马业具有严重威胁。AHS 主要在南欧和非洲的一些国家流行和暴发[1-2,7],目前在我国尚无感染AHSV病例的相关报道。上述4种外来动物疫病均具有病死率高和传播速度快的特点,为了能够对上述外来动物疫病的入侵进行有效防范,特别需要对该4种外来动物疫病病原体实施快速特异的检测确诊。本试验通过设计引物、探针和优化组合,初步建立了PPRV/BTV8/EHDV1三重实时荧光定量逆转录PCR(Reverse transcription-polymerase chain reaction,RT-PCR)检测方法及PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR检测方法,以期可以实现快速同步高通量检测,并可对该3种或4种病毒进行鉴别诊断,从而应用于实际生产。
1 材料与方法
1.1 试验材料 BTV8及EHDV1灭活细胞毒由昆明海关技术中心提供。PPRV-M、PPRV-NP和AHSV-VP7阳性pMDTM18-T质粒样品为本实验室制备;PPRV疫苗株,羊痘、羊口疮、阿卡斑、口蹄疫等阳性病料和临床待检测样本925份(样本背景资料详见参考文献[8]),均为本实验室收集。
1.2 主要试剂 0.85%灭菌生理盐水为实验室自配;病毒核酸抽提试剂盒、质粒抽提试剂盒、DNA胶回收试剂盒、普通PCR扩增试剂盒、RT-PCR扩增试剂盒、实时荧光定量RT-PCR试剂盒、pMDTM18-T Vector Cloning Kit试剂盒和DL 2 000分子标记等其他相关试剂,均购自宝生物工程(大连)有限公司。
1.3 方法
1.3.1 引物和探针的设计及合成 根据参考文献[9-11]和GenBank下载的相关病毒基因序列,设计相关检测用引物和探针(表1、2),按照溶解说明书,制备成100 pmol/μL的贮存浓度冻存至-80 ℃冰箱备用,待试验操作时再稀释成各自所需要的工作浓度进行使用。

表1 PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR扩增引物
1.3.2 样本基因组核酸提取 无菌生理盐水浸泡过夜的拭子样本、研磨好的血凝块、血清样本或灭活细胞毒样本,分别各取200 μL待用。按照核酸提取试剂盒说明书提取核酸样本。最后将制备好的DNA/RNA样本贮存于-80 ℃冰箱备用。
1.3.3 反应体系和反应程序 BTV8或EHDV1普通RT-PCR反应和PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR反应,均按试剂盒说明书加入各反应组分并充分混匀,反应程序:42 ℃ 38 min,95 ℃ 4 min,35×(94 ℃ 30 s,55 ℃ 35 s,72 ℃,1 min),72 ℃ 8 min。反应结束后经琼脂糖凝胶电泳进行检测,并放置于紫外灯下进行拍照记录,切割阳性片段并进行胶回收纯化。按照试剂盒说明书进行PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR反应液的配制,反应程序:42 ℃ 5 min,95 ℃ 30 s,42×(95 ℃ 5 s,60 ℃ 35 s)。在每个60 ℃荧光扩增循环反应时进行不同波段荧光信号的收集和检测。
1.3.4 BTV8和EHDV1普通RT-PCR片段的扩增纯化、克隆和核苷酸序列测定 详细试验步骤参见参考文献 [11],获得最终核苷酸序列后进行BLAST比对分析。
2 结果
2.1 EHDV1和BTV8普通RT-PCR扩增和质粒构建 以自灭活BTV8和EHDV1细胞毒抽提的 RNA为模板进行PCR扩增,皆扩增出预期条带;随后经胶回收纯化、载体连接、感受态细胞转化,最终成功构建BTV8和EHDV1的阳性载体质粒用于构建后续的检测方法。
2.2 PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR检测方法的构建 经过反复筛选扩增组合,最后优化出了PPRV-NPF/R、BTV8-NS2F1/R1、EHDV-VP31F/1R和AHSV-VP7F1/R1引物对的最佳组合,可实现对PPRV、BTV8、EHDV1和AHSV四种病毒的特异性同步四重RT-PCR检测。当在反应体系中同时加入4种引物对,若4种病毒质粒DNA同时存在,可扩增出4条预期条带,即415 bp的AHSV条带、509 bp的EHDV条带、625 bp的BTV8条带和703 bp的PPRV条带;而当分别加入三三或者两两组合的病毒质粒DNA时,会分别扩增出对应的3种或者2种特异片段;若仅有1种病毒质粒DNA模板存在时,则仅可扩增出1条特异的预期条带(图1)。

图1 PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR扩增条带电泳图
此四重普通RT-PCR检测方法对羊口疮、羊痘、阿卡斑、口蹄疫等病毒核酸均无条带扩增,检测敏感度可达103copies/μL DNA(图2、3)。

图2 PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR敏感性试验
2.3 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR检测方法的构建 以组建好的PPRV-M、BTV8-NS、EHDV1-VP3不同梯度浓度的质粒DNA为标准品,用表2所列引物和探针按照最优反应条件进行系列梯度浓度扩增,根据各自的扩增曲线综合构建出三重实时荧光定量RT-PCR扩增标准曲线,结果如图4所示,在102~107copies/μL DNA标准品质粒的浓度范围,质粒浓度的对数与循环数Ct值之间存在着良好的线性关系:其中BTV8-NS-FAM探针标准曲线的方程表达式为Y=-3.335 896X+45.640 709(R2=0.998 484,扩增效率为99.42%);PPRV-M-Cy5探针标准曲线的方程表达式为Y=-3.630 651X+46.277 901(R2=0.990 383,扩增效率为88.55%);EHDV1-VP3-VIC探针标准曲线的方程表达式为Y=-3.270 725X+46.813 782(R2=0.999 496,扩增效率为102.18%)。上述表达方程式中X表示拷贝数的对数(Log copy number),Y为循环数(Ct值),R2是相关系数。

表2 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR引物和探针

图3 PPRV/BTV8/EHDV1/AHSV四重普通RT-PCR特异性试验
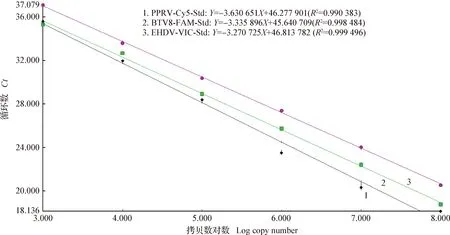
图4 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR方法标准曲线
标准品质粒DNA在不同的梯度浓度出现规律的荧光扩增曲线(图5~7),若以Ct值40作为阳性样品的临界阈值,则PPRV-M-Cy5探针的检测敏感性理论上可低至101.73copies/μL DNA,BTV-NS-FAM探针的理论检测敏感度可低达101.70copies/μL DNA,而EHDV1-VP3-VIC探针的理论检测敏感度为102.08copies/μL DNA;较常规普通RT-PCR检测方法敏感性平均高出10倍以上。分别选取104、105、106、107copies/μL DNA的相应质粒标准品作为模板,每个梯度样本连续反复扩增检测3次,各自的扩增结果显示所选择梯度的PPRV、BTV8和EHDV1的质粒DNA样本各自的扩增重复性均良好。统计学方法分析结果显示其变异系数CV均小于2.5%,说明所构建的三重实时荧光定量检测方法具有良好的稳定性和重复性(表3)。

图5 PPRV-M质粒DNA标准品动力学扩增曲线

图6 EHDV1质粒DNA标准品动力学扩增曲线

图7 BTV8质粒DNA标准品动力学扩增曲线

表3 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR质粒DNA标准品重复性试验
2.4 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR检测方法特异性测定和临床初步应用 抽提羊痘等已知阳性病料和925份临床样本基因组核酸,用上述已经建立的三重实时荧光定量RT-PCR检测方法进行方法特异性的测定。试验结果显示:除阳性质粒和PPRV、EHDV1及BTV8阳性RNA外,其他病毒均未检测出荧光信号 (图8)。用上述所建立的三重实时荧光定量RT-PCR检测方法,对从925份临床样本中抽提出的核酸物质进行检测,结果显示在上述自临床样本抽提的核酸物质中均未检测到EHDV1和BTV8阳性样本,仅检测出1例PPRV核酸阳性样本。该阳性样本经常规RT-PCR扩增测序比对后为PPRV谱系IV型序列。

图8 PPRV/BTV8/EHDV1三重实时荧光定量RT-PCR特异性检测荧光扩增曲线
3 讨论
PPRV是单股负链RNA病毒,隶属于副黏病毒科麻疹病毒属,该属成员均具有约16 kb的基因组全长,自3′端到5′端基因组上依次排列着N-P/C/V-M-F-H-L六个基因,分别对应着编码6种结构蛋白和2种非结构蛋白[12]。EHDV、BTV和AHSV这3种病毒则皆均为环状病毒属的成员,隶属于呼肠孤病毒科大家庭,它们的基因组是分节段的,均由10个线性双链RNA片段组成;构成病毒粒子的5个非结构蛋白和7个结构蛋白分别由不同节段的双链RNA基因组编码[13]。本试验中分别选择PPRV、BTV8、EHDV1和AHSV这4种病毒基因组中高度保守位置序列作为核酸检测的靶点,它们分别是PPRVN-P基因、BTV8NS2基因、EHDVVP3基因和AHSVVP7基因,设计不同引物对经反复筛选组合,最终构建了PPRV/BTV8/EHDV1/AHSV的特异性四重普通常规RT-PCR检测技术体系,可实现对4种病毒的同步特异性检测,方便在仅具有常规普通PCR仪的广大基层实验室推广和应用。另外,本试验又分别选择各自保守的PPRVM基因、BTV8NS2基因和EHDV1VP3基因设计各自相应的引物和探针,采用5′Cy5(荧光集团)-BHQ2(淬灭集团)3′、5′FAM(荧光集团)-TAMRA(淬灭集团)3′和5′VIC(荧光集团)-BHQ1(淬灭集团)3′分别进行不同病毒特异检测探针的标记,继而实现对PPRV、BTV8和EHDV1的同步三重快速特异实时荧光定量检测。
无论是多重普通PCR还是多重荧光实时定量PCR反应体系跟单一反应体系相比均会有些许相互间的竞争影响,其扩增效率较单独扩增时会稍微的降低,多重扩增时一般原则是优先扩增短片段序列;但多重反应体系的建立会使诊断、检测试剂的成本大大降低,尤其是当需要进行大规模临床检测时。本试验所建立的检测方法已经在临床样本检测中进行了初步应用,但仍需在更大量样本中进行进一步的临床验证以及提升优化。
