丹参酮ⅡA调控Sirt1通路影响巨噬细胞极化的机制研究
2022-05-14宋璐霞樊懿萱刘启予
宋璐霞,张 杰,马 丹,樊懿萱,刘启予,赵 麟,徐 浩,3
动脉粥样硬化(atherosclerosis,AS)是发生于动脉血管壁(主要累及大中肌性动脉)的慢性疾病,是冠心病、高血压等多种心脑血管疾病的危险因素。巨噬细胞作为动脉粥样硬化斑块中的主要炎性细胞,在促进早期斑块形成、稀释纤维帽和核心坏死成分、增强免疫应答反应等方面具有重要作用[1]。巨噬细胞在不同因素刺激下发生表型的分化即巨噬细胞极化,可分为M1、M2 型巨噬细胞。M1 型巨噬细胞能够分泌促炎因子肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β、趋化因子配体-5(CCL-5)、诱导型一氧化氮合酶(iNOS)等[2]参与炎症反应过程;而M2型巨噬细胞则主要参与组织重塑及炎症消退过程[3]。
丹参为唇形科植物丹参的干燥根和根茎,具有活血化瘀、通经止痛、清心除烦、凉血消痈的功效。丹参酮ⅡA为丹参的脂溶性有效活性成分,已有大量临床及基础研究显示其具有抗炎、抗氧化应激等作用,在保护血管内皮细胞功能、抗动脉粥样硬化中发挥重要作用[4-6]。然而,丹参酮ⅡA从影响巨噬细胞极化角度探索抗炎作用的实验证据尚待完善。故本实验以脂多糖(LPS)刺激的RAW264.7巨噬细胞为体外炎症细胞模型为研究对象,从巨噬细胞极化角度出发探讨丹参酮ⅡA抗炎的作用机制。
1 材料与方法
1.1 细胞及药品 小鼠单核巨噬细胞RAW264.7购自武汉普诺赛生命科技有限公司;丹参酮ⅡA购自美国APExBIO公司,N184611337769;LPS购自Solarbio公司,L8880。
1.2 试剂与仪器 DMEM培养基(Gibico公司,C11885500BT);CCK-8 试剂盒(赛百科公司,F25);LipofectamineTM3000 Transfection Reagent、TurboFectTMTransfection Reagent、SuperScriptⅢ逆转录试剂盒、Sybr qpcr mix均购自THERMO公司;T4 DNA Ligase(Transgen公司,FL101-01);封闭专用脱脂奶粉(北京普利莱公司,P622,2021MOAP1622);10x电转液(北京Solarbio公司,D1060,批号20210220);5xTris-甘氨酸电泳缓冲液(北京Solarbio公司,D1060);二哇啉甲酸(BCA)蛋白质定量试剂盒(北京普利莱公司,P1511);4×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶缓冲液(北京Solarbio公司,S1051,批号20201217);一抗:Sirt1、F4/80、β-actin(Abcam公司,ab189494、ab6640、ab8227)、CD206/MMR(RD公司,AF2535),过氧化物酶增生激活受体-γ(PPAR-γ)、iNOS、核转录因子(NF)-kBp65、Arg1抗体(CST公司);二抗:山羊抗兔IgG HRP、山羊抗兔IgG H&L(Alexa Fluor®647)Abcam公司;驴抗兔 IgG(minimal x-reactivity)、FITC标记抗鼠二抗均购自Biolegend公司;Sirt1干扰RNA由湖州河马生物设计合成;各指标引物由北京梓熙生物科技有限公司合成。YCP系列气套二氧化碳(CO2)培养箱(中国华曦公司);BeamCyte-1026流式细胞仪(中国必达科公司);3-30K低温离心机(德国 Sigma公司);Nanodrop lite分光光度计(购自美国THERMO公司);荧光定量聚合酶链式反应(RT-qPCR)仪(美国Applied Biosystems公司);SDS-PAGE电泳系统(美国Bio-rad公司);ChemiDoc MP化学发光成像系统(美国Bio-rad公司);凝胶成像系统(美国Bio-rad公司)。
1.3 实验方法
1.3.1 细胞培养 RAW264.7巨噬细胞使用10% FBS-DMEM培养基(含100 kU/L 青霉素、100 mg/L 链霉素),置于37 ℃、5%CO2的培养箱中培养,每日观察细胞形态,RAW264.7最佳形态为小的圆形透亮细胞[7],待细胞生长密度为80%~90%后使用 0.25%的胰蛋白酶消化2 min进行传代培养。
1.3.2 Sirt1干扰技术 采用qPCR法筛选最佳Sirt1敲降效果的siRNA(引物序列见表1),构建干扰载体,将慢病毒包装质粒混合物及表达质粒使用无菌超纯水分别稀释为终浓度为1.0 μg/μL 的质粒溶液。在无菌1.5 mL EP管中加入400 μL无血清培养基,加入1.5 μg核心质粒和1.5 μg病毒包装质粒,及6 μL turbofect充分混匀,静置15~20 min,将混合液逐滴加入HEK-293T细胞中,48 h后吸取上清,补入培养基,继续培养。24 h后收集上清,将两次收集的上清液混合,得到病毒液。0.45 μm滤膜过滤病毒液,-80 ℃保存用于后续感染诱导的巨噬细胞模型。

表1 mSirt1 siRNA合成序列
1.3.3 丹参酮ⅡA给药浓度筛选 于96孔板中以1×105
每孔接种RAW264.7细胞,分为对照组及丹参酮ⅡA各剂量组(浓度分别为5 μg/mL、10 μg/mL和20 μg/mL),细胞培养24 h后,应用CCK-8法检测细胞存活率,细胞存活率=[(实验组OD-空白组OD)/(对照组OD-空白组OD)]×100%,选定细胞给药浓度。
1.3.4 炎症模型构建与分组 使用100 ng/mL LPS刺激RAW264.7细胞24 h构建巨噬细胞炎症模型。分为空白组、模型组、Sirt1敲降组(模型+Sirt1 RNA干扰)、丹参酮ⅡA组(模型+丹参酮ⅡA)及Sirt1敲降+丹参酮组(模型+Sirt1 RNA干扰+丹参酮ⅡA)。
1.3.5 流式细胞术检测 各组细胞药物干预24 h后,0.25%胰蛋白酶消化收集细胞,重悬细胞并进行细胞计数。调整细胞浓度为1×107/mL,取100 μL 细胞悬液,加入对应的一抗 4 ℃孵育30 min,二抗 4 ℃、避光孵育30 min,经1%多聚甲醛 4 ℃固定30 min后上机检测。M1型巨噬细胞以F4/80+/iNOS标记,M2型巨噬细胞以F4/80+/CD206+标记。
1.3.6 蛋白免疫印迹法(Western Blot)检测相关指标 收集各组细胞,使用5倍细胞体积RIPA裂解液提取巨噬细胞总蛋白,BCA蛋白法测定蛋白浓度,以每孔20 μg蛋白质上样进行SDS-PAGE电泳,电泳结束后将蛋白条带转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉室温封闭2 h后,加入Sirt1、PPAR-γ、NF-κB、iNOS、Arg1等一抗,4 ℃孵育过夜,第2日应用TBST洗膜3次,加入相应二抗,室温摇床孵育1 h,电化学发生(ECL)法显影成像,Image J软件对各组条带灰度值进行分析。
1.3.7 RT-qPCR检测mRNA表达情况 收集并提取各组细胞mRNA,使用逆转录试剂盒逆转录合成cDNA,各组细胞 Sirt1、PPAR-γ、NF-κB、iNOS、Arg1的 mRNA 表达水平(引物序列见表2)。反应条件:95 ℃预处理5 min,循环 1 次;95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸20 s,循环40次,每组设3个复孔。相对表达量计算公式:RQ=2-(△Ctq-ΔCtcb),△Ctq=待测组目的基因平均Ct值-待测组内参基因平均Ct值,△Ctcb=对照组目的基因平均Ct值-对照组内参基因平均Ct值。

表2 各指标引物序列
2 结 果
2.1 qPCR筛选siRNA 提取各组Sirt1表达干扰细胞的mRNA行qPCR检测。与对照组比较,si-RNA-NC组、Si-RNA-1组、Si-RNA2组对Sirt1基因表达的干扰差异无统计学意义(P>0.05),si-RNA-3组对Sirt1基因表达的干扰差异有统计学意义(P<0.05)。详见表3。
表3 siRNA转染RAW264.7细胞对Sirt1表达的影响(±s)
2.2 CCK-8法检测各浓度丹参酮ⅡA细胞存活率 与对照组比较,丹参酮ⅡA 5 μg/mL组、丹参酮ⅡA 10 μg/mL组、丹参酮ⅡA 20 μg/mL组RAW264.7巨噬细胞存活率差异均无统计学意义(P>0.05),说明丹参酮ⅡA对RAW264.7细胞无明显细胞毒作用。详见表4。本实验选择丹参酮ⅡA 20 μg/mL浓度进行后续药物干预。
表4 不同浓度丹参酮ⅡA对RAW264.7细胞活力影响(±s)
2.3 流式细胞术检测各组M1型、M2型巨噬细胞 本实验流式图像分析均使用双参数散点图,按照“十”字四象限进行设置(Q1-1至Q1-4),每象限内以“%”表示不同细胞亚群分布百分比。横坐标及纵坐标分别表示各荧光标记的抗体与目标细胞表面结合荧光强度。M1型巨噬细胞以F4/80+/iNOS+为标记,Q1-2象限内表示M1型巨噬细胞分布情况。与模型组比较,Sirt1敲降组M1巨噬细胞数量明显增多,差异有统计学意义(P<0.001),丹参酮ⅡA组及Sirt1敲降+丹参酮组M1型巨噬细胞数量则明显减少,差异有统计学意义(P<0.01或P<0.001);在对Sirt1基因敲降基础上予丹参酮ⅡA干预后能明显减少M1型巨噬细胞表达,差异有统计学意义(P<0.01)。详见图1、表5。
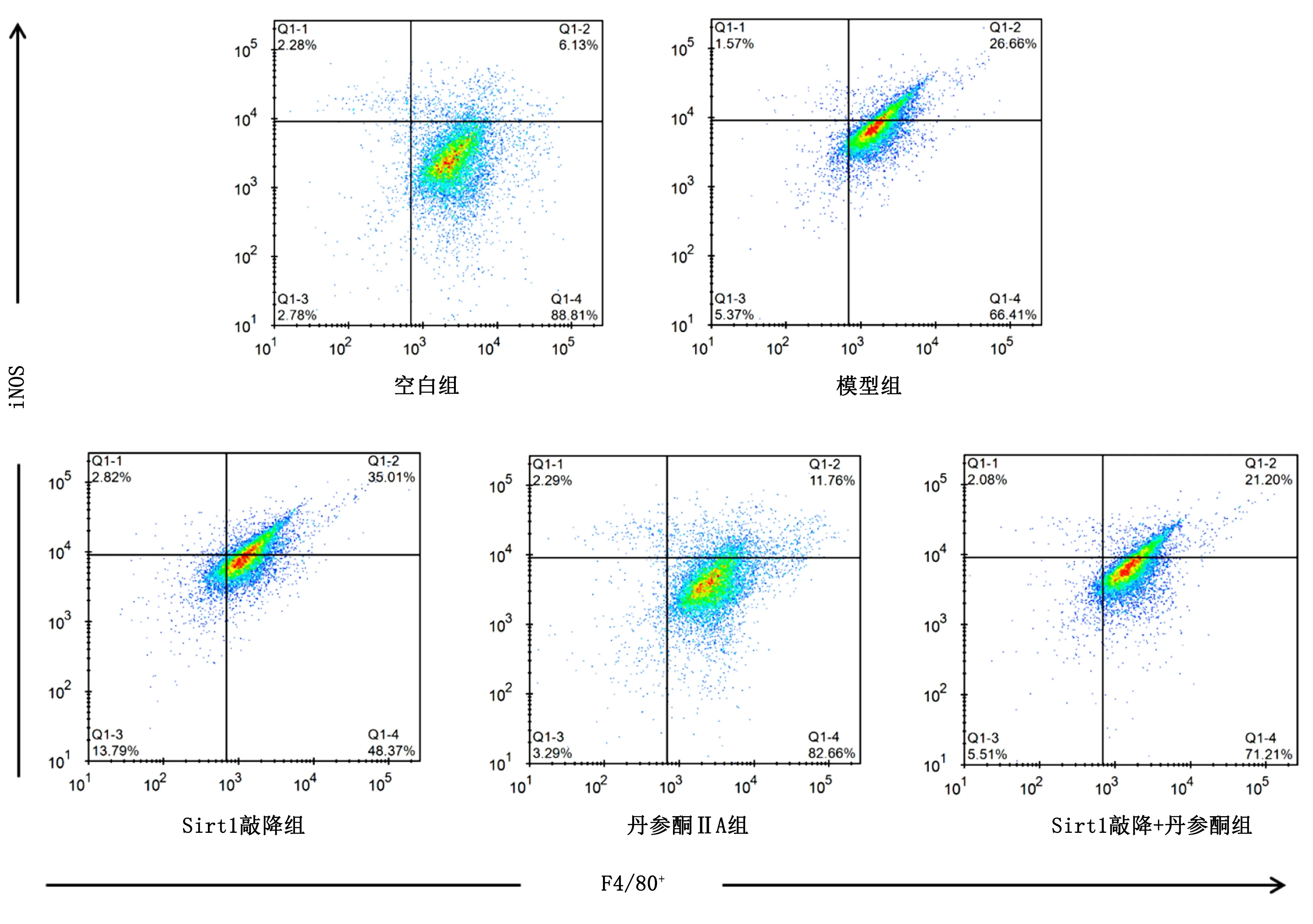
图1 各处理组对M1型巨噬细胞分布影响
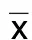
表5 各组对M1型巨噬细胞分布百分比比较(±s)单位:%
M2型巨噬细胞以F4/80+/CD206+为标记,图2中Q1-2象限中为M2型巨噬细胞表达情况。与模型组比较,丹参酮ⅡA组及Sirt1敲降+丹参酮组M2型巨噬细胞数量明显升高,差异有统计学意义(P<0.01),Sirt1基因敲降使M2型巨噬细胞数下降,但差异无统计学意义(P>0.05);与Sirt1敲降组比较,Sirt1敲降+丹参酮组M2巨噬细胞数量明显升高,差异有统计学意义(P<0.01)。详见表6。
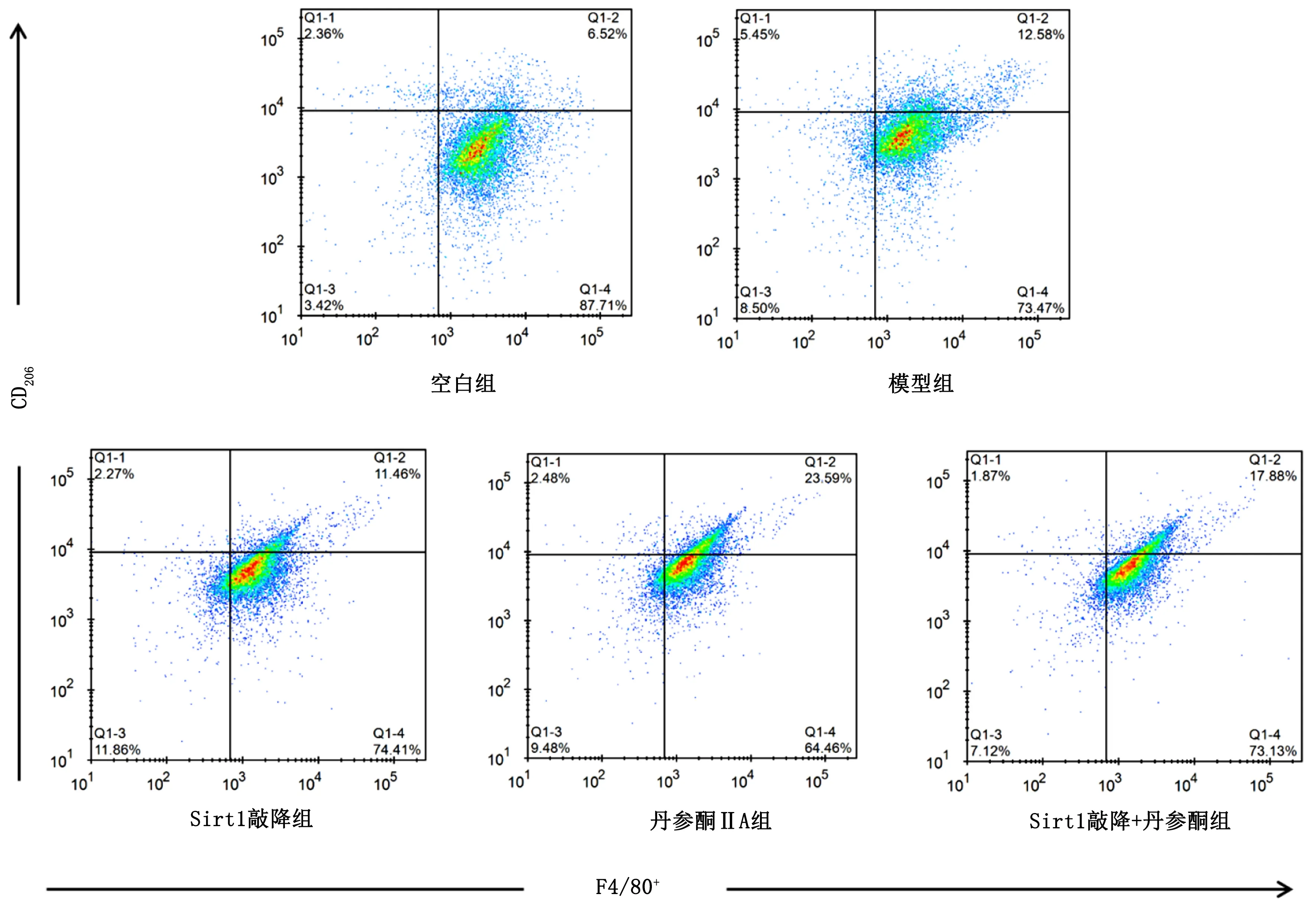
图2 各组M2型巨噬细胞分布情况
表6 各组对M2型巨噬细胞分布百分比比较(±s)单位:%
2.4 Western Blot检测各组Sirt1、PPAR-γ、NF-κB、iNOS、Arg1蛋白表达 与模型组比较,丹参酮ⅡA能够明显上调Sirt1以及M2型巨噬细胞标志蛋白Arg1表达,差异有统计学意义(P<0.01),减少炎症相关NF-κB以及M1型巨噬细胞标志蛋白iNOS表达,差异有统计学意义(P<0.05或P<0.01),丹参酮ⅡA能上调PPAR-γ蛋白表达,但差异无统计学意义(P>0.05);在对细胞进行Sirt1基因敲降后,敲降组Sirt1、PPAR-γ明显减少,差异有统计学意义(P<0.05),NF-κB、iNOS、Arg1表达升高,但差异无统计学意义(P>0.05);与Sirt1敲降组比较,Sirt1敲降+丹参酮组Sirt1表达明显升高,差异有统计学意义(P<0.05),PPAR-γ及Arg1表达增加,但差异无统计学意义(P>0.05),NF-κB、iNOS呈下降趋势,差异无统计学意义(P>0.05)。详见图3、表7。
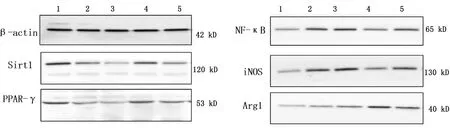
图3 丹参酮ⅡA 对Sirt1、PPAR-γ、NF-κB、iNOS、Arg1蛋白表达影响
表7 各组Sirt1、PPAR-γ、NF-κB、iNOS、Arg1蛋白表达比较(±s)
2.5 各组Sirt1、PPAR-γ、NF-κB、iNOS、Arg1 mRNA表达比较 与空白组比较,模型组Sirt1、PPAR-γ mRNA表达明显下调,差异有统计学意义(P<0.001),NF-κB及iNOS mRNA表达明显升高,差异有统计学意义(P<0.001);与模型组比较,丹参酮ⅡA组能够明显上调Sirt1、PPAR-γ、Arg1 mRNA表达,差异有统计学意义(P<0.05或P<0.01),抑制NF-κB、iNOS mRNA表达,差异有统计学意义(P<0.05或P<0.01),Sirt1敲降组Sirt1、PPAR-γ mRNA表达减少,NF-κB、iNOS、Arg1 mRNA表达升高,但差异无统计学意义(P>0.05);与Sirt1敲降组比较,Sirt1敲降+丹参酮组Sirt1、PPAR-γ、Arg1 mRNA表达增多,但差异无统计学意义(P>0.05),NF-κB、iNOS mRNA表达明显降低,差异有统计学意义(P<0.05或P<0.01)。详见表8。
表8 各组Sirt1、PPAR-γ、NF-κB、iNOS、Arg1 mRNA表达影响(±s)
3 讨 论
动脉粥样硬化所致的血管管腔狭窄及易损斑块的破裂继发血栓是冠心病的主要病理改变,这与中医学中的“血瘀”“血脉瘀阻”有诸多相似之处。陈可冀院士团队采用病证结合方法,提出冠心病主要中医病机为“心血瘀阻,血脉不通”,并提出“瘀毒致变”引发急性心血管事件的假说[8-9],推动了活血解毒中药治疗冠心病的临床实践与科学研究。丹参作为活血化瘀的主要药物,被广泛应用于心血管疾病的治疗实践中。
炎症反应贯穿了动脉粥样硬化发生、发展的全过程,巨噬细胞作为斑块进展的主要参与者,M1 型巨噬细胞增多导致炎性因子分泌增加,损伤内皮细胞导致斑块纤维帽变薄更易破损,成为易损斑块,加速疾病进展;M2 型巨噬细胞增多则导致脂质核心外部的M2型巨噬细胞可吞噬凋亡的M1型巨噬细胞,有助于炎症消退,防止斑块破裂,使斑块趋于稳定,抑制动脉粥样硬化发展[10-11]。沉默信息调节因子Sirtuin(Sirt)家族蛋白(Sirt-7)具有广泛的生物学作用,包括参与脂质代谢、炎症反应、细胞凋亡等[12]。Sirt1基因表达缺失会介导氧化应激、炎症反应的发生[13],抑制PPAR-γ激活、诱导NF-κB活化促使巨噬细胞向M1型巨噬细胞极化[14]。反之,PPAR-γ表达上调能够促进巨噬细胞向M2表型极化。有研究发现,内皮细胞中Sirt1能够催化NF-κB去乙酰化,抑制其过度激活,降低组织因子表达和动脉血栓形成[15],降低凝集素样氧化型低密度脂蛋白受体-1(Lox-1)进而缓解泡沫细胞形成,增加易损斑块稳定性[16]。可见,Sirt1/PPAR-γ/NF-κB信号通路在调控巨噬细胞极化,抑制炎症反应,延缓动脉粥样硬化进展,维持斑块稳定性中发挥重要作用。然而巨噬细胞的种类不仅止于M1、M2型,与人类疾病发展密切相关的部分巨噬细胞的起源和特征仍尚未明确,比如CD169+巨噬细胞、TCR+巨噬细胞和肿瘤相关巨噬细胞[17]。
本研究发现,丹参酮ⅡA能够明显下调RAW264.7巨噬细胞炎症模型中M1型巨噬细胞分布,提高M2型巨噬细胞数量,上调Sirt1、PPAR-γ、Arg1等通路蛋白及mRNA表达,抑制NF-κB、iNOS蛋白和mRNA表达。在对RAW264.7巨噬细胞炎症模型进行Sirt1基因敲降后,M1型巨噬细胞数量较模型组明显升高,M2型巨噬细胞数量则有所下降但差异不明显,但总体呈促炎趋势。对应的Sirt1、PPAR-γ蛋白及mRNA明显减少,然而Arg1并没有如预期中下调,反而有所升高,NF-κB、iNOS蛋白和mRNA表达升高。M1和M2型巨噬细胞极化是一个动态而连续的过程,因此考虑处于二者转化过程中巨噬细胞可能会同时表达个别标志物,故推测这是Sirt1敲除后导致Arg1不降反增的可能原因。
综合上述研究结果,认为丹参酮ⅡA能够通过调控Sirt1/PPAR-γ/NF-κB 信号通路,调控M1、M2型巨噬细胞极化抑制炎症反应发生,进而缓解动脉粥样硬化发展,但在此过程中其他类型巨噬细胞是否参与以及如何干预,有待深入探索。
