热水处理促进胡萝卜的愈伤
2022-05-13柴秀伟朱亚同李宝军李永才PruskyDOV
孔 蕊,柴秀伟,梁 伟,朱亚同,李宝军,李永才,毕 阳,*,Prusky DOV
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.农业研究组织新鲜农产品采后科学部,以色列 里雄莱锡安 7505101)
胡萝卜(Daucus carotaL. var. sativa Hoffm)是重要的园艺作物,世界各国普遍栽培。据联合国粮食及农业组织(Food and Agriculture Organization,FAO)统计,2018年全世界年产萝卜42 814 538 t,我国产量达20 574 774 t,占世界产量的近一半[1-2]。由于胡萝卜根直皮薄,且多为机械采收,采收和采后处理期间极易对直根表皮造成机械损伤,致使其易受到以灰葡萄孢霉(Botrytis cinerea)为主的致腐病原菌的侵染[3]。
热水处理是一种安全有效的采后处理方法,在控制果蔬采后病害、延缓成熟衰老并保持产品品质方面具有重要作用[4]。有研究表明,热水处理可以通过激活苯丙烷代谢,提高H2O2含量和过氧化物酶活性,促进马铃薯块茎伤口部位软木脂和木质素的积累[5]。热水处理可提高山药活性氧和酚类物质代谢水平,促进切口部位木栓质快速形成,有效降低了腐烂率和质量损失率[6]。此外,热水处理还可有效控制地下根茎类蔬菜的采后病害,例如,57.5 ℃热水浸泡20 min可有效减轻由Fusarium sulphureum引起的马铃薯干腐病[7],55 ℃热水喷淋45 s可以有效抑制由Rhizopus stolonifer引起的甘薯软腐病[8]。热处理控制果蔬采后病害的机制除直接抑制或杀死病原菌外[9],还可以激活苯丙烷代谢[10],促进热休克蛋白和病程相关蛋白积累,以及抗菌物质的合成[11]。尽管已有热水处理促进马铃薯和山药愈伤的报道,但热水处理是否影响胡萝卜采后愈伤鲜见报道。本实验用热水处理人工损伤的胡萝卜,测定损伤胡萝卜愈伤期间的质量损失率和病情指数,观察聚酚软木脂(suberin polyphenolic,SPP)和木质素在伤口处的积累,测定胡萝卜伤口处的苯丙烷代谢关键酶活力以及产物含量。以期为热水处理在胡萝卜采后愈伤中的应用提供方法和理论依据。
1 材料与方法
1.1 材料与试剂
供试‘新黑田五寸’胡萝卜于2020年8月26日采自甘肃省金昌市永昌县金玉宏蔬菜园,选取外观良好、大小一致、无病虫害、无机械损伤的胡萝卜,立即装入包装箱,于当天运抵甘肃农业大学食品科学与工程学院采后生物学与技术实验室,于常温((20±3)℃、相对湿度70%~80%)环境下贮藏备用。
供试灰葡萄孢霉(Botrytis cinereaPers.)由中国科学院植物研究所提供,于PDA培养基上培养待用。
无水乙醇、氯化镁、乙酸、丙酮、硼酸、羟胺盐酸、溴化乙酰 国药集团化学试剂有限公司;愈创木酚、福林-酚 天津市光复精细化工研究所;甲苯胺蓝上海中秦化学试剂有限公司;β-巯基乙醇、盐酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、苯甲磺酰氟化物(phenylmethanesulfonyl fluoride,PMSF)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、交联聚乙烯吡咯烷酮(polyvingypyrrolidone,PVPP 北京索莱宝科技有限公司;L-苯丙氨酸 上海凛恩科技发展有限公司;Triton X-100 北京酷来搏科技有限公司;4-香豆酰辅酶A连接酶(4-coumaryl coenzyme A ligase,4CL)提取液 上海源叶生物科技有限公司。
1.2 仪器与设备
HWS24型电热恒温水浴锅、THZ-100型恒温培养摇床 上海一恒科技术有限公司;SPX-30085H-II型生化培养箱 上海新苗医疗器械制造有限公司;HF036型刮皮刀 阳江市阳东区焦点刀具有限公司;SW-CJ-1FD型超净工作台 上海跃进医疗器械有限公司;LDZX-30KBS 型立式压力蒸汽灭菌锅上海申安医疗器械厂;CX21FS1C型生物显微镜奥林巴斯(中国)有限公司;1510型全波长酶标仪赛默飞世尔(上海)仪器有限公司;TGL-20M型台式高速冷冻离心机 长沙平凡仪器仪表公司;UV-2450型紫外-可见光分光光度计 日本岛津公司;Centri Vap真空离心浓缩仪 美国Labconco公司;ACQUITY Arc四元梯度超快速液相色谱仪 美国Waters公司;BS-QT-013型微孔滤膜(0.22 μm) 美国Biosharp公司;CX21FSIC光学显微镜、CX21FS1C型荧光显微镜 日本Olympus公司。
1.3 方法
1.3.1 胡萝卜损伤及热水处理
胡萝卜人工损伤参照Zhang Xuemei等[12]的方法并并适当修改。胡萝卜清洗后用体积分数1%次氯酸钠消毒2 min,蒸馏水冲洗,晾干,用消毒的刮皮刀在每个直根距离顶部与底部40 mm的部位削出2个50 mm×20 mm×1 mm的伤口,室温下晾干。
热水浸泡处理参照Yang Ruirui等[5]的方法。将上述损伤胡萝卜放入装有45 ℃热水的恒温水浴锅中浸泡5 min(产品体积占总水分体积的比例小于10%),以20 ℃室温自来水浸泡作为对照,取出自然晾干后装入打孔的聚乙烯保鲜袋(30 cm×40 cm,厚0.02 mm),置于室温((20±3)℃、相对湿度70%~80%)黑暗条件下进行愈伤。于愈伤的第0、1、3、5、7天测定相关指标。前期预实验发现,胡萝卜在常温条件下愈伤7 d即可实现完全愈伤,伤口处的愈伤组织不再明显增加,故选择在第7天结束实验。
1.3.2 愈伤效果评价
1.3.2.1 质量损失率测定
采用称质量法测定质量损失率,每个处理用胡萝卜9个,重复3次。
1.3.2.2 病情指数测定
参照Yang Ruirui等[5]的方法并作修改。取培养了10 d的B. cinereaPDA平板,用灭菌的涂布器刮取孢子,经4 层纱布过滤后用血球计数板调节至浓度为1×106个/mL的孢子悬浮液。分别在胡萝卜愈伤的第0、1、3、5、7天,吸取上述配制好的孢子悬浮液20 μL接种于胡萝卜伤口处。晾干后装入打孔的聚乙烯保鲜袋,置于常温((20±3)℃、相对湿度70%~80%)避光条件下贮藏,接种7 d后统计各发病级别对应的胡萝卜个数,并按下式计算病情指数。每个处理用胡萝卜9个,重复3次。

式中:发病级别的标准分为5 级,其中:4级,75%<伤口发病表面积比例≤100%;3级,50%<伤口发病表面积比例≤75%;2级,25%<伤口发病表面积比例≤50%;1级,0%<伤口发病表面积比例≤25%;0级,伤口表面不发病。
1.3.3 聚酚软木脂及木质素沉积观察
SPP的沉积观察参照Lulai等[13]的方法并修改。用不锈钢刀片垂直伤口表面切成厚0.2~0.3 mm、长和宽均为1 cm左右的薄片,用蒸馏水冲洗切片表面,置于载玻片上,置于荧光显微镜下观察切片的自发荧光并拍照。
木质素的沉积观察参照Alba等[14]的方法并作适当修改。在垂直伤口表面切出厚度0.2~0.3 mm、长和宽均为1 cm左右的薄片,蒸馏水冲洗8 遍,置于载玻片上滴加1 g/100 mL间苯三酚及浓盐酸染色1 min,置于光学显微镜下拍照观察。
愈伤组织的SPP和木质素细胞层厚度根据Oirschot等[15]的方法通过IS Capture图像软件进行测量并计算。
1.3.4 生化指标测定时的样品处理
参照韩占红等[16]的方法并作修改。用灭菌的手术刀取伤口处3 mm深组织,液氮速冻后用研样机研为粉状,装入50 mL离心管,-80 ℃保存待用。
1.3.5 酶活力的测定
苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活力的测定参照Koukol等[17]的方法并作修改。称取1.0 g冷冻粉末,加入3 mL硼酸-硼砂缓冲液(pH 8.8,含40 g/L PVP、0.2 mol/L EDTA、0.05 mol/Lβ-巯基乙醇),冰浴条件下充分研磨。在4 ℃、10 000 r/min下离心30 min,上清液即为粗酶液。反应体系包括0.5 mL粗酶液、3 mL硼酸-硼砂缓冲液(50 mmol/L,pH 8.8)和0.5 mLL-苯丙氨酸(0.02 mol/L),混合后以反应10 s时测定在290 nm波长处的吸光度,在37 ℃下水浴1 h后,再次测定在290 nm波长处的吸光度。蒸馏水为对照,以每小时吸光度变化度增加0.01为一个酶活力单位(U)。
肉桂酸-4-羟化酶(cinnamic acid-4-hydroxylase,C4H)活力的测定参照Lamb[18]的方法并略作修改。取1.0 g冷冻粉末,加入3 mL提取液(15 mmol/Lβ-巯基乙醇、50 mmol/L pH 8.9 Tris-HCl、4 mmol/L MgCl2、体积分数10%甘油、10 μmol/L亮抑酶肽、5 mmol/L VC、1 mmol/L PMSF、质量分数0.15% PVPP,冰浴条件下充分研磨。在4 ℃、10 000 r/min下离心20 min,上清液即为粗酶液。反应体系:2.2 mL 50 mmol/L Tris-HCl缓冲液(含 8 μmol/L反式肉桂酸、3 μmol/L NADPNa2、6 μmol/L 6-磷酸葡萄糖二钠,pH 8.9)、0.8 mL 粗酶液。在340 nm波长处测定吸光度。以Tris-HCl缓冲液作为对照。以每小时吸光度变化增加0.01为一个酶活力单位(U)。
4-香豆酰辅酶A连接酶(4-coumaryl coenzyme A ligase,4CL)活力的测定参照Voo等[19]的方法并作适当修改。称取1.0 g冷冻粉末,加入3 mL提取液,冰浴条件下充分研磨。在4 ℃,10 000 r/min条件下离心30 min,上清液即为粗酶液。反应体系:0.45 mL 7.5 μmol/L Mg2+(硫酸镁或氯化镁)、0.15 mL 50 nmol/mLp-香豆酸、0.15 mL 2.5 μmol/mL ATP、0.15 mL 38 nmol/mL辅酶A以及0.5 mL粗酶液。40 ℃下反应10 min后,立即在333 nm波长处测定吸光度。以每分钟吸光度增加0.001为1个酶活力单位(U)。
肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活力测定参照Goffner等[20]的方法并略作修改。取1.0 g冷冻粉末,加入3 mL预冷的0.1 mmol/L pH 6.25的磷酸盐缓冲液(含15 mmol/Lβ-巯基乙醇、2 g/100 mL聚乙二醇、0.1 g PVPP),冰浴条件下充分研磨。在4 ℃、12 000 r/min下离心20 min,上清液即为粗酶液。反应体系:1.0 mL粗酶液、3 mL反应液(含10 mmol/L烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、5 mmol/L反式肉桂酸),37 ℃水浴30 min,加入0.1mL 1 mol/L HCl终止反应(如有沉淀离心除去),以0.2 mL磷酸盐缓冲液与0.8 mL反应液为对照,在340 nm波长处测定吸光度。每分钟吸光度变化0.01为一个酶活力单位(U)。
过氧化物酶(peroxidase,POD)活力的测定参照Venisse等[21]的方法并略作修改。取冷冻粉末1.0 g,加入1 mL提取缓冲液(pH 5.5,含1 mmol/L聚乙二醇、质量分数4% PVPP、质量分数1%聚乙二醇辛基苯基醚(Triton X-100)),冰浴条件下充分研磨。4 ℃、12 000 r/min离心30 min,上清液即为粗酶液。反应体系:0.5 mL粗酶液、3 mL 25 mmol/L愈创木酚、200 μL 0.5 mol/L H2O2。以蒸馏水为对照,在470 nm波长处测定吸光度,每隔15 s记录一次,连续测定2 min。以吸光度每分钟变化0.01为一个酶活力单位(U)。
以上酶活力单位均为U/g,结果均以鲜质量计。
1.3.6 4种酚酸和3种木质素前体物质含量的测定
参照Ayaz等[22]的方法并作修改。取1.0 g冷冻粉末,加入3 mL体积分数70%甲醇,40 Hz条件下常温超声提取40 min,8 000 r/min离心30 min,重复2次并收集上清液,用真空冷冻浓缩仪于40 ℃旋转蒸发。蒸干后,用1 mL体积分数70%甲醇复溶,过0.22 μm微孔滤膜备用。采用四元梯度超快速液相色谱分析,色谱条件:Waters Symmetry®C18柱(4.6 mm×250 mm,5 μm);无水甲醇(A)和体积分数1%乙酸(B)为流动相,梯度洗脱程序:0~10 min、30% A+70% B,10~12 min、45% A+55% B,12~15 min、65% A+35% B,15~18 min、30% A+70% B,18~20 min、30% A+70% B,18~20 min、30% A+70% B;流速1 mL/min,进样量10 μL。咖啡酸和芥子酸在325 nm波长处检测,阿魏酸在322 nm波长处检测,肉桂酸在276 nm波长处检测,芥子醇和肉桂醇在273 nm波长处检测,松柏醇在263 nm波长处检测。以上物质含量单位均为μg/g,结果均以鲜质量计。
1.3.7 总酚、类黄酮和木质素含量的测定
总酚和类黄酮的测定参照Mullins等[23]的方法并作修改。称取1.0 g冷冻粉末,加入5 mL体积分数0.5%乙酸与5 mL体积分数70%丙酮,置于低温(4 ℃)黑暗环境24 h,8 000 r/min离心30 min,收集上清液为提取液。总酚含量测定体系:1 mL提取液、2 mL稀释10 倍的福林-酚试剂、2 mL 7.5 g/100 mL Na2CO3,5 min后在760 nm波长处测定吸光度,以无水甲醇为对照。类黄酮含量测定体系:0.5 mL提取液、0.2 mL 质量分数10% Al(NO3)3,常温反应6 min,加入2 mL质量分数 4% NaOH溶液,反应15 min后,蒸馏水定容至5 mL。以无水乙醇为对照,在510 nm波长处测吸光度。总酚和类黄酮含量分别以每100 g鲜样所含没食子酸和儿茶酚质量计,单位μg/100 g。
木质素含量的测定参照Morrison等[24]的方法并做适当修改。称取1.0 g冷冻粉末,加入5 mL预冷的体积分数95%乙醇溶液,10 000 r/min下离心20 min,弃去上清液,沉淀物用体积分数95%乙醇溶液冲洗3 遍后再用V(无水乙醇)∶V(正己烷)=1∶2的混合溶液冲洗3次。置于高于50 ℃烘箱中干燥24 h,干燥物中加入1 mL质量分数25%溴化乙酰冰醋酸溶液,70 ℃恒温水浴 30 min,加入1 mL 2 mol/L NaOH溶液终止反应。再加2 mL冰醋酸和0.1 mL 7.5 mol/L羟胺盐酸,4 ℃、8 000 r/min离心30 min,取上清液0.5 mL用冰醋酸定容至5 mL,于280 nm波长处测定OD值。木质素含量每克鲜组织的OD280nm表征。
1.3.8 H2O2含量的测定
H2O2含量的测定参照Prochazkova等[25]的方法并略修改。取1.0 g冷冻粉末,加入3 mL冷丙酮,冰浴磨成匀浆,于4 ℃下12 000r/min离心20 min,取上清液。反应体系:1 mL上清液、100 μL体积分数20%四氯化钛溶液(溶剂为浓盐酸)和200 μL浓氨水。混匀反应5 min后4 ℃下8 000 r/min离心15 min。沉淀部分用冷丙酮洗涤4次以减少色素的干扰,最后将沉淀溶于1.5 mL 1 mmol/L H2SO4溶液中,于410 nm波长处测定溶液的吸光度。通过标准曲线方程计算H2O2含量,单位为μmol/g,结果以鲜质量计。
1.4 数据统计与分析
上述各项测定至少重复3次。全部数据用Excel 2010软件计算平均值和标准差,用SPSS 19.0软件进行Duncan’s多重差异显著性分析(P<0.05表示差异显著)。
2 结果与分析
2.1 热水处理对胡萝卜愈伤期间质量损失率和病情指数的影响
质量损失率和病情指数是评价愈伤效果的重要指标。愈伤期间,处理组和对照组胡萝卜的质量损失率均持续升高,除第1天外,处理组的质量损失率显著低于对照组,第5天时低于对照组21%(P<0.05)(图1A)。处理组和对照组胡萝卜的病情指数随愈伤时间的延长逐渐降低,处理组的病情指数显著低于对照组,第3天时低于对照组22%(P<0.05)(图1B)。质量损失率和病情指数的结果表明,热水处理组有效促进了胡萝卜的愈伤。
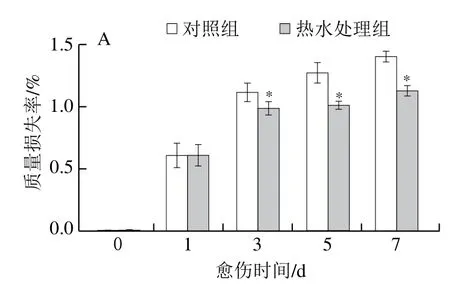
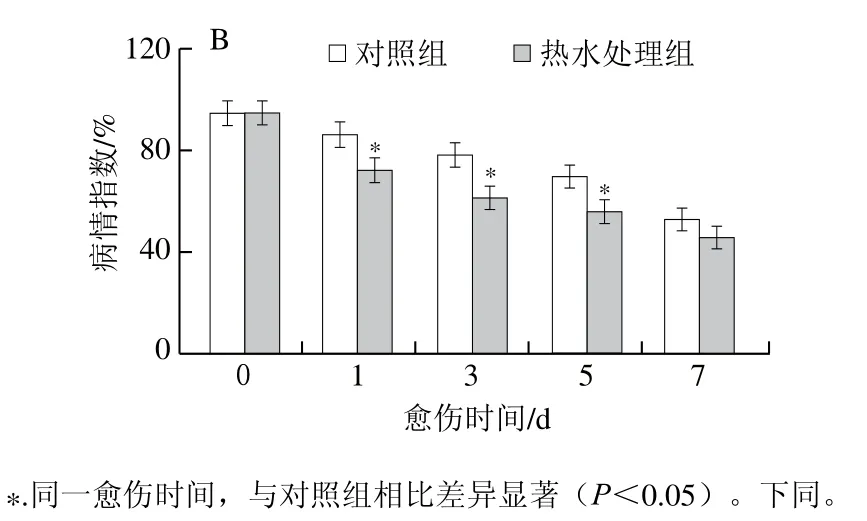
图1 热水处理对愈伤期间损伤胡萝卜质量损失率(A)和损伤接种胡萝卜病情指数(B)的影响Fig. 1 Effect of hot water dipping on mass loss of wounded carrots (A)and disease index (B) of inoculated carrots during wound healing
2.2 热水处理对胡萝卜伤口处SPP和木质素积累的影响
SPP和木质素是伤口处愈伤组织的重要成分。愈伤期间,处理组和对照组胡萝卜在伤口处的SPP、木质素积累量随愈伤时间的延长逐渐增加,差异出现在第3天,之后处理组胡萝卜的积累量均显著高于对照组(图2A、B)。处理组和对照组胡萝卜在伤口处的SPP、木质素细胞层厚度随愈伤时间的延长逐渐增加,其中处理组的SPP细胞层厚度在第3天高出对照组18%(P<0.05),处理组的木质素细胞层厚度在第5天高出对照组16%(P<0.05)(图2C、D)。上述结果表明,热水处理有效促进了胡萝卜伤口处SPP和木质素的积累。
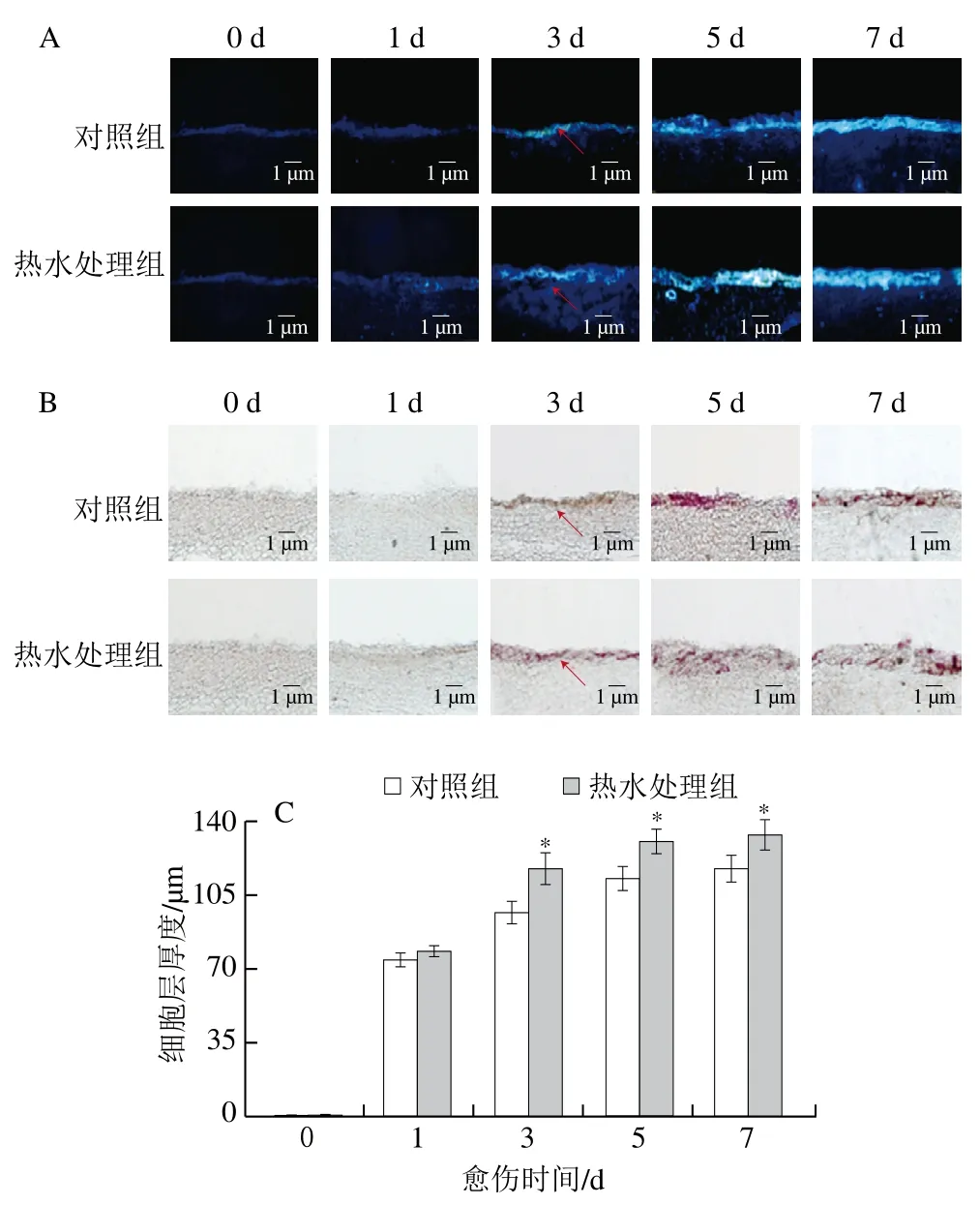
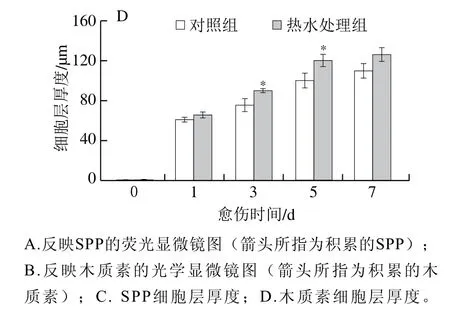
图2 热水处理对胡萝卜伤口处SPP、木质素积累的影响Fig. 2 Effect of hot water dipping on the accumulation of SPP and lignin at wounded sites of carrots during healing
2.3 热水处理对胡萝卜伤口处苯丙烷代谢关键酶活力的影响
苯丙烷代谢的关键酶活性决定酚类物质的生成量。愈伤期间,处理组和对照组胡萝卜伤口处的PAL活力前期迅速增加,第1天达到峰值后逐渐降低,处理组胡萝卜的活力高于对照组,且在第1、3天具有显著性差异,第1天时高出对照组31%(P<0.05)(图3A)。胡萝卜伤口处的C4H、4CL和CAD活力在愈伤期间均呈先升高后降低的变化趋势,在第3天达到峰值,且3 d后处理组整体上显著高于对照组(P<0.05)(图3B~D)。上述结果表明,热水处理激活了胡萝卜伤口处的PAL、C4H、4CL和CAD。

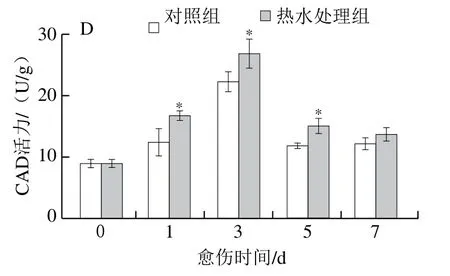
图3 热水处理对胡萝卜伤口处PAL(A)、C4H(B)、4CL(C)和CAD(D)活力的影响Fig. 3 Effect of hot water dipping on the activity of PAL (A), C4H (B) ,4CL (C) and CAD (D) at wound sites of carrots during healing
2.4 热水处理对胡萝卜伤口处4种酚酸以及总酚、类黄酮含量的影响
肉桂酸、咖啡酸、阿魏酸、芥子酸是SPP形成的前体物质。愈伤期间,处理组和对照组胡萝卜的肉桂酸、总酚及类黄酮含量均逐渐上升,处理组胡萝卜在愈伤中后期这些物质的含量均显著高于对照组(P<0.05)(图4A、E、F)。愈伤期间,处理组和对照组胡萝卜的咖啡酸、阿魏酸与芥子酸含量均呈先升高后降低的趋势,处理组胡萝卜的含量高于对照组,且在中后期具有显著性差异(P<0.05)(图4B~D)。上述结果表明,热水处理提高了胡萝卜伤口处肉桂酸、咖啡酸、阿魏酸和芥子酸的含量,促进了总酚及类黄酮的积累。
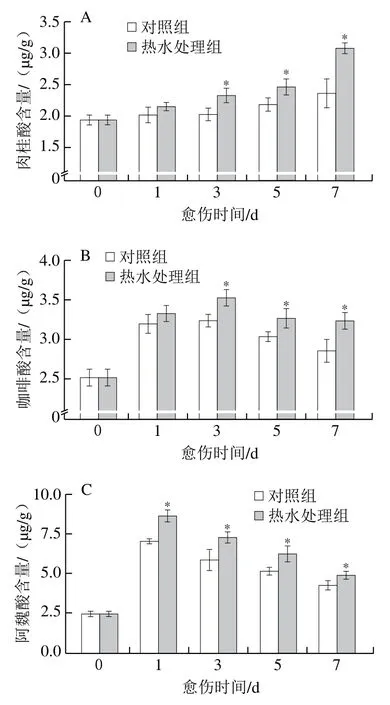
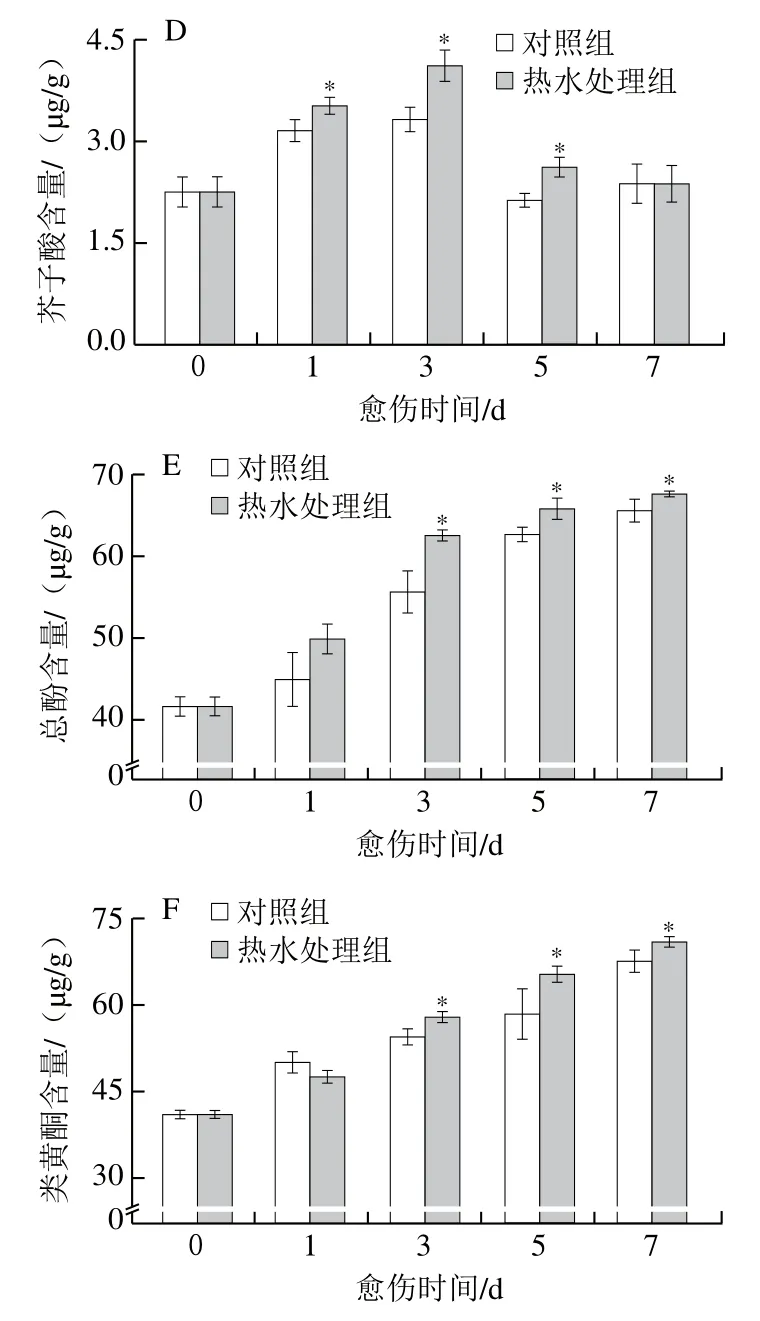
图4 热水处理对胡萝卜伤口处肉桂酸(A)、咖啡酸(B)、阿魏酸(C)、芥子酸(D)、总酚(E)和类黄酮(F)含量的影响Fig. 4 Effect of hot water dipping on the contents of ferulic acid (A),coffeic acid(B), ferulic acid (C), cinnamic acidsinapic acid (D), total phenolics (E) and flavonoids (F) at wound sites of carrots during healing
2.5 热水处理对胡萝卜伤口处3种木质素单体及木质素含量的影响
肉桂醇、松柏醇、芥子醇是木质素单体,愈伤期间,处理组和对照组胡萝卜的肉桂醇、芥子醇及木质素含量均逐渐增加,处理组胡萝卜的这3种物质含量在愈伤中后期均显著高于对照组(P<0.05)(图5A、C、D)。处理组和对照组胡萝卜的松柏醇含量在愈伤期间呈先升高后降低的变化趋势,处理组胡萝卜的含量高于对照组,且在第1、3、7天具有显著性差异,第3天时高出对照组26%(P<0.05)(图5B)。上述结果表明,热水处理组提高了胡萝卜伤口处肉桂醇、松柏醇、芥子醇和木质素含量。
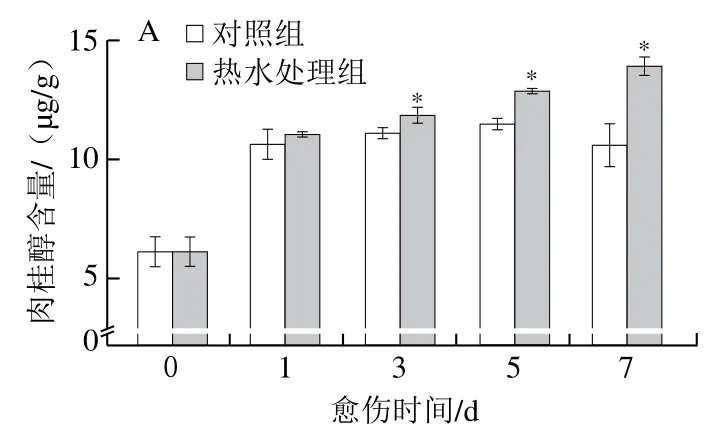
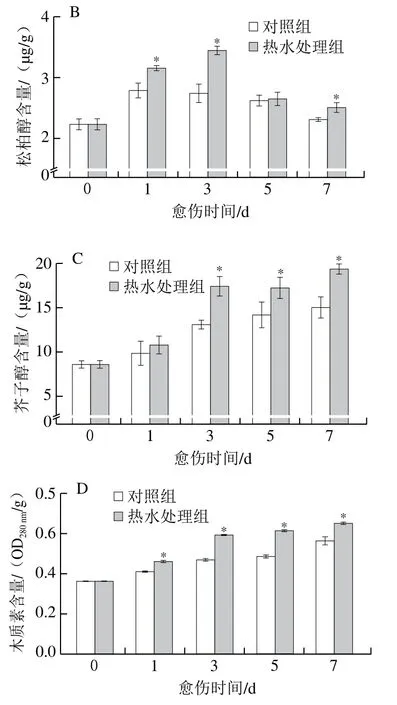
图5 热水处理对胡萝卜伤口处肉桂醇(A)、松柏醇(B)、芥子醇(C)和木质素(D)含量的影响Fig. 5 Effect of hot water dipping on the contents of cinnamyl alcohol (A),coniferyl alcohol (B), sinapyl alcohol (C) and lignin (D) at wound sites of carrots during healing
2.6 热水处理对胡萝卜伤口处H2O2含量和POD活力的影响
H2O2含量和POD活力可反映SPP和木质素单体的聚合水平。处理组胡萝卜的H2O2含量在愈伤期间先上升后下降再上升,对照组胡萝卜的H2O2含量在愈伤早期有所增加,后趋于平稳。除第5天外,处理组胡萝卜的H2O2含量显著高于对照组(P<0.05)(图6A)。处理组和对照组胡萝卜的POD活力在愈伤期间不断增加,处理组显著高于对照组,第1天时高出对照组1.75 倍(P<0.05)(图6B)。上述结果表明,热水处理提高了胡萝卜伤口处的H2O2含量和POD活力。
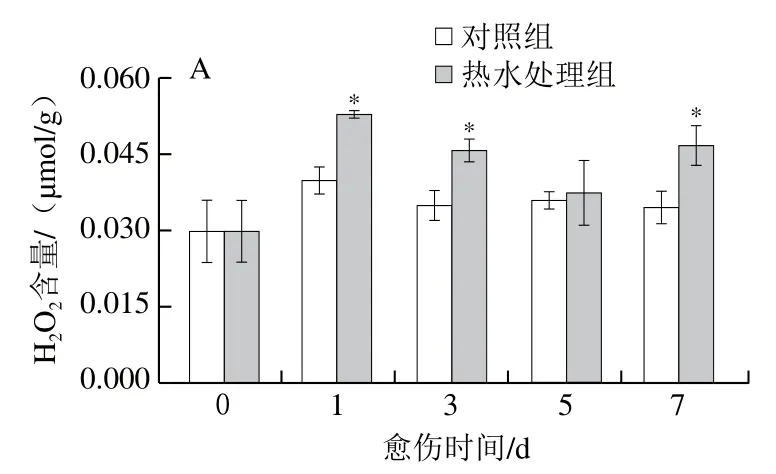
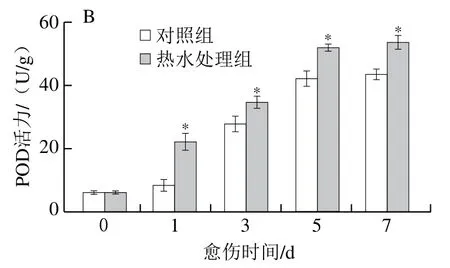
图6 热水处理对胡萝卜伤口处H2O2含量(A)和POD活力(B)的影响Fig. 6 Effect of hot water dipping on H2O2 content (A) and POD activity (B) at wound sites of carrots during healing
2.7 胡萝卜各指标之间的相关性分析结果
为了验证胡萝卜愈伤过程中各指标间的关系,选取了具有代表性的质量损失率、病情指数、SPP细胞层厚度、木质素细胞层厚度、总酚和木质素含量6个指标,通过皮尔逊相关性分析来明确他们之间的关系。由表1可知,与胡萝卜愈伤相关的6个指标间均呈极显著相关(P<0.01)。其中,质量损失率(r=0.904)、SPP细胞层厚度(r=0.928)及木质素细胞层厚度(r=0.945)与总酚含量呈极显著正相关,这些指标与木质素含量也呈极显著正相关(r分别为0.771、0.896、0.911)。而病情指数与总酚含量(r=-0.952)和木质素含量(r=-0.974)呈极显著负相关。这些结果表明,热水处理对促进损伤胡萝卜的愈合具有重要意义,提高了损伤胡萝卜对病原菌的抗性。
以上结果均为现象指标,应进一步研究愈伤相关通路(如文中提出的苯丙烷代谢)基因或蛋白水平变化结果,才更能阐释热水处理的加速愈合机制。
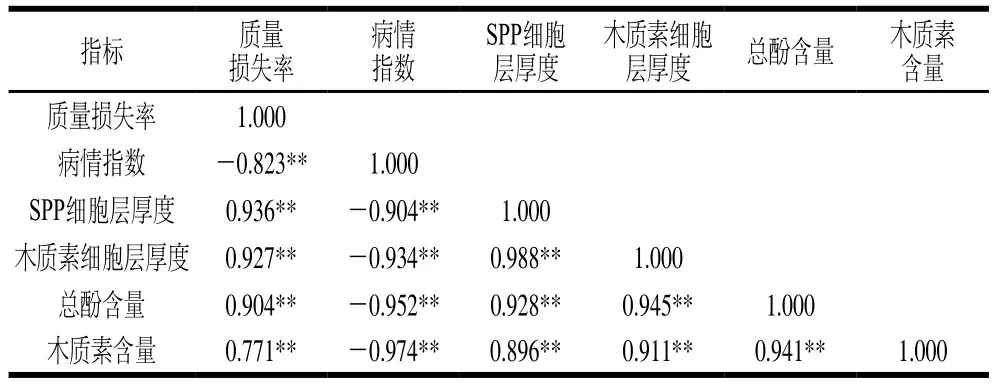
表1 胡萝卜愈伤效果与总酚和木质素含量之间的关系Table 1 Relationship between wound healing indexes and the contents of total phenolics and lignin in carrots
3 讨 论
本研究发现,热水处理可有效降低损伤胡萝卜愈伤期间的质量损失率(图1A),该结果与热水处理降低马铃薯愈伤期间质量损失率的结果[5]类似。热水处理减少胡萝卜质量损失的原因可能是处理组激活了苯丙烷代谢,促进了酚类物质的产生。而酚类物质是SPP和木质素的合成底物,随着SPP与木质素在伤口表面的聚合,有效阻止了通过伤口的水分蒸腾[26]。此外,热水处理还可通过融化表皮蜡质封闭部分气孔来减少水分蒸腾[10]。本研究还观察到,热水处理有效降低了B. cinerea损伤接种胡萝卜的病情指数(图1B),该结果与热水处理降低F. sulphureum损伤接种马铃薯块茎的病情指数的结果[5]类似。有报道表明,热水处理可以促进SPP与木质素在伤口表面积累,从而形成物理屏障有效阻止病原菌的侵入[26]。此外,热水处理还可促进具有抗菌活性的多酚和类黄酮合成,激活热休克蛋白及病程相关蛋白,从而抑制病原菌的生长和扩展[27]。
苯丙烷代谢在愈伤过程中具有重要作用,既可提供SPP和木质素形成的底物,又可形成具有抗菌和抗氧化功能的多酚和黄酮类物质[28]。PAL是苯丙烷代谢的关键酶和限速酶,参与第一步反应,将L-苯丙氨酸脱去氨基生成反式肉桂酸,反式肉桂酸在C4H的作用下羟基化生成香豆酸,香豆酸可在香豆酸-3-羟基化酶作用下生成咖啡酸,咖啡酸通过氧甲基转移酶作用生成阿魏酸,阿魏酸通过阿魏酸-5-羟基化酶羟基化生成5-羟基阿魏酸,后者再通过5-羟基阿魏酸-O-甲基转移酶甲基化生成芥子酸[29]。这些酚酸会被4CL转化成为相应的香豆酸-CoA、阿魏酸-CoA和咖啡酸-CoA,这些酚酸-CoA在肉桂酰辅酶A还原酶的催化下分别形成香豆醛、芥子醛和松柏醛[30]。然后CAD将这些醛类物质转化成肉桂醇、松柏醇、芥子醇等木质素的底物[31]。本研究观察到,热水处理组激活了PAL、C4H、4CL和CAD(图3A~D),促进了肉桂酸、咖啡酸、阿魏酸、芥子酸、总酚和类黄酮的合成(图4A~F),以及肉桂醇、松柏醇与芥子醇的积累(图5A~C)。该结果与热水处理促进马铃薯伤口处总酚和类黄酮积累的结果[5]类似。有研究表明,桃果实在热水处理组后会快速应激,PAL基因表达量迅速上升[32]。因此推测,热水处理可能通过调控PAL在转录水平上的表达来促进酚类物质的合成。至于热水处理组如何调控苯丙烷代谢尚有待进一步研究。
SPP和木质素是愈伤组织的主要成分。SPP主要由羟基肉桂酸、阿魏酸等酚酸通过酯键和醚键连接而成,具有抵抗病原菌侵染的作用[33]。木质素主要由松柏醇、芥子醇和肉桂醇通过碳-碳键、醚键和酯键聚合而成[34]。木质素在细胞壁沉积除可增加其强度、限制病原菌的侵入外,还可毒杀病原物[35]。本研究发现,热水处理促进了胡萝卜伤口表面SPP和木质素的积累(图2),该结果与热水处理促进山药伤口处SPP和木质素积累的结果[6]类似。SPP和木质素单体的氧化交联均需要POD和H2O2的参与[36],本研究发现,热水处理提高了胡萝卜伤口处H2O2含量(图6A),该结果与热水处理提高马铃薯伤口处H2O2含量的结果[5]类似。有研究表明,热处理可提高表达水母发光蛋白的转基因烟草细胞质中Ca2+浓度[37]。而Ca2+可以作为信号分子激活钙依赖蛋白激酶(calciumdependent protein kinase,CDPK),CDPK磷酸化位于质膜的NADPH氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase,NOX),NOX转移电子到O2生成O2-·,由于O2-·存活寿命较短,很快又被超氧化物歧化酶歧化成易存活的H2O2[38]。因此推测,热处理组胡萝卜伤口处的H2O2含量升高可能与热处理组调节Ca2+水平激活NOX途径有关,但其具体作用机理有待进一步研究。本研究还观察到,热水处理提高了胡萝卜伤口处的POD活性(图6B)。该结果与热水处理促进山药伤口处POD的积累结果[6]类似。有研究表明,热处理可诱导葡萄果实Hsp70的基因表达,POD活性也随之增加[39]。因此,推测热处理提高胡萝卜伤口处POD活性与热处理组促进热激蛋白相关基因的表达有关。
4 结 论
热水处理可激活胡萝卜伤口处的PAL、C4H、4CL和CAD,促进肉桂酸、咖啡酸、阿魏酸、芥子酸、总酚及类黄酮,以及肉桂醇、松柏醇、芥子醇和木质素的合成。此外,热水处理还提高了胡萝卜伤口处的H2O2含量和POD活性。胡萝卜伤口处的酚酸和木质素单体在H2O2和POD的作用下氧化交联,聚合形成的SPP和木质素在伤口表面不断沉积,从而有效降低了胡萝卜愈伤期间的质量损失率和损伤接种的病情指数,促进了胡萝卜的采后机械损伤愈伤。
