壳寡糖对酒精诱导的新生大鼠脑组织氧化应激损伤和凋亡因子的影响
2022-05-13陈逸伦夏文水
王 斌,陈逸伦,夏文水
(1.江南大学食品学院,江苏 无锡 214122;2.江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
胎儿酒精谱系综合征(fetal alcohol spectrum disorder,FASD)的症状包括胎儿出生前后发育迟缓、面部缺损或畸变[1]、智力和行为障碍等[2]。大脑发育期的酒精暴露可以引起一系列中枢神经系统发育损害,是欧美国家可预防严重智力残疾的主要诱因[3],酒精暴露对发育中的中枢神经系统造成多种影响,包括影响脑容量和神经活动的降低,损害基底神经节,损害小脑、海马和皮层等大脑区域的发育,从而破坏学习和记忆能力[4-5]。FASD目前无法根治,酒精对中枢神经系统的损害是永久的,临床上多使用一般精神药物进行治疗,对中枢神经系统直接进行作用,但长期应用易引起明显依赖性,对人体健康有明显影响,因此寻找有效安全的治疗方法十分重要。许多文献表明酒精暴露会导致脑部神经产生氧化应激损伤和炎症反应[6],并对认知和学习记忆能力产生重要影响[7-8],酒精通过激活神经细胞凋亡途径造成神经元细胞非正常凋亡[9]。同时一些文献表明酒精暴露导致的新生大鼠的神经细胞凋亡与胱天蛋白酶(caspase)-3的激活有关[10-11],Caspase-3作为凋亡终端酶在凋亡细胞凋亡过程中被激活,一些研究表明酒精作为γ-氨基丁酸(γ-aminobutyric acid,GABA)激活剂能够上调GABA水平[12-14],影响神经元的迁移,激活Caspase-3从而导致神经细胞的非正常凋亡。
壳寡糖(chitooligosaccharide,COS)由β-1,4糖苷键连接N-乙酰氨基葡萄糖组成的碱性氨基寡糖,由于其良好的水溶性、易降解和极其微小的细胞毒性受到广泛关注[15]。许多文献表明COS具有的多种生理活性,如抗氧化[16]、抗炎、抗肿瘤、免疫调节[17]以及神经活性等[18]。COS具有良好的血脑屏障穿透能力[19],能够直接到达大脑产生作用。COS对各种原因引起脑部神经损伤的各种症状,如氧化应激损伤、炎症反应以及神经细胞凋亡都有一定程度的影响[20],研究表明COS能够影响体外体内的神经细胞,对阿尔茨海默病脑损、谷氨酸盐等引起的神经性脑损伤都具有保护作用[21]。Jiang Maorong等对周围神经受损大鼠进行COS干预,发现COS对周围神经细胞具有保护及促进再生的作用[22]。Yang Yuming等对体外PC-12细胞神经元进行COS干预,发现经COS处理后的PC-12细胞突触生长能力和细胞活性都得到提升,表明COS具有提高PC-12细胞神经元分化能力[23]。Wu Wei等发现COS的干预改善了新生大鼠缺氧缺血性脑损伤,显著降低了丙二醛(malondiadehyde,MDA)、乳酸水平,对减轻缺氧缺血造成的氧化应激损伤有积极影响[24]。以往的文献对酒精暴露对发育中的中枢神经系统造成影响的具体机制有过多种探索,但对酒精暴露所致脑神经发育异常的抑制物质研究较少,具体机制尚不清楚。因此,本实验通过建立成熟的FASD新生大鼠模型来研究酒精暴露所导致的新生大鼠大脑的氧化应激损伤和神经细胞凋亡情况,旨在探究COS能否抑制酒精暴露导致的发育中新生大鼠的脑部损伤及其潜在机制。
1 材料与方法
1.1 实验动物、材料与试剂
56只SPF级SD新生大鼠由北京斯贝福实验动物有限公司提供,实验动物生产许可证号为SCXK(京)2019-0010。
壳寡糖(平均分子质量1 299 Da、脱乙酰度85%)实验室自制;95%(体积分数)乙醇(药用级) 上海阿拉丁生化科技股份有限公司;蒸馏水 屈臣氏饮用水有限公司;其他常用有机试剂及无机试剂均为分析纯 国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、MDA、谷胱甘肽(glutathione,GSH)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒南京建成生物工程研究所;RIPA裂解液、苯甲磺酰氟(phenylmethyl sulfonyl fluoride, PMSF)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、脱脂乳粉、Cleaved-Caspase-3抗体、Pro Caspase-3抗体、Bax抗体上海碧云天生物技术有限公司;β-actin抗体、羊抗兔免疫球蛋白G(H+L) 武汉三鹰生物技术有限公司;聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜美国Merck & Millipore公司;增强型化学发光(enhanced chemiluminescenc,ECL)试剂盒 上海天能有限公司。
1.2 仪器与设备
4K15冷冻型离心机 德国Sigma公司;UV-1800型紫外-可见分光光度计 日本岛津公司;FC全自动酶标仪美国赛默飞世尔科技公司;SCIENTZ-48高通量组织研磨机 宁波新芝生物科技公司;Mini PROTEAN 3 cell型电泳仪、小型Trans-Blot转印槽、ChemiDoc MP全能型成像系统 美国Bio-Rad公司;DM2000 LED显微镜德国徕卡公司。
1.3 方法
1.3.1 动物分组和FASD模型建立
实验动物于江南大学动物实验中心饲养,每笼放养4只,每天接受12 h黑暗/12 h光照,光照时间段为8∶00~20∶00,实验室室温为(22±2)℃,相对湿度为40%~70%,实验操作严格遵守国际伦理学规范,实验动物处理方法通过江苏省无锡市伦理审核,伦理审核编号:JN.No20190615S0070810 [159]。
参考文献[25]建立FASD模型,具体步骤为:在新生大鼠出生后第4天(postnatal day 4,PD4),将SD新生大鼠按体质量随机分为正常对照组(NC)、药理组(COS)、模型组(Mod)及COS干预组(COS+Mod),每组14只,共56只,尽量保持每组都有相同数量的雌性和雄性。通过灌胃法进行新生大鼠酒精给药和COS干预。根据国家关于COS作为“食品新原料”的规定[26],COS的每日推荐量为不高于0.5 g/d,换算成大鼠剂量为45 mg/(kgmb·d)。新生大鼠在PD4早上8点对各组进行第1次灌胃,灌胃时将新生大鼠与母鼠分开并测定体质量,COS组和COS+Mod组分别给予4.5 mg/mL COS溶液(10 mL/kgmb·d),NC组和Mod组给予10 mL/kgmb·d蒸馏水,给药周期为PD4~PD9。Mod组和COS+Mod组大鼠在PD5~PD9进行酒精造模(给予5.25 g/(kgmb·d)乙醇[27]),连续5 d按照33 mL/kgmb·d给予体积分数20%的乙醇溶液(用体积分数95%乙醇(药用级)配制),分两次给予酒精,每次剂量相等,Mod组与COS+Mod组分别在COS给药后90 min内给予第一次酒精,2 h后给予第二次酒精,NC组和COS组给予等体积蒸馏水,每次灌胃完成后将新生大鼠归还母鼠。
1.3.2 新生大鼠脑组织的采集、固定与观察
各组新生大鼠在PD9时测定终体质量,然后新生大鼠腹腔注射1%(质量分数,下同)的戊巴比妥钠溶液(10 mL/kgmb),麻醉后颈部脱臼处死,于冰上分离脑组织,测定脑组织质量后冻存在-80 ℃下备用。
同时在PD9时每组随机抽取3只大鼠,大鼠进行腹腔注射1%的戊巴比妥钠溶液(10 mL/kgmb),麻醉后用磷酸缓冲溶液(0.01 mol/L、pH 7.4)进行心脏灌注,当肝脏变白后用4%多聚甲醛溶液进行灌注,灌注结束后颈部脱臼处死大鼠,于冰上分离脑组织。脑组织在4%甲醛溶液中固定24 h,随后用无水乙醇和二甲苯进行梯度处理,然后进行石蜡包埋,石蜡切片后用于后续苏木精-伊红(hematoxylin-eosin,HE)染色,通过DM2000 LED显微镜对新生大鼠大脑海马区和皮质区进行病理学观察。
1.3.3 体质量与脑器官指数测定
新生大鼠PD4~PD9每天测定并记录体质量,计算新生大鼠PD9时的脑器官指数(脑组织质量与体质量的比值×100%)。
1.3.4 脑组织氧化还原状态的测定
取1.3.2节冻存在-80 ℃下的脑组织,按试剂盒说明书,用生理盐水制备脑组织质量分数为10%的匀浆,参考对应的试剂盒说明书测定脑组织中SOD、MDA、GSH、T-AOC水平,结果以蛋白质量计。
1.3.5 免疫蛋白印迹法测定脑组织蛋白表达
取1.3.2节-80 ℃保存的脑组织0.1 g,经1 mL RIPA裂解液提取总蛋白,并用BCA蛋白浓度测定试剂盒测定蛋白浓度,各组蛋白样品(30 μg/孔)经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,湿转至PVDF膜(250 mA、1 h),经TBST洗涤5 min后用5%脱脂奶粉封闭2 h,然后用TBST洗涤5 min,重复洗涤3次后一抗(Cleaved Caspase-3、Pro Caspase-3、Bax和Bcl/2均以1∶1 000 稀释;β-actin以1∶5 000稀释)4 ℃孵育12 h。然后用TBST洗涤5 min,重复洗涤3次后用二抗室温孵育1 h,再次经TBST洗涤5 min,重复洗涤3次。显影前滴加ECL工作液于PVDF膜上进行反应,显影拍照后计算目的蛋白条带和内参条带(β-actin)灰度值的比值进行蛋白相对表达水平分析。
1.4 数据统计与分析
所有数据均采用平均值±标准偏差表示,采用SPSS 19.0软件进行数据单因素方差分析,采用t检验进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。采用GraphPad Prism 7绘制折线图和柱状图。
2 结果与分析
2.1 COS对酒精暴露下新生大鼠体质量增长情况及脑器官指数的影响
图1A为PD4~PD9新生大鼠每天的体质量增长情况,COS组、Mod组、COS+Mod组大鼠每天的体质量增长趋势都小于NC组,在大鼠PD6时,经酒精灌胃后Mod组体质量显著低于NC组(P<0.05);在大鼠PD7~PD9时,Mod组体质量极显著低于NC组(P<0.01);在大鼠PD9时,COS+Mod组体质量显著高于Mod组(P<0.05)。说明酒精暴露导致新生大鼠出现发育缓慢,而COS干预可以改善新生大鼠生长发育情况。由图1B可知,Mod组脑器官指数最高,较NC组有极显著提高(P<0.01),脑器官指数增加可能与酒精暴露导致脑水肿有关。COS+Mod组较Mod组脑器官指数显著降低(P<0.05),说明COS可对酒精暴露造成的脑损伤有缓解作用。
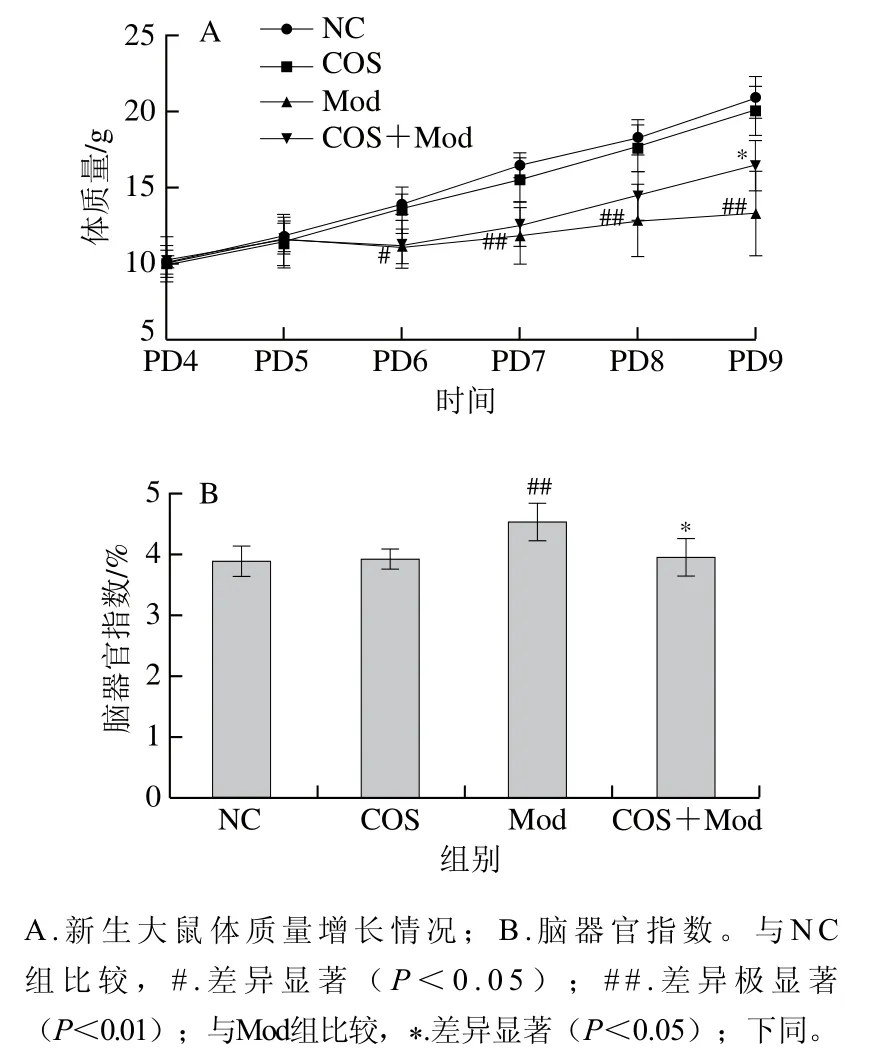
图1 PD4~PD9新生大鼠体质量增长情况及脑器官指数Fig. 1 Changes in body mass gain from PD4 to PD9 and brain organ index of neonatal rats
2.2 COS对酒精暴露下新生大鼠脑组织病理学的影响
图2A为各组在PD9时新生大鼠的脑组织海马区HE染色情况,可以看出Mod组海马区神经细胞有明显的固缩变形,细胞核深染难以辨认,排列不规则,部分神经细胞出现坏死,细胞间隔变大。NC组与COS组神经细胞则排列紧密,层次清除,细胞结构完整、细胞核清晰。COS+Mod组有小部分神经细胞出现固缩变形坏死情况,但大部分神经细胞结构完整、细胞核可辨。从图2B中可以看出,Mod组皮质区神经细胞出现固缩变形,排列混乱,可以看到部分神经细胞出现坏死变形。NC组与COS组神经细胞则排列有序,层次清除,细胞结构完整、细胞核清晰。COS+Mod组有小部分神经细胞出现排列混乱,但大部分神经细胞结构完整、细胞核可辨。说明COS可对酒精暴露造成的脑神经细胞变形坏死有缓解作用。
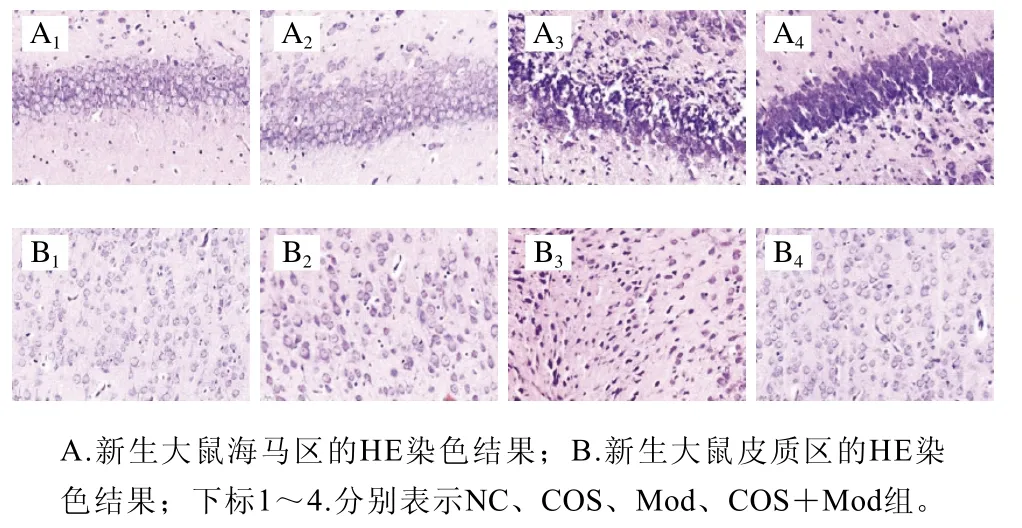
图2 各组新生大鼠脑组织病理学图(200×)Fig. 2 Histopathological image of neonatal rats brain tissue in each group (200 ×)
2.3 COS对酒精暴露导致新生大鼠脑组织氧化损伤的影响
由图3可知,Mod组脑组织的SOD活力、GSH含量、T-AOC较NC组极显著降低(P<0.01),MDA含量则极显著提高(P<0.01)。COS+Mod组较Mod组的SOD活力、GSH含量、T-AOC显著或极显著提高(P<0.05、P<0.01),COS+Mod组的MDA含量较Mod组显著降低(P<0.05),COS组比NC组的SOD活力、GSH含量稍低,但无统计学差异(P>0.05)。从以上结果可以看出,COS可以缓解酒精诱导的新生大鼠脑组织氧化应激损伤,提高其抗氧化能力和清除自由基能力。
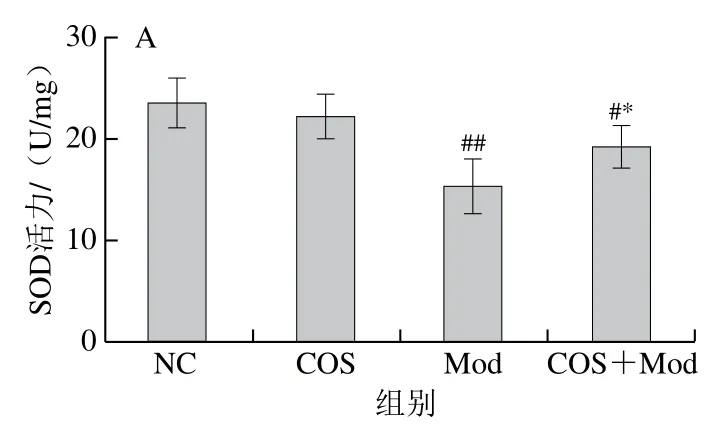
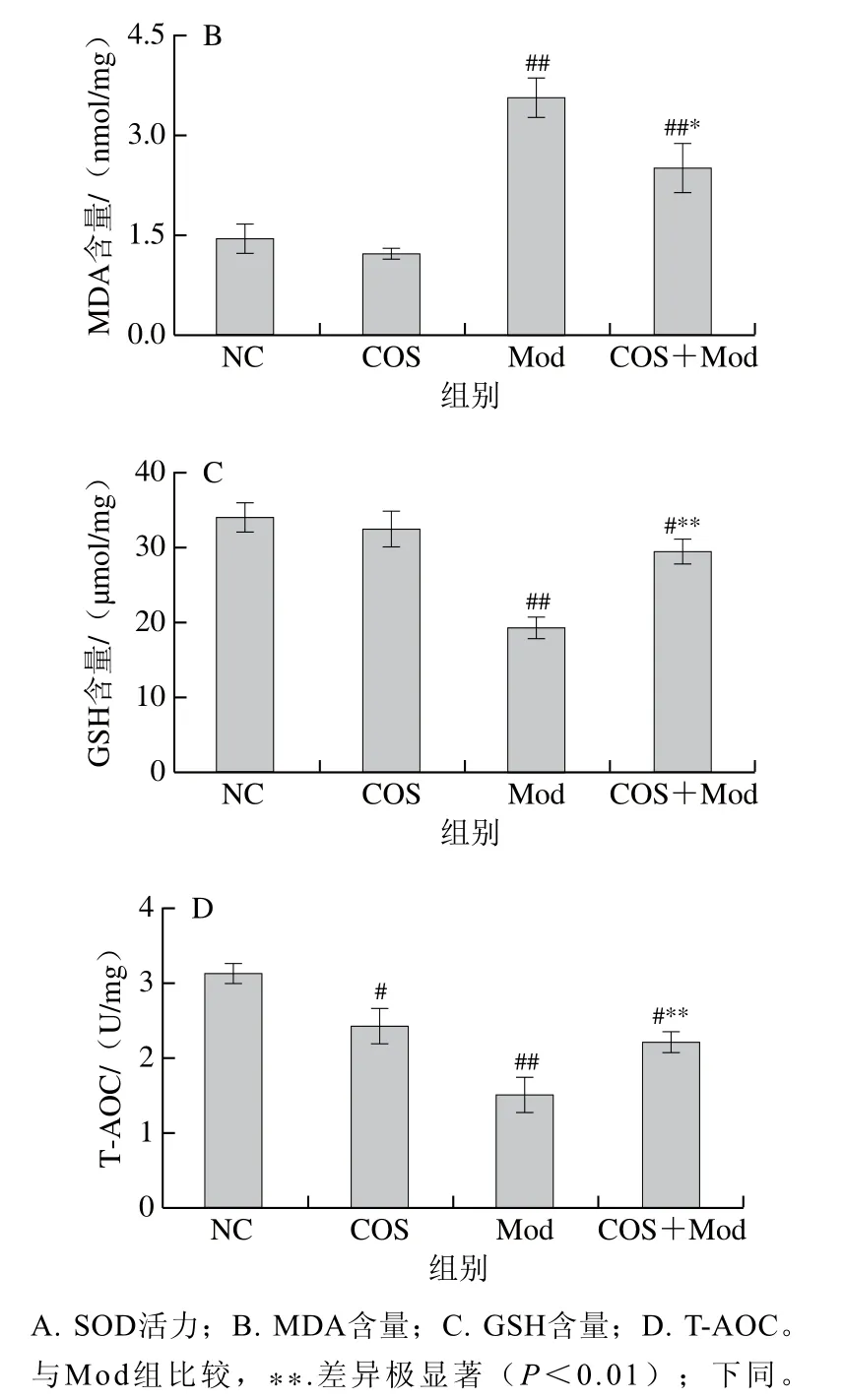
图3 COS干预对酒精暴露导致新生大鼠脑组织氧化损伤的影响Fig. 3 Effect of COS intervention on cerebral oxidative damage induced by alcohol exposure in neonatal rats
2.4 COS对酒精暴露下新生大鼠脑组织中Cleaved Caspase-3、Pro Caspase-3、Bax和Bcl/2相对表达水平的影响
利用蛋白免疫印迹法研究COS干预对在酒精暴露下新生大鼠脑组织中Cleaved Caspase-3、Pro Caspase-3、Bax和Bcl/2表达的影响,结果如图4A所示。如图4B、C所示,各组新生大鼠脑组织中Cleaved Caspase-3相对表达水平存在明显差异,Mod组大鼠脑组织中Cleaved Caspase-3和Pro Caspase-3相对表达水平较NC组显著或极显著增加(P<0.05、P<0.01);COS+Mod组较Mod组大鼠脑组织中Cleaved Caspase-3、Pro Caspase-3相对表达水平极显著降低(P<0.01)。NC组和COS组Cleaved Caspase-3和Pro Caspase-3相对表达水平无显著性差异,由此可知酒精暴露诱导发育中的新生大鼠大脑Cleaved Caspase-3、Pro Caspase-3相对表达水平升高,而COS干预大大降低了酒精暴露导致的Cleaved Caspase-3、Pro Caspase-3激活。进一步分析COS对Bax和Bcl/2相对表达水平的影响,结果如图4D、E所示,酒精暴露对Bax具有激活作用,Mod组脑组织Bax相对表达水平极显著高于NC组(P<0.01),而Bcl/2相对表达水平则极显著低于NC组(P<0.01)。经COS干预后,COS+Mod组脑组织Bax相对表达水平较Mod组极显著降低(P<0.01),Bcl/2相对表达水平显著上升(P<0.05)。综上,COS对酒精诱导的脑组织凋亡相关蛋白的激活有抑制作用。
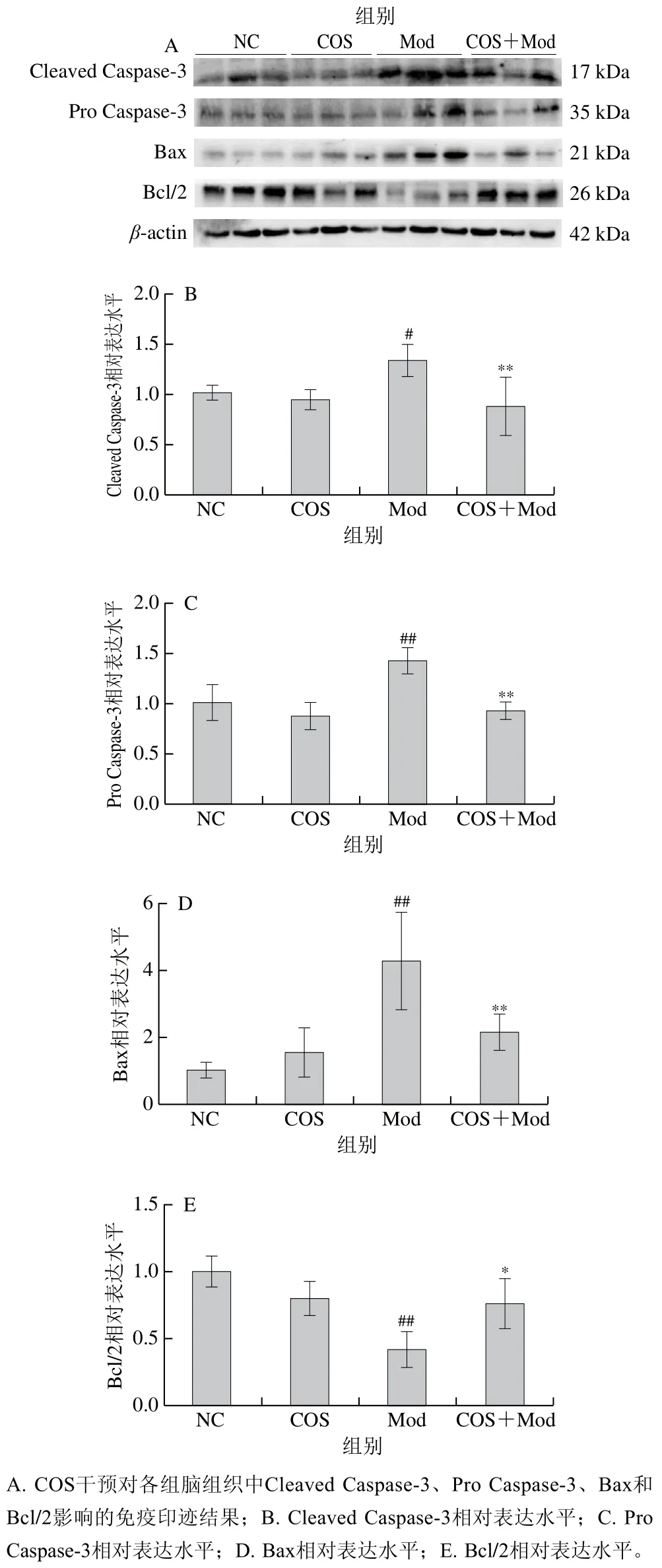
图4 COS对酒精暴露下新生大鼠Cleaved Caspase-3、Pro Caspase-3、Bax和Bcl/2相对表达水平的影响Fig. 4 Effect of COS on the relative expression levels of cleaved caspase-3, pro-caspase-3, Bax and Bcl-2 in neonatal rats exposed to alcohol
3 讨 论
在近20年来对酒精滥用对胎儿发育中的大脑产生有害影响的研究中,研究者们广泛地使用酒精暴露新生大鼠模型(FASD动物模型)。本实验采用FASD动物模型来验证COS缓解酒精暴露下的新生大鼠氧化应激损伤和神经细胞凋亡的能力。以往的许多文献表明酒精可在脑生长突增期时引起广泛的神经元细胞异常死亡[9],这种大量的非正常神经元死亡发生在人类胎儿出生前3个月和出生后的前几年,而大鼠脑生长突增期则是在大鼠出生后几天内。通过动物模型实验,许多研究对酒精诱导发育中的神经细胞死亡的具体机制进行了广泛的探索,文献表明在大脑发育过程中,酒精暴露可导致大量神经元异常死亡,最常见的神经元死亡模式是细胞凋亡[9]。酒精诱导发育中的神经细胞凋亡的机制是复杂的,可能与脑源性神经营养因子、微RNA(microRNA,miRNA)被破坏、氧化应激损伤和神经炎症以及凋亡相关蛋白的激活有关[28]。细胞凋亡的特征是形态学和生化变化,形态学改变包括染色质凝结、膜泡形成、DNA片段化和凋亡小体形成。神经细胞凋亡的一个主要变化是Caspase-3被激活,Pro Caspase-3和Cleaved Caspase-3作为凋亡终端酶在神经元凋亡过程中起重要作用。酒精诱导的神经细胞凋亡伴随着与Caspase-3相关的固有凋亡通路的激活,包括Bax、Bcl/2和细胞色素c的上调/释放,这与Pro Caspase-3和Cleaved Caspase-3的激活高度相关[11]。
COS是一种具有抗氧化、抗炎、神经保护活性和抗凋亡特性的天然寡糖[29],具有良好的水溶性,易穿越血脑屏障。COS由于在结构上含有羟基、氨基等活性基团而具有强的抗氧化性,先前研究表明COS能降低生物体内自由基水平,影响MDA、T-AOC、GSH、总巯基(total sulphur,T-SH)、非蛋白结合巯基(non-protein sulfhydryl,NP-SH)、金属硫蛋白(metallothionein,MT)水平,减少氧化应激损伤[21-24]。此外,COS对多种中枢神经系统疾病有明显的治疗作用,如周围神经损伤和脑创伤性损伤,以及阿尔茨海默病、帕金森病和新生儿缺氧缺血性脑损伤[30]等退行性神经疾病。COS的神经保护作用的保护机制有多种说法[31],如抗氧化(自由基抑制剂/清除剂)机制、抗炎机制、抗遗传毒性、抗凋亡、基因表达调节;离子通道调节以及金属离子螯合剂和调节神经营养因子等方式。刘贵娟等的研究表明羧甲基壳寡糖能够缓解阿尔茨海默病模型大鼠中氧化应激损伤,有效抑制海马神经细胞的凋亡,降低大鼠大脑海马区MDA和乙酰胆碱酯酶的水平,显著提高SOD和谷胱甘肽过氧化物酶的活力[32];戴雪伶等的研究表明COS可以明显抑制H2O2引起的神经细胞死亡,影响乳酸脱氢酶释放量及MDA含量,能够使凋亡蛋白Bax和抗凋亡蛋白Bcl/2的比值下降,通过影响凋亡蛋白对神经细胞起到抗凋亡作用[33]。
本实验探究了COS是否可以通过调控氧化应激损伤和凋亡相关蛋白的激活来缓解酒精暴露诱导的新生大鼠脑部损伤。体质量增长的情况在一定程度上反映了新生大鼠的发育情况,脑器官指数是评价动物大脑发育情况的重要指标。酒精暴露下新生大鼠的体质量增长明显比正常大鼠缓慢,脑器官指数也明显增加。本研究中,COS干预可显著提高体质量增长情况,降低脑器官指数。说明COS干预可以对酒精诱导导致的新生大鼠生长发育和脑部发育滞缓有积极影响。HE染色实验结果显示,酒精暴露可使新生脑组织神经细胞发生病理性改变,而COS干预可有效缓解新生脑组织生理损伤。新生儿脑耗氧量高,抗氧化能力弱,新生儿大脑易受氧化应激引起的组织损伤,最终导致脑部损伤,COS干预可明显提高T-AOC水平,同时降低MDA水平,MDA是脂质过氧化的产物,其含量是对氧化应激最敏感的指标之一,MDA可引起膜通透性增加、ATP活力降低,从而导致神经细胞损伤。对于酒精暴露下的新生大鼠,COS干预可上调GSH水平和SOD活力,对维持新生儿神经系统正常发育起重要作用。本实验还研究了COS是否可以通过影响凋亡相关蛋白的激活表达来缓解酒精暴露诱导的神经凋亡。结果表明,酒精暴露增加了Cleaved Caspase-3、Pro Caspase-3和Bax的表达,抑制了Bcl/2的激活表达。此外,与Mod组相比,COS干预有效抑制了Cleaved Caspase-3和Pro Caspase-3的表达,抑制了Bax表达的激活和Bcl/2的下调。这与Xu Wei等[20]体外培养皮质神经细胞进行COS干预从而抑制神经细胞凋亡的研究结果相似,其结果表明COS能够稳定线粒体膜电位,提高Bcl/2/Bax的比值,抑制Pro Caspase-3的激活表达,并且能够提高Akt和胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2激活表达,抑制葡萄糖剥夺引起神经细胞凋亡。此外,Zhou Songlin等对体外培养的海马神经细胞进行COS干预,研究结果表明COS能够抑制谷氨酸盐诱导的海马神经细胞中Pro Caspase-3的激活表达,缓解海马神经细胞凋亡[21]。因此,本研究结果表明COS可能通过抑制Caspase-3相关凋亡通路的激活来抑制酒精暴露所导致的新生大鼠神经细胞损伤。
综上,本研究表明COS可以通过减轻酒精暴露诱导的新生大鼠脑组织氧化应激损伤和抑制Caspase-3等凋亡相关蛋白的激活来抑制酒精暴露所导致的新生大鼠神经细胞损伤,然而,COS缓解酒精诱导神经凋亡的作用机制还有待于进一步研究。后续实验可以围绕COS对Caspase-3相关凋亡通路的影响开展研究。
