外源海藻糖浸种对低温胁迫油菜种子萌发及幼苗生长的影响
2022-05-13张钰钦杨之帆李越李银水胡小加秦璐廖星
张钰钦,杨之帆,李越,李银水,胡小加,秦璐*,廖星
(1.中国农业科学院油料作物研究所,湖北 武汉, 430062;2.湖北大学生命科学学院,湖北 武汉, 430062)
油菜作为国产植物油第一大供给源,每年可提供的食用油量占国产植物油的47%[1]。我国油菜种植面积位居全球首位,特别是冬油菜,作为我国唯一的冬季油料作物,在不与其它粮食作物争地的前提下,可有效利用冬季空闲耕地[2]。但是随着国家粮食政策的调整,双季稻的种植面积不断扩大,收获期延长到10 月下旬甚至11 月上旬,影响了后茬作物冬油菜的种植[3]。气象研究表明,湖北省10 月下旬气温常下降到15℃以下,11 月上旬甚至会出现4~10℃的低温[4]。随着播种时间的后移和气温的下降,油菜在种植过程中更容易遭遇低温冷害[5]。油菜迟播还会造成苗期光合作用效率低,积累的生物量不足,难以应对低温胁迫,从而造成减产[6]。有研究表明,不同播期的油菜因光温条件不同,生物量会产生相应变化,物质转化能力明显降低[7]。
植物体内积累可溶性糖类物质是一种较为常见的抗逆响应。海藻糖(trehalose)是一种稳定的非还原性二糖,由两个葡萄糖分子以α-1,1-糖苷键构成[8]。近年研究发现,海藻糖不仅存在于真菌、细菌和昆虫中,同时存在于高等植物中。在逆境胁迫下,海藻糖通常作为能量或者信号分子,具有保护细胞内活性物质、调节细胞渗透压、清除自由基、维持细胞器完整性等功能。研究表明,通过外源添加特定浓度的海藻糖,可以提高植物的抗逆性,已经在黄瓜、小麦、玉米、西红柿、生菜及烟草等作物中得到了验证[9~15]。
本试验探讨外源施用海藻糖对低温胁迫下油菜种子萌发、幼苗生长及相关能量物质、酶活性等方面的影响,以期明确海藻糖的适宜浓度,为在低温胁迫下施用提升油菜抗低温胁迫能力提供有效措施和依据。
1 材料与方法
1.1 材料
甘蓝型油菜品种中油杂19,由中国农业科学院油料作物研究所培育,是当前我国冬油菜主产区的主推品种之一。
1.2 试验设计
试验采用智能人工气候箱(宁波东南仪器,型号:RXZ-500D)进行种子萌发及幼苗生长,培养参数为:昼16 h/夜8 h;光照强度12 000 Lux;相对湿度60%。
培养液为1/4 Hoagland 营养液,采用不同浓度海藻糖浸种,具体设置如下:常温(24±1)℃空白组,不浸种,利用1/4 Hoagland 营养液培养(NT);低温(10±1)℃空白组,不浸种(LT);低温(10±1)℃对照组,蒸馏水浸种(LWT);低温(10±1)℃处理组,利用不同浓度海藻糖溶液浸种,浓度设置分别为:5 mmol/L(T5)、10 mmol/L(T10)、15 mmol/L(T15)、20 mmol/L(T20)和25 mmol/L(T25),不同浓度海藻糖溶液均用蒸馏水配制。
以H2O(蒸馏水)和不同浓度海藻糖溶液作为种子浸种液,在已灭菌的玻璃培养皿中放入种子500颗左右,倒入浸种液30 mL,常温(24±1)℃避光浸种处理24 h。
1.3 指标检测
1.3.1 油菜种子发芽相关指标测定 种子浸种结束后,从培养皿中挑选籽粒饱满、大小一致的种子进行发芽试验。将种子摆放于垫有3层滤纸的圆形培养皿(12 cm×2 cm)中,每皿50 粒,每个处理设置3 次生物学重复,分别添加1/4 Hoagland 营养液10 mL,除常温处理(NT)放入常温培养箱(24±1)℃外,其余处理均置于低温培养箱(10±1)℃内进行培养。逐日统计其发芽种子数量,于第3 d 统计发芽势,第7 d统计发芽率。
种子发芽相关指标包含:发芽率、发芽势、发芽指数、活力指数以及平均发芽时间。
发芽率=M1/M×100%发芽势=M2/M×100%
发芽指数(GI)=∑(Gt/Dt)
活力指数(VI)=GI×S
平均发芽时间(MGT)=∑(Gt×Dt)/∑Gt
式中M1代表第7 d 正常发芽粒数;M2代表第3 d 的正常发芽粒数;M代表供试种子粒数;Dt代表发芽天数;Gt代表与Dt相对应的每天发芽种子数;S代表正常幼苗鲜重[16]。
1.3.2 油菜幼苗表型与生物量相关指标 浸种处理后,将种子置于种子发芽袋(180 mm × 125 mm,PHYTOTC)中用于检测幼苗生长情况。具体操作如下:将不同处理后的种子置于种子发芽袋中培养,每袋种植10 株油菜幼苗,每个处理设置4 次生物学重复。发芽袋中加入1/4 Hoagland 营养液30 mL,除常温处理(NT)放入常温培养箱(24±1)℃以外,其余低温处理均置于低温培养箱(10±1)℃内进行培养,每隔2 d补充培养液。于第10 d,从不同处理中挑选大小一致且具有代表性的幼苗植株进行拍照取样,用于检测营养指标。
利用扫描仪(型号ScanMaker 1000XL plus)获取植株形态图像,然后将地上部与地下部分离。用滤纸吸干水分后,分别称重并记录,后用钢尺(50 cm)测量长度(苗长为从茎顶端生长点到根颈之间的距离,根长为主根根尖到根颈之间的距离),后装入牛皮纸105℃杀青20 min 后75℃烘至恒重,测定干重,后将干样磨粉后进行氮、磷、钾检测[17]。
1.3.3 油菜幼苗养分含量及累积量测定 称取上述发芽袋中的油菜制作成干样粉末0.1500 g,采用浓H2SO4-H2O2消煮,凯氏定氮仪(K9860,海能仪器)测定氮含量;ICP-OES(Optima 7000DV,Pekin Elmer)测定磷含量,火焰光度计(Model410,Sherwood)测定钾含量[18]。油菜苗期养分累积量计算公式如下:
养分累积量= 幼苗植株干重×幼苗植株养分含量
1.3.4 异柠檬酸裂解酶活性、可溶性物质及脯氨酸含量检测 每个处理称取15 份0.1 g 左右籽粒饱满的油菜种子,置于10 mL离心管中,分别添加不同处理溶液6 mL,避光浸种24 h。后将浸种完毕的种子置于垫有3 层滤纸的培养皿中,加入10 mL 的1/4 Hoagland 营养液进行培养,NT 处理置于常温培养箱(24±1℃),LT、LWT、T10 处理置于低温培养箱(10±1℃)。分别于浸种前24 h,浸种后0 h、24 h、48 h、96 h,共计5 次(每次3 皿)检测样品的异柠檬酸裂解酶活性及可溶性糖、可溶性蛋白、脯氨酸的含量。
异柠檬酸裂解酶活性采用紫外分光光度法检测(Solarbio-BC2030-异柠檬酸裂解酶活性检测试剂盒,Solarbio公司)[19]。
可溶性蛋白含量采用考马斯亮蓝G-250 方法检测[20]。可溶性糖采用可见分光光度法检测(Solarbio-BC0030- 可溶性糖检测试剂盒,Solarbio公司)[21]。
脯氨酸含量检测采用磺基水杨酸法。利用磺基水杨酸从植物体内提取游离脯氨酸,在酸性条件下与茚三酮反应呈现红色,甲苯萃取后在520 nm 处测定吸光度,其吸光度与脯氨酸含量成正比[22]。
1.4 数据处理与分析
种子发芽试验数据处理中的平均值与标准差的计算均为3 次重复所得,种子幼苗实验数据处理中的平均值与标准差的计算均为4 次重复所得,采用SPASS Statistics 20.0 统计软件与R 4.03,ggpubr包进行试验数据统计分析和多重比较。
通过单样本柯尔莫可洛夫-斯米洛夫检验(Kolmogorov-Smirnov test,K-S test)分析实验数据是否服从正态分布,服从则采用单因素方差分析(ANOVA),多重比较采用邓肯检验(Duncan’s test),不同的字母表示组间差异显著(p<0.05);不服从正态分布的数据,则不适合使用ANOVA,检验方式将采用的独立样本克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test),分析(post hoc analysis)采用t 检验(t-student),不同的字母表示组间差异显著(p<0.05)。
能量代谢及渗透调节物质与发芽指标的相关性,采用双变量相关分析,先使用皮尔逊(Pearson)的积矩相关系数来测量连续变量之间的相关大小和方向,后利用显著性检验验证结果。
2 结果与分析
2.1 外源海藻糖浸种对低温胁迫下种子萌发的影响
在适宜萌发的温度(24±1)℃下,油菜种子24 h开始萌发,萌发率为90.7%。低温(10±1)℃胁迫时,萌发率及发芽势急剧下降,不浸种对照第3 d 才开始萌发,第5 d 后才趋于稳定,萌发率仅为49.3%(图1)。根据发芽曲线图显示,不同浓度海藻糖浸种后,种子萌发时间缩短,萌发率显著提升,种子第2 d 便可陆续萌发,在第3 d 达到峰值。随着海藻糖浓度的不断提升,油菜种子发芽率呈现先增加后降低的趋势。不同浓度海藻糖浸种处理的种子发芽率和发芽势均显著高于LT 组,且当海藻糖浓度为10 mmol/L 时发芽率和发芽势最高,较LWT 处理分别提升19.4%和61.8%,发芽时间也显著降低了21.7%(表1)。其中当海藻糖浓度为10 mmol/L 时,种子第2 d 便开始萌发,并于第5 d 后趋于稳定,于第7 d 发芽率可高达86.7%,同时该浓度海藻糖处理下油菜种子发芽指数及活力指数显著高于其它低温处理,平均发芽时间也显著低于其余低温处理(表1)。

表1 外源添加不同浓度海藻糖对低温胁迫下油菜发芽率的影响Table 1 Effect of different concentrations of exogenous trehalose on the germination rate of rapeseed under low temperature stress
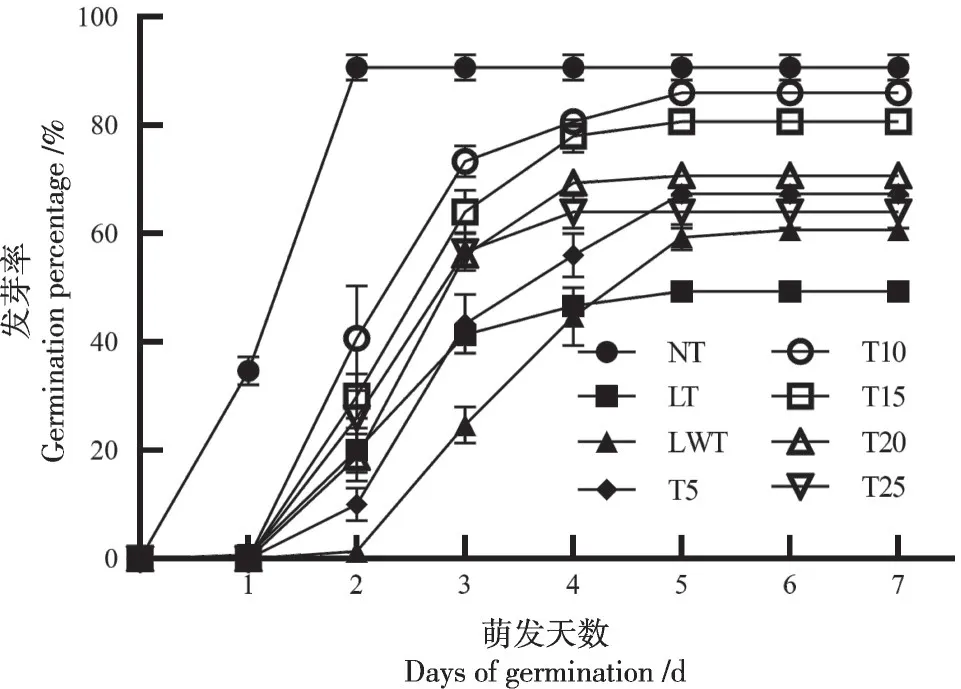
图1 不同处理对油菜种子发芽率的影响Fig.1 Effect of different treatments on rapeseed seed germination rate
2.2 外源海藻糖浸种对低温胁迫下幼苗生长的影响
低温胁迫会造成种子萌发后幼苗长势相对较弱,尤其是对根系生长发育的抑制作用较为明显(图2)。
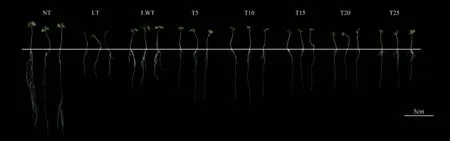
图2 不同处理下油菜种子萌发10 d后幼苗表型Fig.2 Phenotype of rape seedlings under different exogenous trehalose soaking at the 10th day of germination
低温胁迫时,LT 组油菜苗长、根长、全苗长以及干鲜重指标均显著低于NT 组(表2)。经过海藻糖浸种处理后,T5~T25 5 个处理组的根长、全苗长均显著高于LWT 组,但对于苗长指标,仅T10 处理显著高于LWT 组。T5~T25 海藻糖处理组中,T10 组的苗长指标仅显著高于T25 组,T10 组根长与全苗长及干、鲜重等指标高于T15、T20、T25组,表现出一定的生长优势。
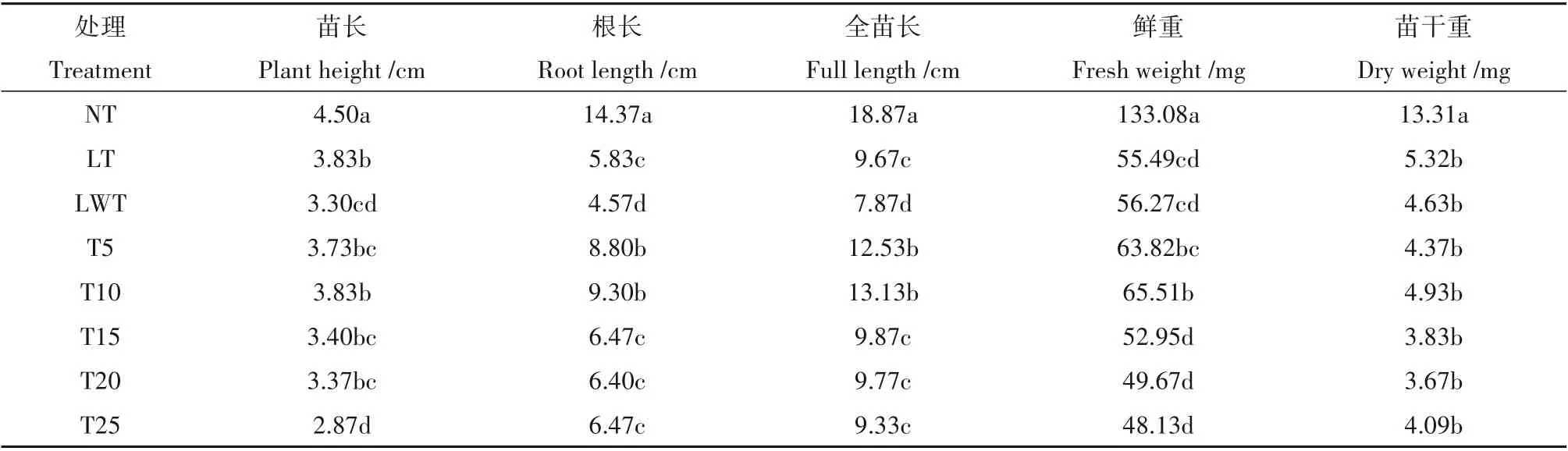
表2 外源添加不同浓度海藻糖对低温胁迫下油菜幼苗生长的影响Table 2 Effect of exogenous trehalose soaking on growth of rapeseed seedlings under low temperature stress
综上所述,低温胁迫下海藻糖处理可以显著促进幼苗的全苗长,其中海藻糖浸种浓度为10 mmol/L效果相对较好。
2.3 外源海藻糖浸种对低温胁迫下种子异柠檬酸裂解酶活性的影响
由图3 可得,在常温条件下,异柠檬酸裂解酶(ICL)活性在96 h 内随着时间呈现上升的趋势。而在低温胁迫下,油菜种子内ICL 活性一直保持在一个较低的水平。10 mmol/L 海藻糖浸种后ICL 活性先降低,24 h处开始上升,浸种后培养48 h后酶活性高于LT 组;96 h时,显著高于LWT 组(图3),表明10 mmol/L 海藻糖处理在浸种后可以提升油菜ICL 活性,加快油菜种子中脂肪转换成碳水化合物,增加油菜种子中可利用物质的含量,促进油菜种子萌发和幼苗生长。
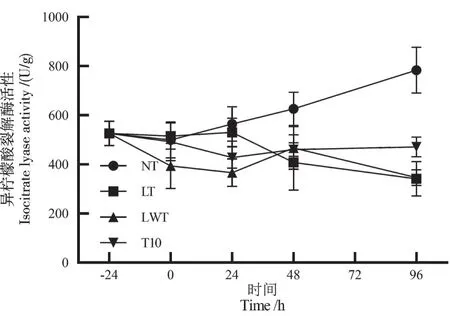
图3 不同处理对油菜种子异柠檬酸裂解酶活性的影响Fig.3 Effect of different treatments on isocitrate lyase ac⁃tivity of rape seeds
2.4 外源海藻糖浸种对低温胁迫下种子能量代谢及渗透调节的影响
图4A 显示,随着种子萌发时间的延长,种子中可溶性蛋白的含量不断降低,表明种子萌发伴随着可溶性蛋白不断消耗的过程。当种子发芽过程面临低温胁迫时,其生理活动受到抑制,可溶性蛋白的消耗速率减慢。而海藻糖浸种后可有效提高油菜种子可溶性蛋白的消耗量(图4A)。相关性分析结果表明,种子萌发过程中可溶性蛋白的含量与各项发芽指标之间存在显著或者极显著相关(表3),其中浸种后24 h、48 h、96 h 含量与发芽势、发芽率及发芽指数呈现极显著的负相关,其中浸种后培养24 h与平均发芽时间呈现显著正相关(0.695),浸种后48 h、96 h与平均发芽时间呈现极显著正相关(分别为0.738 和0.861),这些数据表明油菜种子浸种后24 h、48 h 及96 h 后可溶性蛋白含量与种子萌发存在关联。
从图4B可以看出,作为种子萌发后48 h内的主要能量,可溶性糖含量随着种子萌发过程减少。低温胁迫时种子自身活力减弱,降低了其体内糖分的分解利用速率。海藻糖浸种后油菜种子在低温处理下可溶性糖的分解能力强于LT 与LWT 对照组(图4B),这表明海藻糖浸种可以促进低温胁迫下种子中可溶性糖的分解与利用。浸种48 h 后,种子内可溶性糖含量与发芽指标之间呈现显著或极显著相关(表3),其中浸种48 h 后,可溶性糖含量与发芽指数呈现极显著负相关(-0.876),与平均发芽时间呈现出极显著正相关(0.897)。但是之后,结果则正好相反,这可能与幼苗生长后进行光合作用有关。该结果表明油菜种子浸种后48 h、96 h 后可溶性糖含量与种子萌发存在紧密的相关性。
图4C 可见,正常萌发时,种子体内的脯氨酸含量先增加后减少,48 h 达到最高。低温处理会造成种子体内脯氨酸含量保持在一个较低的水平,脯氨酸含量提升减慢。24 h 后T10 处理脯氨酸含量开始增加,48 h后增速加快。而LT与LWT处理则在24 h时反而略有下降,直到48 h 后才开始增加。低温下,T10 处理可以使脯氨酸迅速累积,有效提高脯氨酸的含量,可见其作用在于以这种方式增加种子的抗寒能力。24 h、48 h、96 h 后,脯氨酸含量与发芽势、发芽率、发芽指数、活力指数、根长和苗鲜重均存在极显著正相关,与平均发芽时间呈现极显著负相关,表明油菜种子萌发过程中,脯氨酸含量与种子萌发存在相关性(表3)。
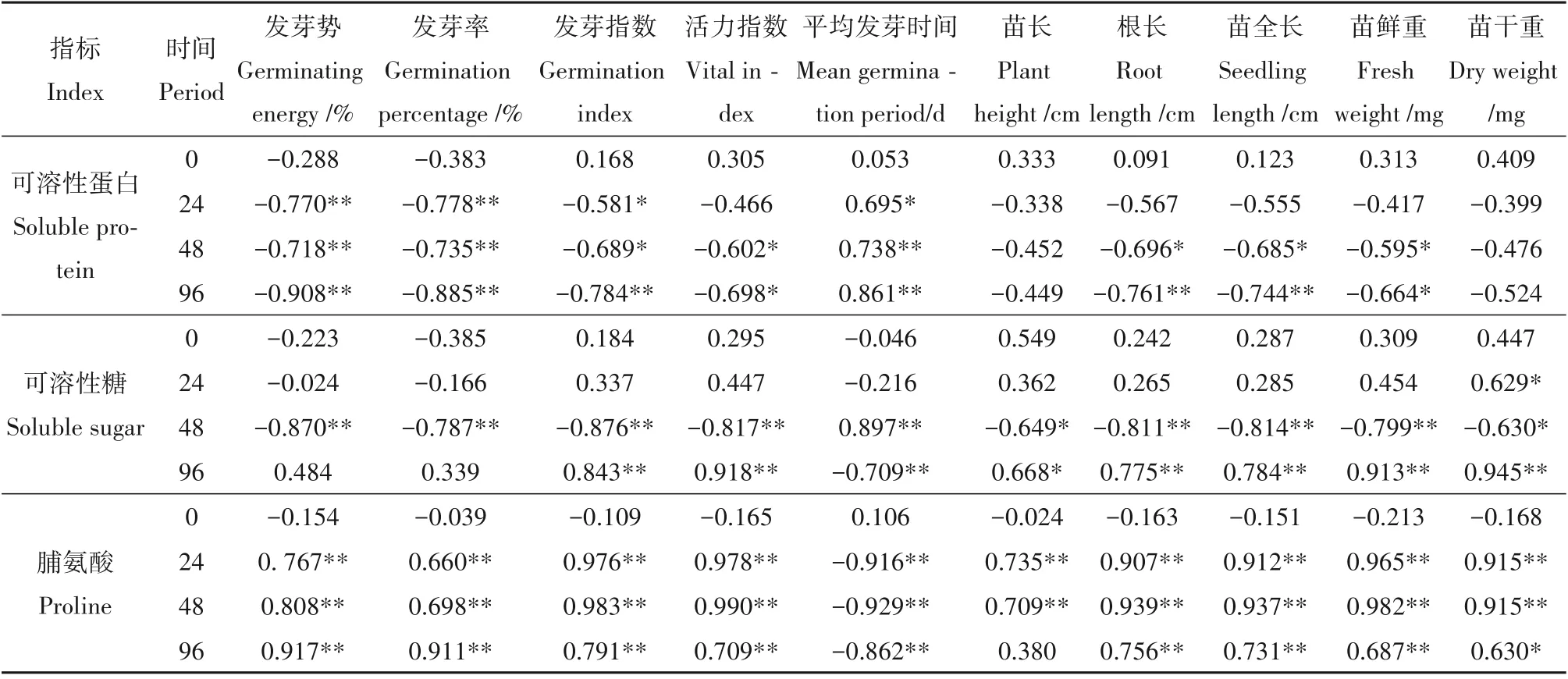
表3 不同时间段能量代谢及渗透调节相关物质与发芽指标间的相关性Table 3 Correlation between energy metabolism and osmotic adjustment related substances and germination indexes at dif⁃ferent time points

图4 不同处理下对油菜种子能量代谢及渗透调节相关指标的影响Fig.4 Effect of different treatments on energy metabolism and osmotic adjustment related indexes of rape seeds
2.5 外源海藻糖浸种对低温胁迫下幼苗养分累积的影响
低温胁迫时,油菜生长与代谢速度减慢,养分累积量下降。通过比较不同处理下油菜幼苗中氮磷钾含量和累积量发现(图5),低温胁迫时,LT(低温空白)与NT(常温空白)相比,氮、磷、钾含量分别下降38.94%、39.17%、81.83%;氮、磷、钾累积量也分别降低75.60%、75.76%、92.74%,其中低温对钾元素的影响最大。
外源施用海藻糖对油菜植株的氮、磷、钾含量与累积量有一定的影响,与LT(低温空白)相比,T10处理下油菜氮、磷、钾含量增加,分别提高9.02%、11.94%、19.37%;而T10 处理下油菜氮、磷、钾累积量也分别提升了1.9%、3.5%和10.67%。综上所述,T10 处理的植株氮、磷、钾含量与累积量均呈现出上升的趋势,外源添加10 mmol/L 海藻糖对低温胁迫下油菜幼苗养分含量的影响较为显著,而对幼苗养分的累积量也有一定的促进作用(图5)。

图5 不同处理对油菜幼苗养分含量及累积量的影响Fig.5 Effect of different treatments on nutrient(N,P,K)contents and accumulation of rape seedlings
3 讨论
温度是影响植物生长发育的重要因素之一。在全球气候整体变暖的情况下,初霜与末霜的日期变化加大并且变得不易预测,区域性的低温冷害活动增加[23]。在面临低温胁迫时,种子作为生命起点,对低温环境最为敏感[24],不适宜的低温环境将延长萌发时间,影响发芽率和幼苗活力,以至于使幼苗产生低温损伤,最终直接导致减产[25]。本试验通过测定油菜种子发芽势、发芽率、发芽指数、活力指数、平均发芽时间及幼苗苗长、根长、干鲜重等指标,明确了低温胁迫(10±1)℃显著抑制油菜种子萌发及幼苗生长,影响了油菜壮苗基础,这与前人研究报道一致[26]。
海藻糖作为植物适应非生物胁迫的应激代谢产物,可以帮助植物在逆境环境中保护细胞完整性,因此被广泛应用于植物抗逆研究[27]。本研究结果表明,油菜面临低温胁迫时,10~15 mmol/L海藻糖浸种可以显著提升油菜种子发芽势、发芽率、发芽指数及活力指数,缩短平均发芽时间,并且以10 mmol/L海藻糖处理效果最优,浓度过高(25 mmol/L)效果反而下降。这可能由于高浓度的海藻糖造成植物根系细胞脱水情况加剧,不利于其正常的生理活动。这与谢东微等人[10]研究结果相似,10 mmol/L海藻糖处理的东农冬麦1 号分蘖结相对含水量、脯氨酸含量、可溶性糖含量及返青率相对较高,MDA含量降低,表明外源施加一定浓度的海藻糖可以提高冬小麦抗低温能力。
前人研究表明,在油菜萌发与成苗阶段,低温胁迫会造成油菜种子萌发率降低,油菜幼苗根苗比降低,说明在这个阶段,低温主要抑制了根的发育;而在成苗阶段遭遇低温胁迫,则会造成根苗比偏大,说明在成苗阶段,低温对苗的影响更大[28]。油菜幼苗遭遇低温胁迫,其干鲜重均下降,但是干鲜比却普遍高于正常幼苗,这表明油菜幼苗在低温下,植株出现脱水状况,呼吸作用减弱,营养吸收减慢[29]。植物根系不仅为植物提供养分及水分,同时也参与各类物质的转化与合成,植物根系生长发育水平直接决定了植株个体的生长发育、品质含量。低温会导致植株根系活力降低,造成其生长缓慢甚至停止生长。本试验通过对低温胁迫下海藻糖浸种后种子萌发指标和幼苗地上部长、主根长、干鲜重等指标进行检测,发现10 mmol/L 海藻糖浸种处理可以显著增加油菜种子萌发各项指标,降低平均萌发时间,显著增加幼苗主根长及其鲜重,减弱低温胁迫对油菜幼苗的伤害。
异柠檬酸裂解酶(ICL)作为油菜种子进行乙醛酸循环的一种关键酶,其在种子萌发过程中,可以将脂肪转换为碳水化合物[30]。龚动庭等人研究证明在种子萌发过程中ICL 随着浸种时间延长呈现出先上升后下降的趋势,低温会造成油菜ICL 活性始终保持在较低水平,其活性与种子萌发指标具有较高的相关性[31]。在本研究中,低温胁迫确实造成油菜ICL 保持在一个较低的水平,但浸种处理后,ICL 酶活性会有一个小幅度的降低,之后活性缓慢提高。10 mmol/L 海藻糖浸种处理后的48 h 后可以显著提升油菜种子ICL活性。
根据上述研究表明,面临低温胁迫时,油菜种子能量代谢速度减缓,其中可溶性糖、可溶性蛋白消耗量减少,脯氨酸累积量受到抑制。脯氨酸主要用于调节细胞质内渗,降低凝固点,可以有效防止细胞脱水,稳定细胞结构。10 mmol/L海藻糖处理可以显著增加种子萌发过程中可溶性糖及可溶性蛋白的消耗,增加脯氨酸累积,提高幼苗抗寒性。该研究结果与张曼[18]等人研究H2O2浸种对低温胁迫下油菜种子萌发的影响结果相似,30% H2O2浸种8 h可以显著增加萌发过程中对淀粉、可溶性糖、可溶性蛋白的消耗量,增加脯氨酸的累积量。低温环境下,海藻糖处理可以帮助种子萌发中所需物质的顺利分解和利用,增加脯氨酸累积,提高抗冷能力,促进其低温萌发。
从本研究结果可以进一步看出,低温胁迫很大程度上抑制了植株对氮、磷、钾的吸收。而外源海藻糖处理可以显著增加低温胁迫下油菜植株养分含量。氮元素不仅是植物体内蛋白质、核酸以及叶绿素的重要组成部分,而且也是植物体内多种酶的组成部分。磷元素则是植物体内许多重要有机化合物的成分,并参与植物体内的生理、生化反应,对植物生长发育及新陈代谢均有重要作用[32]。钾元素可以促进植株叶片水分保存,减少细胞中离子及水分的外渗,从而提高植物的抗性。在面临低温胁迫时,低钾植株细胞质膜通透性增大,生理代谢速率减慢,易受到低温冷害;而高钾植株则能使原生质胶体保持较高的水化度和粘滞性,保证植株的正常生理活动[33]。因此,外源海藻糖处理可通过增加低温胁迫下油菜植株养分含量,增强植株渗透调节能力、抗氧化能力,进而降低植株受到的伤害。
4 结论
综上所述,当油菜种子萌发面临低温胁迫时,相关酶活受抑制,阻碍营养物质的分解,减少了萌发可利用的物质和能量来源,造成种子萌发受阻,萌发时间延长,幼苗长势弱,主根短小。10 mmol/L海藻糖浸种处理24 h 则可有效提高酶活,促进贮藏物质分解,提高抗氧化脯氨酸含量的累积,提高种子萌发过程中可以直接利用物质的含量,促进其在低温下的萌发及幼苗根系生长,一定程度上提升养分含量及累积量。因此,可以在油菜迟播的情况下,应用10mmol/L 的海藻糖溶液进行浸种处理,可提高其种子萌发效果及幼苗抗冷能力。
