臭氧催化氧化处理造纸厂二级生物处理出水
2022-05-13贺万里武书彬万金泉
贺万里 武书彬,2,* 万金泉,3
(1.华南理工大学轻工科学与工程学院,制浆造纸工程国家重点实验室,广东广州,510640;2.华南理工大学轻工与食品国家级实验教学示范中心,广东广州,510640;3.华南理工大学环境与能源学院,广东广州,510640)
随着我国经济的高速发展,企业用水不断增加,国家加强了对企业取水权的管理,也提高了用水价格。与此同时,国家出台了《水污染防治行动计划(水十条)》《控制污染物排放许可制实施方案》《关于实施工业污染源全面达标排放计划的通知》《中华人民共和国水污染防治法修正案(草案)》等政策法规[1],对企业水排放的要求更高。2005年,国家颁布《中国节水技术政策大纲》提出,发展外排废水回用和“零排放”[2],因此,部分造纸厂正在采用零液体排放技术,即封闭水循环,以最大限度地减少用水量,这会导致水中污染物的持续积累[3],积累的污染物必须得到有效处理,才能达到废水回用或排放的行业标准。虽然可以采用沉淀法、气浮法、混凝沉淀法、膜法、吸附法等物理方法去除造纸废水中的污染物,但化学氧化法因操作简便、效率高等优点而被广泛应用[4]。
臭氧具有极强的氧化性,可以与许多有机物或官能团发生反应,从而有效地降解废水中的有机污染物。臭氧氧化技术具有反应速率快、占地面积小、无二次污染、污泥产生量较少[5-6]等优点,但单一的臭氧氧化处理也存在局限性,如在处理不同有机物时具有选择性以及不能将有机物彻底分解为CO2和H2O,所以臭氧氧化技术通常会与其他技术联用[7],如UVO3耦合氧化技术[8-9]、催化臭氧氧化技术[10-11]、O3/H2O2高级氧化技术[12-13]、O3/UV/ZnO复合光催化臭氧技术[14]。许钧媛[15]采用“臭氧氧化+芬顿氧化”工艺对造纸厂二沉池出水进行深度处理,经过中试试验,二沉池出水CODCr低于180 mg/L时,采用“臭氧+芬顿”组合工艺处理,最终出水CODCr低于50 mg/L。王伟等[16]采用臭氧氧化和膜的组合工艺实现了造纸厂尾水回用。庄海峰等[17]采用农业废弃物水稻秸秆制备秸秆基活性炭,将其负载过渡金属Mn和Fe作为臭氧催化剂,对浙江省某造纸厂二级处理出水进行处理后,CODCr平均去除率为74.3%,色度降低80.5%。
通过臭氧氧化技术处理,目前很多制浆造纸厂排放废水可达到《制浆造纸工业水污染物排放标准》(GB 3544—2008)的要求。为进一步提高企业节水水平及降低吨纸废水排放量,需考虑更深层次的水循环利用,即将车间排放的废水经过深度处理,去除特征污染物,达到回用水要求(CODCr≤50 mg/L,电导率≤1200μS/cm,固体悬浮物≤16 mg/L)后,代替部分清水回用至车间,从而进一步实现水资源循环利用率的提高及污染物的减排[18]。寻找行之有效的催化剂,促进臭氧产生·OH,形成高级氧化机制,增强臭氧处理的普适性以及彻底性,是科研工作者近年来研究的重点。而且,臭氧催化氧化反应pH值范围宽、废水处理后可以达到回用要求、无后续危险废弃物处理而导致成本增加等优势,具有很强的实用性。
本实验利用臭氧氧化法对造纸厂二级生物处理出水进行深度处理,在此基础上探究以不同金属盐为前驱体、掺氮活性炭(AC)为载体的催化剂的臭氧催化氧化技术对造纸废水的处理效果。在实验中,为了提高臭氧的利用率,采用以下几种方式:①改进装置,使废水以连续循环模式在装置中运转,使臭氧与造纸废水充分接触;②采用掺氮活性炭负载催化剂,以促进臭氧分解生成氧化性很强的·OH。
1 实验
1.1 实验原料
实验用废水取自广东省某造纸厂二级生物处理出水。废水CODCr为81.27 mg/L,色度为40 C.U.,pH值为7.01~7.65,固体悬浮物(SS)含量为10 mg/L,电导率(EC)为2060μS/cm。
实验用木质素磺酸钠取自山东日照造纸厂。
1.2 实验试剂
盐酸(HCl,36.0%~38.0%)、硝酸镍(Ni(NO3)2·6H2O)、硝酸镁(Mg(NO3)2·6H2O)、硝酸铜(Cu(NO3)2·3H2O),购于广州化学试剂厂;氢氧化钠(NaOH)、硝酸铁(Fe(NO3)3·9H2O)、硝酸锰(Mn(NO3)2,50%),购于福晨(天津)化学试剂有限公司;尿素(CH4N2O),购于天津市大茂化学试剂厂;碘化钾(KI),购于天津市北辰方正试剂厂;氢氧化钾(KOH),购于上海润捷化学试剂有限公司。以上药品均为分析纯;实验用水均为实验室自制超纯水。
1.3 实验仪器
臭氧发生器(CF-G-3-10g,青岛国林环保科技股份有限公司),数字式蠕动泵(Masterflex L/S 7523-80,美国Masterflex公司),泵头(77200-60,美国Masterflex公司),水质检测笔(TDS-pH-EC,美国爱诗普霖公司),紫外分光光度计(DR6000,美国哈希公司),消解仪(DRB200,美国哈希公司),开启式管式炉(30165-1,杭州蓝天化验仪器厂),扫描电子显微镜-能谱仪(SEM-EDS,Sigma300-smartedx,德国蔡司公司),X射线衍射仪(XRD,SmartLab 9 kW,日本理学公司),X射线光电子能谱仪(XPS,K-Alpha,美国塞默飞公司)。
1.4 实验方法
1.4.1 臭氧氧化反应
取500 mL废水样置于1000 mL玻璃瓶中,利用蠕动泵使废水样定量通过进水口而进入玻璃管中,然后经出水口流回至玻璃瓶,形成循环体系。O3/O2混合气体通过进气口导入玻璃管中,经曝气头曝气后可使O3/O2混合气体充分分散在废水中,未溶解或溶出的O3/O2混合气体顺着出气口流入KI溶液中被充分吸收[4]。臭氧氧化反应装置及工艺流程见图1。

图1 臭氧氧化反应装置及工艺流程Fig.1 Reaction deviceand processof ozoneoxidation
1.4.2 水质指标的检测
水样pH值、EC值、SS含量分别按照GB 6920—1986《水质pH值的测定 玻璃电极法》、GB 6908—2008《水质电导率的测定电导仪法》及GB 11901—1989《水质悬浮物的测定重量法》测定;色度按照GB 11903—1989《水质色度的测定铂钴比色法》和APHA铂钴标准法测定;CODCr按照HJ 828—2017《水质化学需氧量的测定重铬酸盐法》测定。
1.4.3 掺氮活性炭负载催化剂的制备
掺氮活性炭的制备分为炭化、掺氮改性以及活化3个过程:木质素磺酸钠在电热恒温鼓风干燥箱内于105℃烘至绝干,然后移至刚玉方舟中,与刚玉方舟一同放入管式炉中于500℃炭化1 h;按质量比1∶3称取炭化后的木质素磺酸钠与KOH,加入适量水搅拌12 h后,再加入与炭化后的木质素磺酸钠同等质量的尿素,继续搅拌2 h,于105℃下干燥并研磨,然后置于管式炉中850℃下活化1 h。采用1 mol/L的稀盐酸溶液浸渍活化后的木质素磺酸钠12 h后,用超纯水洗至中性并于105℃下烘干。
分 别 以Ni(NO3)2·6H2O、Mg(NO3)2·6H2O、Fe(NO3)3·9H2O、Mn(NO3)2、Cu(NO3)2·3H2O等金属盐为前驱体、掺氮活性炭为载体,采用浸渍法制备了前驱体金属元素质量百分比为10%[19]的5种催化剂。具体工艺为:配制不同的硝酸盐溶液,加入制备好的掺氮活性炭,浸渍搅拌4 h,超声2 h,置于105℃烘箱中干燥,最后在管式炉中于500℃煅烧3 h,冷却后备用。在整个制备过程中,管式炉采用高纯氩为保护气且其流速均为300~400 mL/min、管式炉升温速率均为10℃/min。
1.4.4 催化剂表征
SEM-EDS分析:采用SEM对催化剂进行形貌和结构测定,同时使用EDS测定催化剂表面主要元素分布。
XRD分析:测定催化剂物相组成,采用Cu靶,扫描角度2θ=5°~90°,扫描速率2°/min。
XPS分析:测定催化剂表面的化学组成和各元素的化学价态,采用Al靶,Kα射线。
2 结果与讨论
2.1 臭氧氧化工艺优化研究
2.1.1 臭氧发生量对臭氧氧化效果的影响
在反应时间30 min、废水循环速率400 mL/min、温度为室温(18.5℃)、pH值为原废水pH值的条件下,探讨了臭氧发生量对臭氧氧化效果的影响,结果如图2所示。

图2 臭氧发生量对臭氧氧化效果的影响Fig.2 Effect of ozone intake on ozone oxidation
由图2可知,当臭氧发生量为3 g/h,废水CODCr去除率相较臭氧发生量为0、1 g/h时的CODCr去除率显著提高,继续增大臭氧发生量,废水CODCr去除率增长速率减缓。这可能是因为:①初始时废水中不含臭氧,因此臭氧会因为浓度差而渗入液相中;臭氧发生量增加后,液相中的臭氧浓度也不断增加,随后废水中的臭氧逐渐饱和,使得废水中的CODCr去除率增长速率开始减缓;②造纸废水中的有机污染物多数难以降解[20],即使增加臭氧发生量至5和7 g/h时,产生的·OH很难在短时间内迅速将大分子有机污染物降解为小分子化合物或者完全矿化。臭氧发生量为3~7 g/h,废水的CODCr去除率为70%~80%。
随着臭氧发生量的增加,废水色度明显降低,这主要是由于臭氧氧化破坏了废水中有机污染物分子显色基团的不饱和化学键,减少了废水中的显色反应[21]。臭氧发生量为3 g/h时,废水色度远低于国家排放标准。
综合考虑安全因素、工厂运行成本以及去除效果,选定臭氧发生量为3 g/h进行后续实验。臭氧发生量3 g/h对应的臭氧浓度约为35~40 mg/L。
2.1.2 反应时间对臭氧氧化效果的影响
在臭氧发生量3 g/h、废水循环速率400 mL/min、温度为室温(15.2℃)、pH值为原废水pH值的条件下,探讨了反应时间对臭氧氧化效果的影响,实验从废水第一次循环起开始计时,结果如图3所示。

图3 反应时间对臭氧氧化效果的影响Fig.3 Effect of reaction time on ozone oxidation
由图3可知,随着反应时间的延长,造纸废水的色度整体呈下降趋势,CODCr去除率整体呈上升趋势,这基本符合实验预期。进一步分析发现,反应过程中CODCr去除率的增长速率呈先快速增长后缓慢增长的趋势。根据化学反应动力学原理,反应速率与底物浓度直接相关,本研究中反应底物是溶于水的臭氧及其活化产物·OH和有机污染物,当臭氧饱和时,影响反应速率的因素是可与臭氧及其活化产物·OH反应的有机污染物浓度,随着反应时间延长,该部分有机污染物浓度逐渐降低,因此反应速率相比实验初始阶段有所减缓。
废水色度随反应时间的延长明显降低,这主要是因为延长反应时间可使废水中的不饱和有机污染物充分降解,减少了废水中的显色反应。
反应时间为40~60 min时,废水色度低于10 C.U.,CODCr去除率稳定在60%~70%。因此,确定反应时间为40 min进行后续实验。
2.1.3 反应温度对臭氧氧化效果的影响
臭氧氧化反应一般在室温下进行,但对于工厂而言,冬季与夏季的温差比较明显,因此将反应温度作为变量。由于臭氧的不稳定性和选择性,在过低或过高温度下,臭氧不易分解为·OH,难以去除废水中难降解的有机污染物[21]。在臭氧发生量3 g/h、反应时间40 min、废水循环速率400 mL/min、pH值为原废水pH值的条件下,根据南方地区的冬季与夏季温度设定反应温度为10、20、30、40、50℃,以探究反应温度对臭氧氧化效果的影响,结果如图4所示。

图4 反应温度对臭氧氧化效果的影响Fig.4 Effect of reaction temperatureon ozoneoxidation
由图4可知,随着反应温度的升高,CODCr去除率的增长速率呈先快速增长后缓慢增长的趋势。根据阿伦尼乌斯方程,在臭氧与废水中有机污染物的反应中,升高反应温度可以提高化学反应速率,所以CODCr去除率上升较快;但是继续升高温度,臭氧的分解速率将加快,溶解度会降低,从而降低了反应体系中臭氧的有效浓度,一定程度上减缓了化学反应速率,所以在温度较高时CODCr去除率的增长速率会减缓。同时,由于臭氧氧化有机污染物的反应属于链式反应,在降解有机污染物的同时也会对其氧化反应过程中所产生的中间产物进行深度氧化,消耗废水中的臭氧,从而减缓了目标有机污染物的降解速率[22],使得CODCr去除率的增长速率减缓。废水在室温下可达20~40℃,通过臭氧氧化技术可使CODCr去除率基本稳定在80%及以上。50℃时的CODCr去除率高达90.0%,但即使地处广东省,废水也很难达到此温度,需额外消耗能源,故不宜选用50℃为反应温度。
废水色度随反应温度的升高呈波动状态,这是因为在某一温度下,臭氧降解有机污染物的同时产生了具有发色基团的中间产物,且中间产物在该温度下不能够进一步分解,从而导致废水色度有所上升。在20~40℃时,通过臭氧氧化技术可使废水色度维持在10 C.U.以下。
综上所述,选定反应温度40℃进行后续实验,在实际处理废水过程中无需调节温度。
2.1.4 废水pH值对臭氧氧化效果的影响
不同pH值下,臭氧氧化处理废水的机理也不同。在臭氧发生量3 g/h、反应时间40 min、废水循环速率400 mL/min、反应温度为40℃条件下,探讨废水pH值对臭氧氧化效果的影响,结果如图5所示。
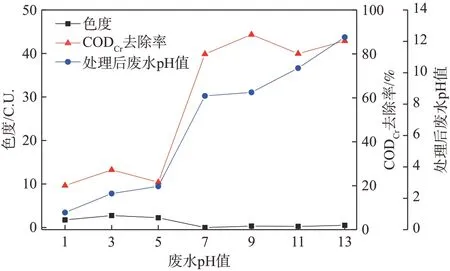
图5 废水pH值对臭氧氧化效果的影响Fig.5 Effect of pH value on ozone oxidation
由图5可知,废水pH值<7时,臭氧氧化处理后色度低,但CODCr去除率偏低,不符合废水回用或排放要求;废水pH值=7时,臭氧氧化处理后色度接近于0,CODCr去除率达79.9%,且处理后废水pH值为8.5,均符合《制浆造纸工业水污染物排放标准》(GB 3544—2008)中的要求;废水pH值>7时,臭氧氧化处理后色度更低,CODCr去除率较高,其中pH值为9时,经臭氧氧化处理后废水pH值(6~9)达到国家排放标准,但是pH调节剂会引入Na+,从而提高废水的EC值。
当废水pH值<4时,臭氧在水溶液中的分解可忽略不计,其反应主要是溶解于废水中的臭氧分子与废水中还原性物质的直接反应;当废水pH值>6时,臭氧氧化主要是以间接反应为主,根据臭氧活化反应方程式可知:
该反应中臭氧进行分解反应,生成氧化性很强的·OH,其可以无选择性地将废水中的大部分有机污染物氧化,臭氧在废水中的分解速率随着其pH值的提高而加快[23]。所以在中性及碱性环境下,废水中的有机污染物可很好地被臭氧氧化,这与实验结果相符。
综上所述,原废水的pH值在7~8波动,呈弱碱性,臭氧氧化处理效果好且不会引入其他离子,所以选定原废水的pH值进行后续实验。
2.1.5 废水循环速率对臭氧氧化效果的影响
废水循环速率决定了实际处理过程中单位时间内处理的废水量。在臭氧发生量3 g/h、反应时间40 min、反应温度40℃、pH值为原废水pH值的条件下,探讨了废水循环速率对臭氧氧化效果的影响,结果如图6所示。
由图6可知,废水循环速率对废水CODCr去除率影响不大,对色度稍有影响。这可能是因为无论是废水循环速率较慢时通过延长臭氧与废水的接触时间使得更多臭氧溶于废水中,还是循环速率较快时通过废水的循环次数从而溶解更多臭氧,这两者导致的结果是单位废水中臭氧的溶解量相近,使得臭氧氧化处理后的效果相近。结合色度、CODCr去除率以及设备维护的考虑,选择废水循环速率为500 mL/min进行后续实验。
2.2 臭氧催化氧化处理工艺研究
2.2.1 不同单金属催化剂催化臭氧氧化处理造纸废水
在最优臭氧氧化工艺条件(臭氧发生量3 g/h、反应时间40 min、反应温度40℃、pH值为原废水pH值及废水循环速率500 mL/min,此工艺条件下废水色度可降至5 C.U.以下,CODCr去除率为86.9%)下,探究不同单金属催化剂催化臭氧氧化处理造纸废水的效果,结果如图7所示。催化剂的投入量为2 g/L[24]。
由图7可知,镍基催化剂(Ni@AC)可使臭氧催化氧化造纸废水的CODCr去除率达91.7%。这是因为Ni@AC可提高臭氧分解速率,生成氧化性更强、非选择性的·OH。单金属催化剂协同臭氧氧化可使造纸废水的CODCr降至很低,远低于国家排放限值,使废水达到回用要求。

图7 不同单金属催化剂催化臭氧氧化的效果Fig.7 Effect of different singlemetal catalysts on ozoneoxidation
2.2.2 单金属催化剂的表征
对Ni@AC进行SEM-EDS表征,结果如图8所示。由图8(a)~图8(d)可知,Ni@AC具有多孔道结构,这是由于:①经KOH活化后的炭材料出现了较多的结构缺陷,表面形成了大量的孔;②炭材料表面的结合水和挥发性杂质被去除,从而形成孔结构[25]。
由图8(e)可知,Ni@AC中的C、O、N、Ni元素在整个结构中均匀分布,证实了金属的高分散性和Ni元素的存在[26],进一步验证了Ni@AC的成功制备。

图8 (a)~(d)Ni@AC在不同放大倍数下的SEM图;(e)Ni@AC的C、N、O、Ni元素EDS面扫描图Fig.8 (a)~(d)SEMimagesof Ni@ACat different magnifications;(e)EDSelement mappingimagesof C、N、O、Niof Ni@AC
为进一步确定产物的化学组分及结构,对Ni@AC进行XPS表征,使用C 1s轨道(284.8 eV)对图谱进行校核并进行了分峰处理,结果如图9所示。由图9可知,在结合能为873.8和856.0 eV处的峰分别对应Ni 2p1/2和Ni 2p3/2轨道,最终产物以Ni2+的形式存在。位于结合能881.8和861.5 eV处的特征峰对应的是Ni 2p的一对卫星峰(Satellite)[27]。
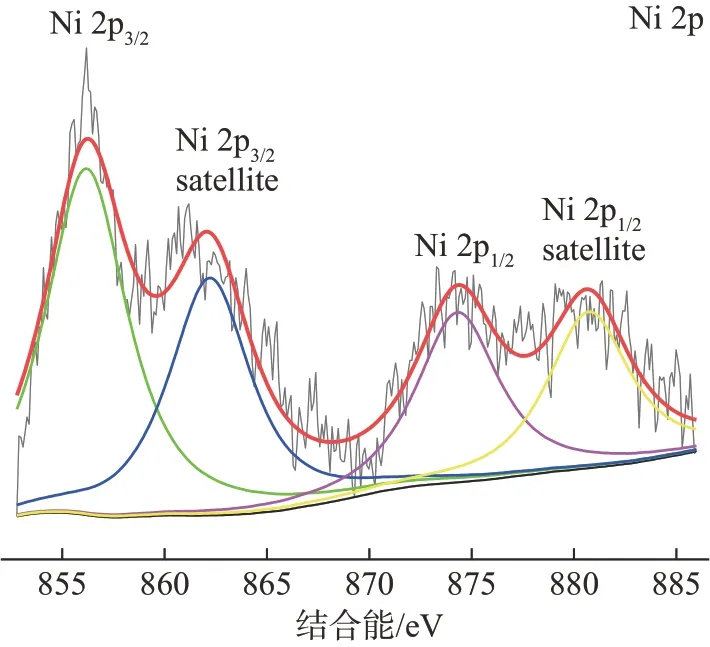
图9 Ni@AC的XPS谱图Fig.9 XPSspectrumof Ni@AC
Ni@AC的XRD谱图如图10所示。由图10可知,在2θ=21.0°和43.0°附近的宽峰归属于碳的(002)和(100)峰[28],表明多孔碳的无定型碳结构[26,29]。在2θ=37.3°、43.4°、63.0°、75.6°和79.6°处的特征峰分别对应NiO晶体的(111)(200)(220)(311)和(222)特征衍射峰[30],PDF标准卡片对应的是NiO(PDF 44-1159)[31]。这也验证了Ni@AC的成功制备,也表明在臭氧催化氧化过程中发挥实际作用的是NiO。

图10 Ni@AC的XRD谱图Fig.10 XRDspectrumof Ni@AC
3 结论
3.1 利用臭氧氧化法对造纸厂二级生物处理出水进行深度处理,采用控制变量法,分别探究臭氧发生量、反应时间、反应温度、废水pH值、废水循环速率对造纸废水CODCr去除率以及色度的影响,并得出最优臭氧氧化工艺:臭氧发生量3 g/h,反应时间40 min,反应温度为40℃,pH值为原废水pH值,废水循环速率为500 mL/min,此工艺条件下处理后废水色度可降至5 C.U.以下,CODCr去除率为86.9%。
3.2 考察了以不同金属盐为前驱体、掺氮活性炭(AC)为载体的催化剂协同臭氧氧化处理造纸废水效果的影响。结果表明,Ni@AC在降解废水CODCr方面尤为突出,去除率高达91.7%。对Ni@AC进行扫描电子显微镜-能谱(SEM-EDS)、X射线衍射(XRD)、X射线光电子能谱(XPS)等表征,结果表明,Ni@AC具有多孔道结构且各元素分布均匀,在催化氧化过程中发挥实际作用的是NiO。
