p H响应性纤维素纳米纤丝/海藻酸钠基水凝胶的制备及其释药性研究
2022-05-13陈甜甜刘婉嫕栾云浩李宇航刘鹏涛刘
陈甜甜 王 聪 刘婉嫕 栾云浩 李宇航 刘鹏涛刘 忠
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
水凝胶是由水溶性或亲水性的高分子通过一定的化学交联或物理交联形成的具有特殊三维网状结构的高分子材料。通过不同的条件控制将刺激响应性的官能团引入到水凝胶结构中,即可制备出pH响应性等适应各类环境变化的智能水凝胶[1-3]。由于对环境的敏感性,智能水凝胶特别是pH响应性水凝胶受到了生物医药领域(如药物载体、人体器官以及组织工程支架等)研究人员的广泛关注[4-7]。pH响应性水凝胶可以根据人体胃部和肠道酸碱度的不同实现对药物的控释缓释行为。如何根据载体材料结构和药物特性选择合适的方法将药物负载到载体上并达到较高的载药量和包封率是目前医药领域研究的热点之一。
纤维素来源广泛(植物纤维、细菌等),是地球上最丰富的天然高分子材料[8]。使用纤维素材料制备的水凝胶可完美地解决合成高分子凝胶难以降解、生物相容性差的难题,因此受到医药领域研究人员的广泛关注[9-10]。其中,纤维素纳米纤丝(cellulose nanofibril,CNF)表面含有大量羟基,可以与药物通过物理或化学的方式相结合;而且CNF的尺寸有助于延迟单核吞噬细胞系统的清除[11-14],并且几乎不存在非特异性细胞摄取[15],是一种非常有应用前景的药物载体材料。
本研究以CNF和海藻酸钠(sodiumalginate,SA)为原料,共混后在CaCl2的交联作用下制备了具有pH响应性的CNF/SA水凝胶。以非甾体抗炎药阿司匹林(aspirin,ASP)为模型药物,通过物理混合的方式成功制备出具有pH响应性的ASP/CNF/SA载药水凝胶,并对其在不同pH值环境中进行了体外药物释放行为的研究。
1 实验
1.1 主要仪器与试剂
热重分析仪(Q 50,美国);紫外-可见分光光度计(UV-2550,日本);扫描电子显微镜(JSMIT300LV,日本);集热式恒温加热磁力搅拌器(DF-101S,中国);超声仪(SB-5200DTDN,中国)。
CNF,机械法制备,白色粉末状,羧基含量接近于0,购自于北方世纪(江苏)纤维素材料有限公司,未经进一步纯化直接使用。
SA(相对分子质量7000~10000)和ASP,上海麦克林生化科技有限公司;CaCl2,国药集团化学试剂有限公司;去离子水,实验室自制。以上所有试剂均为分析纯,未经进一步纯化直接使用。
1.2 CNF/SA水凝胶的制备
称取一定量的SA粉末和CNF粉末并配制成2%的SA和2%的CNF悬浮液。按干燥态质量CNF∶SA=2∶1的比例将上述液体于50℃下搅拌1 h,使其充分混合均匀后倒入模具中,用3.0%(w/V)的CaCl2溶液进行交联直至全部形成水凝胶。用去离子水对水凝胶进行反复漂洗,以去除水凝胶中残留的CaCl2。冷冻干燥48 h后,取出样品,密封干燥。
1.3 CNF/SA水凝胶在不同pH值环境中的润胀性能
称量冷冻干燥后的完全干燥状态下的CNF/SA样品质量,记为W0;将样品分别浸入装有pH值=1.5、7.4和11.0的磷酸盐缓冲溶液(PBS)的烧杯中,每隔10 min取出样品,用滤纸迅速吸去样品表面的水分,称量,记为W1。此过程于恒温恒湿箱中进行测定,设置温度为37℃,湿度为60%。采用式(1)计算得到润胀率[16]。

1.4 ASP/CNF/SA载药水凝胶的制备
按照干燥态质量CNF∶SA=2∶1的比例将2%的SA和2%的CNF悬浮液混合,加热至50℃后搅拌1 h。停止加热,加入0.4 g的ASP后继续搅拌1 h,使其充分混合均匀。用超声仪超声处理15 min以去除混合体系内的气泡后注入模具中,加入3.0%的CaCl2溶液交联,直至溶胶全部形成水凝胶,用去离子水对载药水凝胶中残留的CaCl2溶液进行漂洗,冷冻干燥48 h,取出样品,干燥密封。
1.5 ASP/CNF/SA载药水凝胶的热稳定性测定
采用热重分析仪对ASP、CNF/SA水凝胶和ASP/CNF/SA载药水凝胶的热稳定性进行表征分析。取5~10 mg样品置于氧化铝坩埚内,采用高纯氮气作为载气,调节载气流速为100 mL/min,设置温度范围为40~600℃,升温速率20℃/min。
1.6 ASP/CNF/SA载药水凝胶的微观形貌分析
将ASP/CNF/SA载药水凝胶样品进行干燥后,取小块粘在导电胶上进行喷金处理,利用扫描电子显微镜(SEM)观察ASP/CNF/SA载药水凝胶的微观结构,加速电压设定为12 kV。
1.7 ASP/CNF/SA载药水凝胶的载药量及包封率测定
精密称取10 mg的ASP置于10 mL量瓶中,加入乙醇溶解并稀释至刻度线,摇匀,作为储备液。用移液管分别精密量取0.10、0.20、0.30、0.40和0.50 mL储备液并加入到10 mL量瓶中,加入pH值=7.4的PBS并定容至刻度线,摇匀,在296 nm波长处测定吸光度。以吸光度(A)和质量浓度(c)作线性回归曲线,得回归方程A=23.094c+0.0569(R2=0.9998),说明ASP的质量浓度与其吸光度有良好的线性关系。
称取一定量冷冻干燥后的ASP/CNF/SA样品,用研钵研碎后,将其置于含有50 mL无水乙醇的烧杯中浸泡48 h,使得载药凝胶中的药物完全溶出。离心后取上清液,使用紫外-可见分光光度计测定其吸光度,并根据其回归方程计算药物含量后,用式(2)和式(3)计算ASP/CNF/SA载药水凝胶的载药量和包封率:

1.8 ASP/CNF/SA载药水凝胶的药物体外释放性能
制备不同pH值(1.5、3.0、5.0、6.6、7.4、8.2、9.0和11.0)的PBS作为药物的体外缓释溶液。ASP在缓释过程中发生水解产生水杨酸。用紫外-可见分光光度计在304 nm波长处测定水杨酸吸光度,并对不同pH值PBS中的水杨酸吸光度(A)和质量浓度(c)作线性回归方程。
称取适量ASP/CNF/SA载药水凝胶放入透析袋中,将其置于盛有不同pH值PBS的锥形瓶中,37℃下恒温震荡48 h。每隔2 h使用移液枪取出5 mL混合溶液,同时用等量新的PBS补充至原溶液的量。通过紫外-可见分光光度计于304 nm波长处对缓释过程中收集的溶液的药物浓度进行测定,每个样品的测定结果均由3个平行实验的结果平均得到。
1.9 ASP/CNF/SA载药水凝胶的药物释放动力学
释药过程由药物分子的自由扩散及基质材料自身的降解溶蚀行为所共同控制。Korsmeyer-Peppas模型是一种用于表征药物累积释放速率和释放时间的经验模型,可根据其释放指数确定药物分子的释放机制。因此,为了确定ASP/CNF/SA载药水凝胶药物释放过程由哪种行为所主导,实验选用Korsmeyer-Peppas模型(如式(4)所示)分析药物的释放过程。

其中,t为药物释放时间;Mt为t时间的累积释放量,mg;Mn为整个药物释放过程中的最大药物释放量,mg;k和n为释放常数和释放指数。
为了考察该体系的药物释放是否符合指数定律,通常将式(4)进行变形以得到式(5)和式(6)。

用Korsmeyer-Peppas模型对不同pH值条件下的前10 h的药物释放过程进行分析,并对数据进行线性拟合,以确定合适的药物释放机制。若拟合结果为线性,则表明ASP/CNF/SA载药水凝胶的药物释放规律符合指数规律。根据释放指数n的值确定药物的释放机制[17-18]。
2 结果与讨论
2.1 CNF/SA水凝胶在不同pH值环境中的润胀行为
CNF/SA水凝胶在不同pH值PBS中的吸水率如图1所示。由图1可知,CNF/SA水凝胶在pH值=1.5的酸性环境下吸水速率最慢,且达到吸水平衡时的最大吸水率仅为其干燥态质量的7倍;随着环境pH值的升高,CNF/SA水凝胶达到吸水平衡时的最大吸水率明显提高,在pH值=6.6和8.2中性条件下的最大吸水率分别为其干燥态质量的14倍和15倍;在pH值=11.0碱性条件下的最大吸水率达到最大,为其干燥态质量的19倍。这说明CNF/SA水凝胶的吸水率明显受到环境酸碱度的影响,这可能是因为在酸性条件下,H+导致CNF/SA水凝胶发生质子化转变,形成海藻酸盐难溶物,导致了水凝胶体系的吸水率降低。但随着pH值不断升高,去质子化的海藻酸盐分子链中氢键减少而发生静电排斥,从而导致CNF/SA水凝胶的吸水率显著提高[19]。因此,可认为CNF/SA水凝胶在药物的释放行为中具有pH智能响应的潜力。

图1 CNF/SA水凝胶在不同pH值PBS中的吸水率Fig.1 Water absorption ratio of CNF/SA hydrogel in PBS with different pH value
2.2 ASP/CNF/SA载药水凝胶的热稳定性分析
ASP、CNF/SA水凝胶和ASP/CNF/SA载药水凝胶的TG和DTG曲线如图2所示。从图2(a)可以看出,ASP有2个快速热降解阶段。在270℃时出现第1次质量损失,质量损失率为35%。ASP热解时失去CO2和CH2CH2,按此历程热解的理论质量损失率为32.9%[20],这基本与TG曲线的第一阶段质量损失率35%相对应。第2个快速热降解出现在270~420℃之间,分解物持续吸热降解,样品质量快速损失,最终的质量残留量接近于0,这表明ASP的主要降解产物为CO2和水。

图2 ASP、CNF/SA水凝胶和ASP/CNF/SA载药水凝胶的TG和DTG曲线Fig.2 TGand DTGcurvesof ASP,CNF/SA hydrogel,and ASP/CNF/SAdrug-loaded hydrogel
对比CNF/SA水凝胶和ASP/CNF/SA载药水凝胶的TG和DTG曲线可知,CNF/SA水凝胶在220℃时首次出现降解,之后在360℃时达到最大热降解速率。ASP/CNF/SA载药水凝胶在120~160℃之间出现了小幅度的快速热降解,之后持续升温吸热,在220℃时进入第二热降解阶段,该阶段主要是CNF和SA的热解,ASP/CNF/SA载药水凝胶最终的质量残留量(22%)低于CNF/SA水凝胶(25%),这是由载药体系中的ASP受热分解所导致。
2.3 ASP/CNF/SA载药水凝胶的形貌结构分析
图3为ASP/CNF/SA载药水凝胶的光学照片和SEM图。从图3(a)可以看出,样品表面光滑,是一种白色软状凝胶。由图3(b)可知,CNF在ASP/CNF/SA载药水凝胶的表面均匀分布,在离子交联剂的作用和CNF的支撑下,SA在CNF之间形成薄膜状结构。从图3(c)可以看出,ASP/CNF/SA载药水凝胶内部孔隙大小均匀,呈规则的蜂窝状结构。CNF相互缠绕,对内部的SA起到很好的固定支撑作用,使得ASP/CNF/SA载药水凝胶截面SEM图像呈现出一个由SA及CNF互穿交联的复合交联结构。这种连续稳定的多孔结构可有效增大水凝胶材料的比表面积,从而增强水凝胶体系与周围溶液的扩散互动。

图3 ASP/CNF/SA载药水凝胶的照片(a)和SEM图:(b)表面;(c)截面Fig.3 Pictureof ASP/CNF/SA drug-loaded hydrogel(a),and SEMimagesof ASP/CNF/SAdrug-loaded hydrogel:(b)surface,(c)crosssection
2.4 ASP/CNF/SA载药水凝胶的载药量及包封率
用紫外-可见分光光度计在296 nm波长处测定ASP的吸光度。用50 mL无水乙醇充分浸泡0.01 g ASP/CNF/SA载药水凝胶后取其上清液,测定其吸光度为0.952,根据其回归方程A=23.094c+0.0569(R2=0.9998)和式(2)计算得到其载药量为194 mg/g。
用电子天平精确称量0.40 g ASP并与32 g 2%的CNF悬浮液和16 g 2%的SA混合均匀,制得水凝胶后冷冻干燥48 h。精密称量冷冻干燥后样品质量为0.9258 g,根据其载药量可知该载药体系中含有ASP 179.6 mg,根据式(3)计算得到其包封率为49.9%。
2.5 ASP/CNF/SA载药水凝胶的体外释放结果分析
图4为ASP/CNF/SA载药水凝胶中的ASP在不同pH值环境中的缓释结果。其中,图4(a)为ASP在酸性环境中的累积释放率曲线。从图4(a)可以看出,ASP/CNF/SA载药水凝胶的ASP累积释放率随着环境pH值的升高而增加。ASP在0~12 h内迅速释放,在12~20 h内的释放速度较缓慢,在20~24 h内基本达到释药平衡状态。ASP在24 h且pH值=1.5、3.0、5.0和6.6条件下的最大累积释放率分别为59.6%、64.9%、70.3%和76.8%。可见,ASP/CNF/SA载药水凝胶在中性条件下的ASP释放速率明显快于酸性条件下,这可能是由于酸性条件下纤维素分子链间的作用力增大而使CNF产生集聚,导致ASP的扩散和溶蚀作用减慢。
图4(b)所示为ASP/CNF/SA载药水凝胶在碱性条件下的ASP累积释放率曲线。从图4(b)可以看出,ASP/CNF/SA载药水凝胶在碱性条件下的ASP释放速率明显快于中性条件下的;在12 h时,各pH值条件下的ASP累积释放率均已超过60%;随着释放行为的继续进行,在12~24 h内ASP的释放速率明显降低;在24 h达到释药平衡时,ASP/CNF/SA载药水凝胶在pH值=7.4、8.2、9.0和11.0条件下的ASP累积释放率分别为74.2%、89.8%、91.1%和93.1%,明显高于酸性条件下的ASP最大累积释放率。这是因为碱性条件有助于CNF的溶解,加快对ASP/CNF/SA载药水凝胶的溶蚀作用,加快ASP的释放。
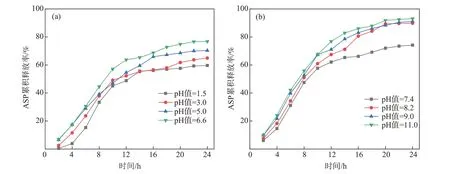
图4 ASP/CNF/SA载药水凝胶在不同pH值环境中的ASP缓释曲线Fig.4 ASPsustained release curves of ASP/CNF/SA drug-loaded hydrogel in different pH value environments
ASP的释放行为表明ASP/CNF/SA载药水凝胶具有明显的pH响应性,能根据释放环境pH值不同而刺激药物的释放,有望被开发成伤口敷料或栓剂。
2.6 ASP/CNF/SA载药水凝胶的药物释放动力学研究
将实验过程中所测得的ASP累积释放量与对应时间分别取对数后进行线性拟合,并根据线性拟合数据得到ASP/CNF/SA载药水凝胶在不同pH值条件下的ASP体外释放拟合曲线(见图5)。从图5可以看出,拟合结果具有良好的线性关系,表1中的拟合方差R2(R2越接近1,表明拟合程度越高)也证实了这一点,表明ASP/CNF/SA载药水凝胶在不同pH值下的ASP释放符合Korsmeyer-Peppas模型。n值大小决定药物的释放机制:当n<0.45时,药物的释放为Fickian扩散;当0.45<n<0.89时,药物的释放为Fickian扩散与溶蚀协同作用;当n>0.89时,药物的释放为溶蚀作用。根据表1中的数据可以看出,ASP/CNF/SA载药水凝胶在pH值=1.5、3.0、5.0、6.6、7.4、8.2、9.0和11.0环境中的ASP释放拟合曲线的n值均大于0.89,说明其ASP的释放均为溶蚀作用。

图5 ASP/CNF/SA载药水凝胶在不同pH值环境中的ASP释放拟合曲线Fig.5 Fittingcurvesof ASPreleaseof ASP/CNF/SA drug-loaded hydrogel in different pH valueenvironments

表1 ASP/CNF/SA载药水凝胶的体外ASP释放动力学参数Table 1 In vitro ASP release kinetic parameters of ASP/CNF/SA drug-loaded hydrogel
3 结 论
3.1 将纤维素纳米纤丝(CNF)和海藻酸钠(SA)共混,然后在CaCl2的交联作用下,制得具有pH响应性的CNF/SA水凝胶,通过物理包裹的方式将阿司匹林(ASP)、CNF和SA三者混合均匀后,在CaCl2的交联作用下制得载药量为194 mg/g、包封率为49.9%的ASP/CNF/SA载药水凝胶。
3.2 扫描电子显微镜分析结果表明,ASP/CNF/SA载药水凝胶内部孔隙大小均匀,呈规则的蜂窝状结构。体外缓释结果显示,ASP/CNF/SA载药水凝胶的药物释放具有pH响应性,药物分子的释放速率随着环境pH值的升高而加快。
3.3 动力学研究结果表明,在pH值为1.5~11.0的缓释条件下,ASP/CNF/SA载药水凝胶的药物释放行为均为溶蚀作用。这种特性使得ASP/CNF/SA载药水凝胶有望被开发为伤口敷料或栓剂。
