miR-153通过戊糖磷酸途径抑制胶质母细胞瘤干细胞增殖研究
2022-05-13邓一帆
邓一帆
【摘要】目的:研究 miR-153通过戊糖磷酸途径抑制胶质母细胞瘤干细胞增殖的情况。方法:从惠州市中心人民医院收集手术切除的胶质母细胞瘤组织样本,原代培养为胶质母细胞瘤干细胞,分为 miR-153组、空白对照组(无意义寡核苷酸链)。分析转染 miR-153对胶质母细胞瘤干细胞增殖、凋亡的影响。结果:转染后1.d、5.d, miR-153组和空白对照组的细胞存活率对比差异不显著(P>0.05);转染后2.d、3.d、4.d, miR-153组的细胞存活率低于空白对照组(P<0.05),其中转染后4.d 出现最小细胞生存率。miR-153组的细胞凋亡率高于空白对照组(P<0.05)。结论:miR-153可以抑制胶质母细胞瘤干细胞增殖,是胶质母细胞瘤治疗的靶点,具有临床应用价值。
【关键词】miR-153;戊糖磷酸途径;胶质母细胞瘤;干细胞;增殖;凋亡
【中图分类号】R739.41【文献标识码】A 【文章编号】2096-5249(2022)05-0038-03
胶质瘤是临床上胶质母细胞瘤(glioblastoma,GBM)的最常見的一种类型,也是四级胶质瘤,同时也是胶质瘤中恶性程度最高的一种。其主要发生在40~60岁的中年人群。脑胶质瘤是中枢神经系统中最常见的原发性肿瘤,而其中过半数是高度恶性的GBM,它的总体预后并不十分理想[1]。目前成人GBM 规范化治疗后的中位生存期仅14.2个月[2]。在GBM中存在广泛的糖代谢改变,其中即包括戊糖磷酸途径(pentose phosphate pathway,PPP)。 PPP为细胞增殖提供物质基础并维持细胞氧化还原状态。在GBM 中, PPP起到促进增殖和侵袭的作用,但其调控机制有待阐明。 miRNAs 是一类内源性非编码单链RNA,在进化上高度保守,长度为22个核苷酸作用,抑制mRNAs翻译或降解靶mRNAs 的途径,主要为与靶mRNAs3’末端非编码区(3’UTR)不完全互补结合,从而在个体发育、细胞增殖、凋亡等生理过程中参与。有研究表明[3],miRNAs 能够对信号通路造成影响,途径为对重要靶基因进行调控,从而将与癌基因或抑癌基因类似的功能发挥出来。胶质瘤等多种肿瘤的发生均和miRNAs 表达异常关系密切。因此, miRNAs 能够将新的认识提供给胶质瘤发病机制与治疗靶点的研究。本研究为阐明miR-153通过PPP 影响 GBM增殖的分子机制,提供GBM治疗的靶点具有临床应用价值,报道如下。
1 材料与方法
1.1主要材料
从惠州市中心人民医院收集手术切除的 GBM 组织样本,原代培养为GBM干细胞,所有患者均为首诊首治。购买美国 Invitrogen 公司生产的细胞培养所需试剂、 DMEM高糖培养基、美国 Abcam 公司生产的抗体、日本Dojindo公司生产的 CCK-8、美国BD 公司生产的 Annexin V-FITC。
1.2方法
1.2.1 GBM干细胞的培养
收集GBM组织,剪碎,消化后吹打成单细胞悬液。过滤、离心,在干细胞培养基中将细胞重悬,干细胞培养基包含4μg/L 肝素+20μg/L 表皮细胞生长因子+20μg/L 成纤维细胞生长因子+10μg/L 白血病抑制因子+1∶50B27添加剂+1∶100双抗+Neurobasal 培养基。在37℃、5%二氧化碳细胞孵箱中放置培养,用 DMEM高糖培养基(含10%胎牛血清)对细胞分化进行诱导。并分为 miR-153组、空白对照组(无意义寡核苷酸链)。
1.2.2 GBM干细胞的鉴定
免疫荧光染色对分选后细胞巢蛋白(nestin)、CD133表达进行检测,用DMEM高糖培养基(含10%胎牛血清)对细胞分化进行诱导。免疫荧光染色对神经元标志物微管相关蛋白2(microtubule-associated protein 2, MAP2)、分化星形胶质细胞标志物神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达进行检测,即用40 g/L 多聚甲醛将细胞固定下来,漂洗后将0.4%Triton X-100加入。将1∶500鼠抗人MAP2单克隆抗体、1∶200鼠抗人巢蛋白单克隆抗体、1∶5000兔抗人GFAP 单克隆抗体、1∶200兔抗人CD133多克隆抗体一抗加入后,将1:200羊抗兔IgG(Alexa fluor488标记)、1∶300羊抗鼠IgG(Alexa fluor 594)荧光二抗加入,充分混合后对细胞核进行DAPI 染色。
1.2.3 miR-153对GBM干细胞增殖的影响
构建TTN-AS1的野生型、突变型荧光素酶表达载体,合成miR-153拟似物,通过荧光素酶实验验证 TTN-AS1与miR-153的结合作用和结合位点。构建过表达和表达沉默TTN-AS1的GBMCs,检测miR-153表达水平变化。过表达或沉默TTN-AS1后,检测PPP 相关分子的表达变化,包括G6PD、NADPH/NADP+、 GSH/GSSG、ROS、R5P。检测过表达或沉默TTN-AS1后, GBMCs增殖、线粒体膜电位、细胞凋亡水平、 DNA 合成情况的变化。构建G6PD 的3’UTR 野生型、突变型荧光素酶表达载体,通过荧光素酶实验验证 miR-153与G6PD的结合作用和结合位点。过表达或沉默miR-153后,检测PPP相关分子的表达变化,包括G6PD、 NADPH/NADP+、GSH/GSSG、ROS、R5P。检测过表达或沉默miR-153后, GBMCs增殖、线粒体膜电位、细胞凋亡水平、DNA 合成情况的变化。运用CCK-8法检测,转染后1d、2 d、3 d、4 d、5 d分别将CCK-8液加入miR-153组、空白对照组细胞中作用4 h,采用BIO-EEK 酶标仪在450 nm处对各培养孔的吸光度(A)值进行测定,依据A值对细胞增殖情况进行判断。
1.2.4细胞凋亡检测
转染后3 d将 Annexin V-FITC 加入 miR-153组、空白对照組细胞中,采用流式细胞仪检测,采用 Cell Quest 3.3分析软件分析数据。
1.3统计学分析
采用 SPSS 21.0软件进行数据处理。计数资料用[ n(%)]表示,用χ2检验;计量资料用(±s)表示,用 t 检验。以 P<0.05为差异有统计学意义。
2 结果
2.1 miR-153对GBM干细胞增殖的影响
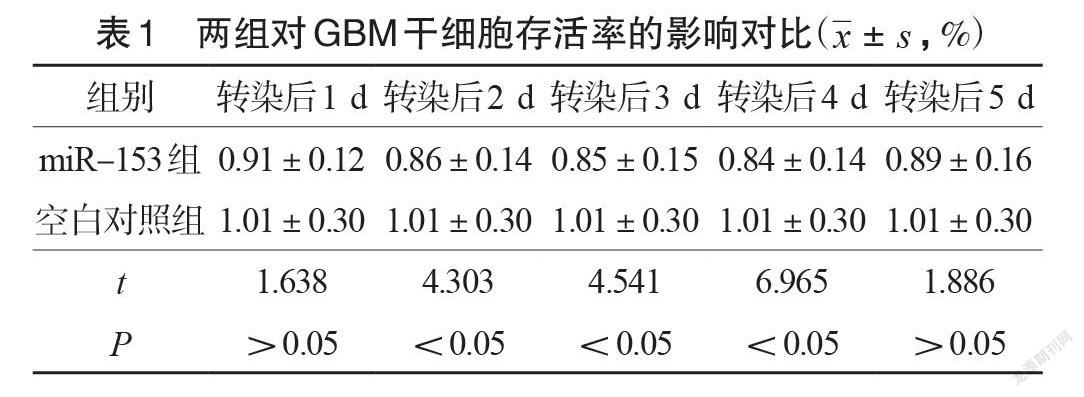
转染后1 d、5 d,miR-153组和空白对照组的细胞存活率对比差异不显著(P>0.05);转染后2 d、3 d、4 d, miR-153组的细胞存活率低于空白对照组(P<0.05),其中转染后4 d 出现最小细胞生存率,见表1。
2.2 miR-153对GBM干细胞凋亡的影响
进行流式细胞检测发现, miR-153组的细胞凋亡率高于空白对照组[(9.40±1.97)%比(4.27±0.30)%, t=4.000,P=0.024]。
3 讨论
GBM是胶质瘤中级别最高的一种类型。胶质瘤在世界卫生组织中被分为4个级别,Ⅰ级和Ⅱ级的胶质瘤属于偏良性的胶质瘤,也是较低级别的胶质瘤;Ⅲ级和Ⅳ级的胶质瘤属于偏恶性的胶质瘤,临床称为高级别的胶质瘤。Ⅳ级胶质瘤即 GBM,可分为原发性和继发性。原发性 GBM。属于Ⅳ级胶质瘤,术后可能较快复发,二次切除后预后也不佳。继发性GBM 是Ⅱ级或Ⅲ级胶质瘤,经过一次手术后再次复发,但继发性 GBM可能复发的间隔时间稍长,预后比原发性GBM 稍好。所以,针对不同类型的GBM,预后不同。
GBM早期可能没有任何症状,但随着肿瘤的生长,会产生相应的症状,可以分为两类。(1)不同部位的 GBM产生不同的症状,如偏瘫、感觉麻木、癫痫、患者智力的改变等。(2)肿瘤长得比较大时,可能会引起颅内压增高的症状。 GBM是一种恶性胶质瘤,它是在 WHO 分级里面属于最恶性的肿瘤之一。目前针对 GBM 的治疗原则还是以手术为主,放化疗为辅的一个原则。 GBM 目前还是神经外科难以攻克的一种肿瘤,因为其是最恶性的肿瘤。之所以综合治疗是因为任何一个单独的治疗都不能达到一个很好的效果,所以综合治疗就是手术为主,辅助的放疗和化疗,愈后相比较其他肿瘤差。从目前来看,其生存期大概14个月多一点。最近几年来,越来越多的研究表明,肿瘤干细胞在肿瘤的发生、侵袭、转移、复发和对治疗的抵抗中发挥着重要作用[4]。正因为如此,肿瘤干细胞是非常好的抗肿瘤治疗靶标。 GBM 干细胞被不同的研究团队分离出来,它们具有干细胞特性,包括自我更新和多向分化能力。与此同时,它们还具有很强的肿瘤形成能力和更强的对化疗放疗的抵抗能力[5]。
microRNAs(miRNAs)是一类小单链RNA分子,非编码,内源性,长度为12~25个核苷酸,虽然由转录而来,但是并不对蛋白进行编码,而是通过不完全互补结合同源mRNA、序列特异性的方式对mRNA 进一步翻译蛋白合成进行抑制或剪切降解mRNA。生物信息学手段证实,每个miRNA 可对上百个靶基因进行调控,而这些受控基因在所有信号通路广泛分布,好多个 miRNA 也调控着1个靶基因,从而促进复杂的miRNA
信息网络的形成。在癌症等很多生理调节与发病过程中,该类分子均发挥着极为重要的作用。有研究表明[6],很多miRNAs 和人类各种恶性肿瘤的发病机理关系密切,患者预后和特殊的miRNAs 表达量特异性相关。在中枢神经系统肿瘤中,胶质瘤最为常见,其是一种恶性肿瘤,患者具有较差的预后,原因主要为肿瘤的浸润性生长速度快,临床无法将肿瘤完全切除。胶质瘤本身的异质性导致其对临床药物具有较强的抵抗性,同时肿瘤本身在脑内分布,药物的有效作用无法在血脑屏障的限制下发挥出来。但是这种现状在癌基因组阿特拉斯计划、基因表达谱、肿瘤干细胞理论等作用下显著改变。现阶段虽然在胶质瘤研究中miRNA 仍然处于起步阶段,但是已经确定了特异miRNA 在神经胶质瘤中的表达谱,将新的依据提供给了临床诊断和治疗神经胶质瘤的工作。近年来,有研究表明[7],在脑肿瘤的诊断中, miRNA 表达谱可能能够作为有用的生物标记,并成为新的药物将肿瘤上涨阻止。
miRNAs 的生物合成机制为 miRNAs 基因在人类所有染色体中分布, Y染色体除外。 RNA聚合酶Ⅱ转录对 miRNA 进行首先编码的基因为原始 miRNA,通常情况下,其核苷酸序列较长,达到了几百到一千个。之后,原始 miRNA 将茎-环二级结构形成,呈发夹形状, RNA酶Ⅲ在细胞核中对其进行加工,促进前体 miRNA 的形成,长度为60~70nt左右,最后,在转运蛋白 Exprorin-5的作用下,原始 miRNA 被从核内向胞质中运输,在 Dicer 酶作用下向短双链 miRNA 进一步加工,解旋酶解开双链为成熟 miRNA、miRNA*,前者被引导向沉默复合体中进入,翻译抑制或降解mRNA,后者以较快的速度被降解[8]。
长链非编码 RNA(Long non-coding RNA,LncR-NA)是一类长度大于200nt的非编码 RNA,其在转录沉默、转录激活、染色体修饰、核内运输等均具有重要的功能。LncRNAs在多种恶性肿瘤,包括GBM 中发挥重要调控作用。此外,LncRNAs还是比较灵敏的肿瘤标志物,能够用于肿瘤的早期诊断和预后评价。 TTN-AS1起到促进食管癌细胞增殖、转移的作用。但TTN-AS1在 GBM 中的表达水平及功能尚未见报道。 miRNA 是由大约23个核苷酸组成的非编码单链RNA,它与目标mRNA 的(3’UTR)互补配对结合,在转录后水平调控成百上千个基因的表达,具有广泛的生物学功能[9]。由于存在 miRNA的结合位点, LncRNA 可以作为内源性竞争性RNA,通过竞争性结合 miRNA,在细胞中起到 miRNA 海绵的作用,进而解除 miRNA 对其靶基因的抑制作用,升高靶基因的表达水平。前述TTN-AS1和 G6PD 并不存在直接作用。 TTN-AS1可能作为某些 miRNAs 的ceRNA发挥作用,并间接调控PPP。综上所述,申报人提出科学假说:由于与 miR-153存在结合位点, TTN-AS1减弱了 miR-153对下游靶基因的负调控作用,最终促进PPP 及 GBMCs 恶性增殖。 miRNAs 广泛参与着肿瘤发生发展的调控,在GBM 中,有些过表达的 miRNAs 起到了癌基因的作用,而另一些降低表达的 miRNAs 则起到抑癌基因的作用[10-11]。与此同时, miRNAs 还广泛参与对 GBM 干细胞的干细胞特性的调控[12]。
GBM 中存在着显著的糖代谢异常,其中即包括 PPP[13]。显著上调的PPP是GBM快速生长的重要因素,也是 GBM治療的有效切入点,但调控PPP 的确切机制有待阐明[14-15]。前期研究发现,TTN-AS1在 GBM 中高表达,起到促进PPP 和 GBM 增殖的作用。 TTN- AS1负调控 miR-153,从而减弱 miR-153对 PPP的关键限速酶 G6PD 的抑制作用,最终促进PPP 及 GBM 恶性增殖。为了阐明TTN-AS1、miR-153、G6PD 在调控轴中的调控机制,本研究需要对不同节点的两两结合调控关系进行验证。在前期研究中,我们已经初步研究了TTN-AS1对 miR-153、miR-153对 G6PD 的调控作用。本研究阐述miR-153通过戊糖磷酸途径抑制 GBM干细胞增殖的情况,结果表明,转染后1 d、5 d, miR-153组和空白对照组的细胞存活率对比差异不显著(P>0.05);转染后2 d、3 d、4 d,miR-153组的细胞存活率低于空白对照组(P<0.05),其中转染后4 d出现最小细胞生存率。 miR-153组的细胞凋亡率高于空白对照组(P<0.05),说明 miR-153显著抑制 GBM 干细胞增殖,并验证了 miR-153可以作为 GBM 治疗的新靶点,具有潜在药物开发价值。
综上所述,此次研究 miR-153通过 PPP抑制 GBM 增殖的分子机制,提供GBM治疗的靶点,具有临床应用价值。
参考文献
[1] Qiao J,Zhao J,Chang S,et al. MicroRNA-153 improves theneurogenesis of neural stem cells and enhances the cognitive ability of aged mice through the notch signaling pathway[J].Cell Death Differ,2020,27(2):808-825.
[2] Diana A ,Gaido G ,Maxia C ,et al. MicroRNAs at thecrossroad ofthe dichotomic pathway cell death vs. stemness in neural somatic and cancer stem cells:implications and therapeutic strategies[J]. Int J Mol Sci,2020,21(24):9630.
[3] Buruiană A,Florian ȘI,Florian AI,et al. The roles ofmiRNAin glioblastoma tumor cell communication:diplomatic and aggressive negotiations[J]. Int J Mol Sci,2020,21(6):1950.
[4] Zhou Z,Lai Y,Cao S,et al. Long non-coding RNA HHIP-AS1 inhibits lung cancer epithelial-mesenchymal transition and stemness by regulating PCDHGA9[J]. Mol Med Rep,2021,24(6):845.
[5] Ashrafizadeh M,Ang HL,Moghadam ER,et al. MicroRNAsand their influence on the ZEB family:mechanistic aspects and therapeutic applications in cancer therapy[J]. Biomolecules,2020,10(7):1040.
[6] Iaquinta MR,Lanzillotti C,Mazziotta C,et al.The roleof microRNAs in the osteogenic and chondrogenic differentiation of mesenchymal stem cells and bone pathologies[J]. Theranostics,2021,11(13):6573-6591.
[7] Tseng AM,Chung DD,Pinson MR,et al. Ethanol exposureincreases miR-140 in extracellular vesicles:implications for fetal neural stem cell proliferation and maturation[J]. Alcohol Clin Exp Res,2019,43(7):1414-1426.
[8] Zhang J,Li Y,Liu Y,et al. Long non-coding RNA NEAT1regulates glioma cell proliferation and apoptosis by competitively binding to microRNA-324-5p and upregulating KCTD20 expression[J]. Oncol Rep,2021,46(1):125.
[9] Zuo Z ,Ye F ,Liu Z ,et al. MicroRNA-153 inhibitscell proliferation ,migration ,invasion and epithelial- mesenchymal transition in breast cancer via direct targeting ofRUNX2[J]. Exp Ther Med,2019,17(6):4693-4702.
[10] Mazurek M,Grochowski C,Litak J,et al. Recent trends ofmicroRNA significance in pediatric population glioblastomaand current knowledge ofmicro RNA function in glioblasto- ma multiforme[J]. Int J Mol Sci,2020,21(9):3046.
[11] Baliou S,Kyriakopoulos AM,Spandidos DA,et al. Roleof taurine,its haloamines and its lncRNA TUG1 in both inflammation and cancer progression. On the road to therapeutics?(Review )[J]. Int J Oncol,2020,57(3):631-664.
[12] Humphries BA,Wang Z,Yang C. MicroRNA regulationof the small rho GTPase regulators— complexities and opportunities in targeting cancer metastasis[J]. Cancers (Basel ),2020,12(5):1092.
[13] Qiu T ,Yin H ,Wang Y ,et al. miR-153 attenuates thein?ammatory response and oxidative stress induced by spinal cord injury by targeting ofNEUROD2[J]. Am J Transl Res,2021,13(7):7968-7975.
[14] Thomas L,Florio T,Perez-Castro C. Extracellular vesiclesloaded miRNAs as potential modulators shared between glioblastoma,and parkinson’s and alzheimer’s diseases[J]. Front Cell Neurosci,2020,14(11):590034.
[15] Yang L,Chen Y,Liu N,et al. Low expression ofTRAF3IP2-AS1 promotes progression ofNONO-TFE3 translocation renal cell carcinoma by stimulating N6-methyladenosine ofPARP1 mRNA and downregulating PTEN[J]. J HematolOncol,2021,14(6):46.
(收稿日期:2021-10-25)
