对零切迹自稳型融合器与传统融合器合并钛板固定治疗退行性颈椎病的疗效比较
2022-05-12李盼雷润博甘璐李沫罗卓荆
李盼 雷润博 甘璐 李沫 罗卓荆
颈椎前路椎间盘切除融合术(anterior cervical discectomy with fusion, ACDF)可有效解除脊髓压迫,恢复颈椎生理曲度,被认为是临床治疗颈椎退行性疾病的主流术式和金标准[1]。传统的ACDF使用融合器合并钛板固定,以增加减压节段的稳定性、提高融合率[2]。但是,中长期随访表明术中钛板的使用可能会增加邻近节段椎体退变(adjacent segment degeneration,ASD)的风险[3],而且由于术中的牵拉刺激以及剥离的软组织较多,在手术视野受限的条件下,会因为出血影响手术操作,增加难度及风险,导致术后出现声音嘶哑及吞咽困难,甚至出现呼吸困难。若术中食管牵拉压迫时间延长,可能导致食管瘘等严重并发症[4]。因此,术后ACDF相关并发症需要关注[5]。为减少潜在的并发症,颈椎前路零切迹自稳型融合器被临床广泛应用于治疗颈椎退行性疾病。该椎间融合装置由聚醚醚酮融合器和两个集成的自锁夹构成,可通过终板进入椎体,提供足够的稳定性,避免植入物与椎前软组织接触,短期效果满意[6-7]。目前鲜有文献报道患者术后5年以上回访的临床疗效。本研究回顾性分析采用自锁定式零切迹椎间融合器(ROI-C)和传统钛板融合器内固定(CPC)系统治疗ACDF的颈椎病患者资料,比较两种手术治疗颈椎病的临床疗效、术后吞咽困难及远期邻近节段退变的发生率。
资料与方法
一、资料
1.纳入与排除标准:(1)纳入标准:①MRI及其他影像学表现提示脊髓或神经根受压;②相应临床症状明显,如颈肩上肢疼痛麻木、僵硬、Hoffmann征阳性、胸带感觉异常、四肢肌肉无力、行走不稳等;③正常非手术治疗6个月以上症状未见明显缓解,影响正常生活;④随访资料完整,随访时间60个月。(2)排除标准:①已行ROI-C和传统ACDF手术;②重度颈椎不稳、颈椎骨折脱位、颈椎管狭窄、肿瘤、椎管占位性病变等;③术前出现吞咽困难及邻近节段变性的患者。本研究经西京医院伦理委员会批准。
2.病例来源:2014年6月至2016年6月,在空军军医大学西京医院骨科行颈椎前路颈椎病患者85例。42例患者行ROI-C手术;其中,男20例,女22例;手术年龄48~65(57.2±8.6)岁;相应手术节段C3-4(4例)、C4-5(5例)、C5-6(14例)、C6-7(5例)、C3-5(8例)、C4-6(6例)。43例患者行传统ACDF手术;其中男21例,女22例;年龄49~64(58.5±9.4)岁;相应手术节段为C3-4(5例)、C4-5(5例)、C5-6(15例)、C6-7(5例)、C3-5(6例)、C4-6(7例)。两组患者的年龄、性别、随访时间、手术水平比较差异无统计学意义(P>0.05)(表1)。本研究纳入患者并非随机分配到ROI-C或ACDF组进行手术,而是在考虑伦理和患者经济情况下,经过充分的术前谈话后患者自主选择的结果。
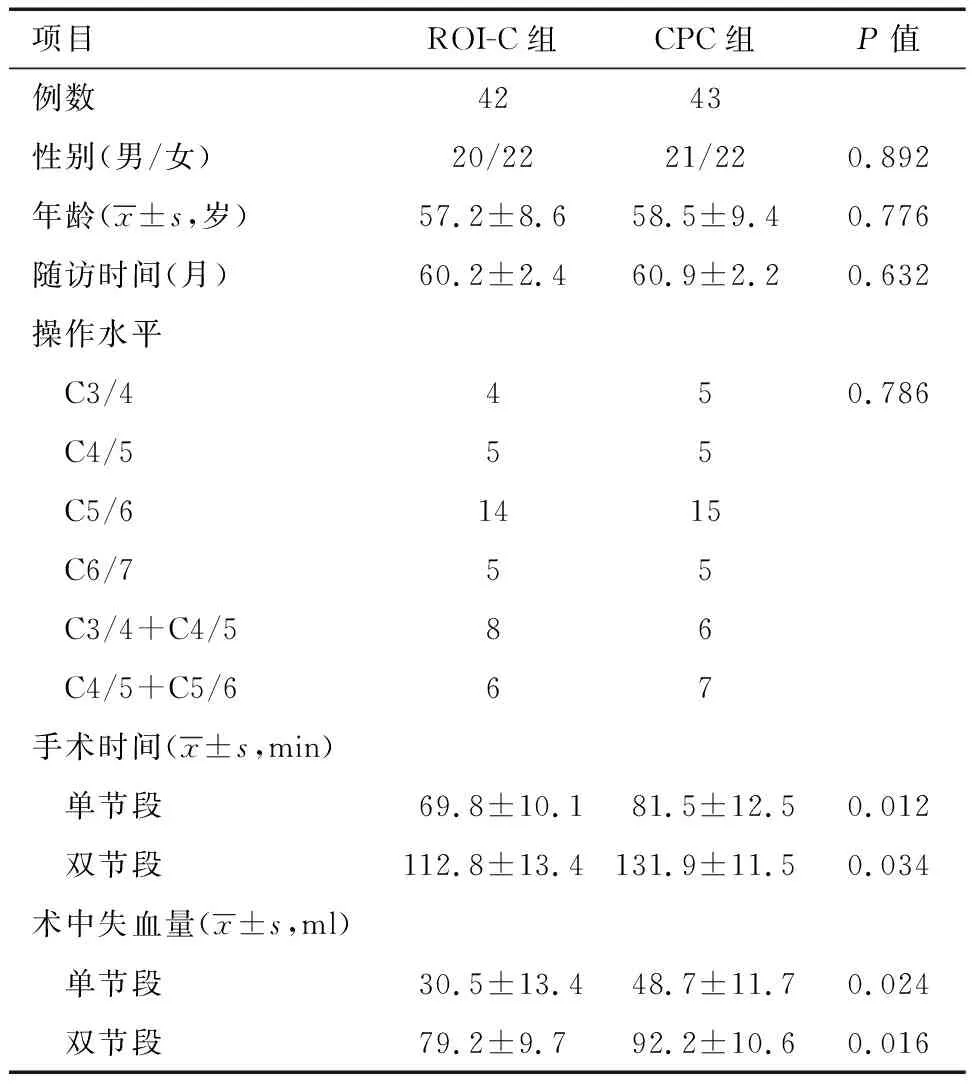
表1 两组患者行不同颈前路椎间盘切除融合术的资料
二、方法
1.手术操作:所有手术均由同一资深外科医生和其团队完成。全身麻醉后,患者取仰卧位。手术采用标准的Smith-Robinson前方入路[8]。根据术前检查,在确定和暴露适当的椎体水平后,将包括椎间盘和骨赘在内的致压物切除松解。切开后纵韧带,显露硬膜囊,行硬脑膜减压和神经减压。减压后刮除终板软骨,处理植骨床。(1)ROI-C组: 使用试模确定ROI-C融合器的适当大小后,将切除的自体骨和0.25 mg重组人骨形态发生蛋白(rhBMP-2)(九源基因工程有限公司,杭州,中国)填充入ROI-C融合(LDR公司,法国)。将融合器ROI-C缓慢置入椎间隙。检查融合器位置、高度合适后,将2个颈椎锚定夹分别插入上下椎体进行颈椎固定。(2)CPC组: 选择合适大小的椎间融合器(威高,山东),PEEK 融合器中加入0.25 mg的rhBMP-2和切除的自体骨。根据减压范围,选择合适长度的钛板,用椎间融合器联合前路钛板、螺钉(威高,山东)内固定。放置常规留置引流袋后,缝合切口,手术结束。术中诱发电位监测未见异常。术后予以补液、镇痛等支持治疗。2 d后拔除引流管,佩戴颈托下床活动。单节段手术患者术后佩戴颈托1个月。双节段患者嘱佩戴颈托6周。术后3、6、12个月及术后每年1次进行临床及影像学随访。
2.临床评估:术前术后采用日本骨科学会(Japanese Orthopedic Association,JOA)评分、颈椎功能障碍指数(neck disability index,NDI)检测[9-10]。计算JOA评分改善率:计算JOA评分改善率(JOA评分改善率(%)=(术后JOA评分-术前JOA评分)/(17-术前JOA评分)×100%)。将JOA评分改善率分为4个等级:极好(≥75%)、好(≥50%且< 75%)、一般(≥25%且<50%)、差(<25%)[11]。采用Odom标准对手术疗效进行判定[12],并由未参加手术的独立观察员进行评估。优:所有术前症状均消除;良:术前症状明显缓解,不影响日常活动、工作;可:术前症状部分缓解,但日常活动受限明显;差,症状无变化或较术前加重。优和良则视为疗效满意。术后3~36个月内评估吞咽困难情况。根据Bazaz评分[13],将术后吞咽困难程度分为无症状(无吞咽困难)、轻度(罕见吞咽困难)、中度(偶尔吞咽困难)、重度(频繁吞咽困难)。观察有无术后并发症,包括(内植物移位、断裂、颈髓损伤加重等)。
3.放射检查:所有患者术前,术后3、12个月及末次随访时均拍摄颈椎标准正侧位X线片。(1)测量颈椎C2-7 Cobb角:Cobb角为C2与C7椎体下终板连线的垂线之间的夹角。(2)融合节段椎间隙高度测量:手术节段上位椎体下终板切线中点与下位椎体上终板切线中点连线的长度。(3)依据Vaccraro标准评估椎间植骨融合情况:颈椎动力位X线片示邻近椎体位移角度≤2°;椎间隙高度恢复,无塌陷;骨小梁与上下椎体骨性连接;植骨区与椎体上下缘间无透亮线。(4)邻近节段退变的评价指标:X线、CT及MRI上发现有骨赘形成、椎间不稳、终板硬化及小关节增生等多方面的退变迹象。2位独立观察者在2次不同情况下确定邻近节段退变等级。以4次测量的平均值作为最终等级。

结 果
1.两组手术相关指标比较:所有患者均顺利完成相应手术。ROI-C组随访60~62(60.2±2.4)个月;CPC组随访60~63(60.9±2.2)个月。ROI-C组和CPC组单节段平均手术时间分别为(69.8±10.1)min和(81.5±12.5)min。两组患者术中平均出血量分别为(30.5±13.4)ml和(48.7±11.7)ml。ROI-C组和CPC组双节段的平均手术时间分别为(112.8±13.4)min和(131.9±11.5)min。同一组患者相应的术中平均出血量分别为(79.2±9.7)ml和(92.2±10.6)ml。ROI-C组患者单节段和双节段的平均手术时间和术中出血量均明显少于CPC组(P<0.05,表1)。
2.两组术前、术后JOA、NDI评分及手术疗效比较:两组术前JOA及NDI评分的差异无统计学意义(P>0.05)。两组患者术后3个月及末次随访JOA评分均较术前明显升高,NDI评分均较术前明显下降,差异有统计学意义(P<0.05)。同一时间点的组间比较,JOA评分、NDI评分差异均无统计学意义(P>0.05)。两组间JOA改善率的差异无统计学意义(P>0.05)(表2)。根据Odom标准,ROI-C组组优良率为92.8%(39/42),CPC组优良率为86.0%(37/43),差异无统计学意义(P>0.05)。

表2 两组患者手术相关评估指标比较
3.两组影像学结果比较:两组患者术前颈椎C2-7 Cobb角,病变椎间隙高度之间比较差异无统计学意义(P>0.05)。术后3个月及末次随访时两组颈椎Cobb角和椎间盘高度均明显改善,与术前相比差异有统计学意义(P<0.05),但组间比较差异无统计学意义(P>0.05)。术后6个月时,ROI-C组融合率为97.6%(41/42),CPC组融合率为93.0%(40/43),组间比较差异无统计学意义(P>0.05)。所有患者术后1年均获得骨性融合。ROI-C组平均融合时间为(6.29±1.31)个月;CPC组平均融合时间为(6.43±1.56)个月,两组差异无统计学意义(P>0.05)。末次随访时ROI-C组未出现ASD;CPC组出现4例症状性ASD。两组术后ASD的发生率差异有统计学意义(P<0.05)。
4.并发症:两组均无内固定移位、螺钉松动、插入物及钢板断裂、食管穿孔等并发症发生。ROI-C组轻度吞咽困难4例(9.5%),症状治疗3~5 d后消失。CPC组术后轻度吞咽困难5例(11.6%),中度吞咽困难4例(9.3%)。随访3个月,3例出现轻度吞咽困难。末次随访时有2例仍存在轻度吞咽困难。末次随访时,ROI-C组无症状性ASD发生;CPC组有4例有症状性ASD患者进行了二次手术。两组术后ASD发生率比较差异有统计学意义(P<0.05)(表3)。

表3 两组术后并发症情况[例(%)]
5.典型病例:患者男,64岁,被诊断为脊髓型颈椎病。行颈椎前路C4-5椎间盘ROI-C切除融合内固定术。术前观察到患者也存在C5-6退变,椎间隙高度丢失,前纵韧带钙化,但不严重尚不考虑此节段的手术。在ROI-C手术后,责任椎间隙的C4-5颈椎恢复良好。尤其是,本身自有的C5-6邻椎病并没有加重,椎间隙高度没有进一步的丢失而是维持原状(图1)。
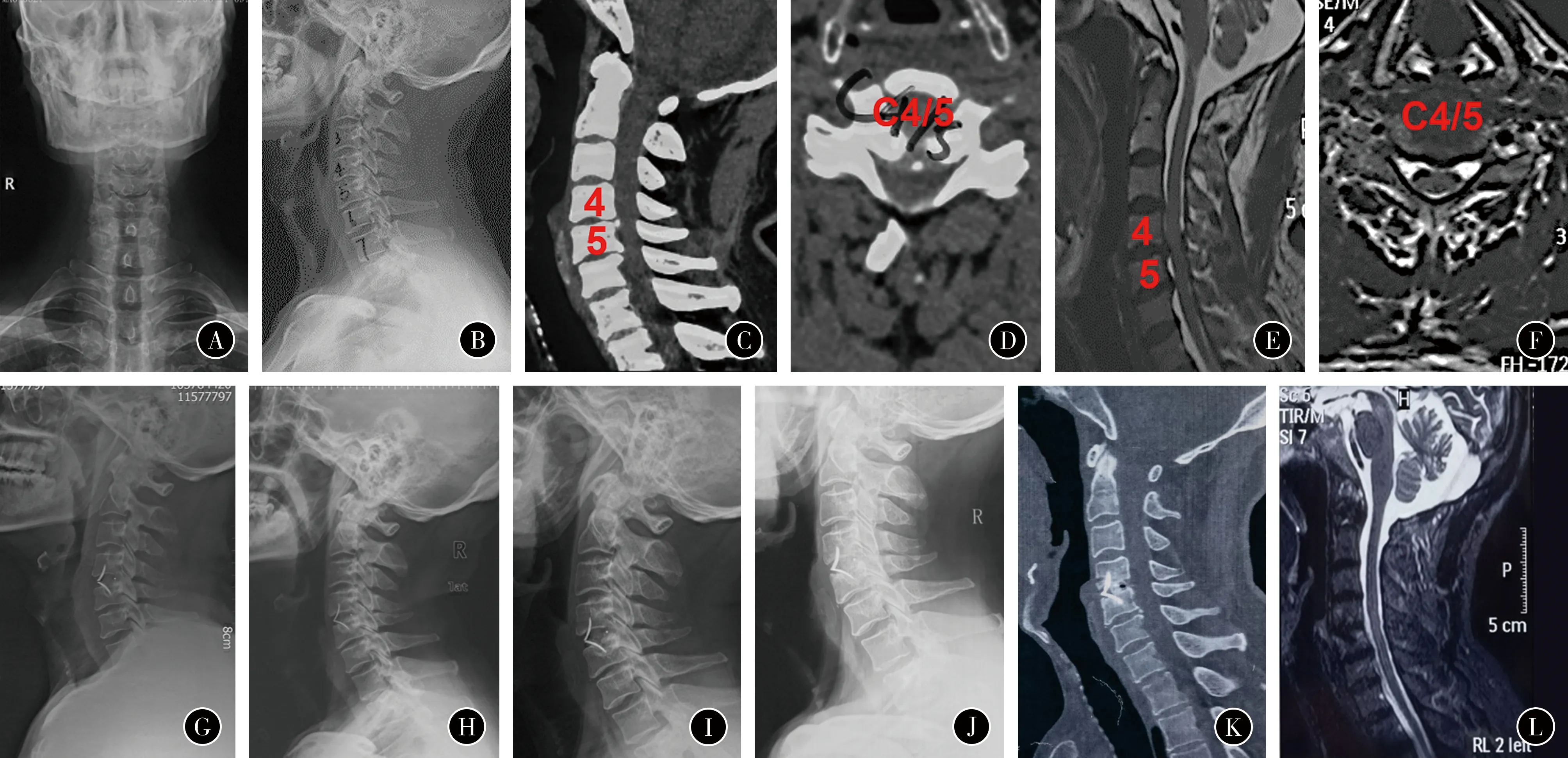
图1 患者男,64岁,脊髓型颈椎病,行C4/5 ROI-C前路椎间盘切除融合内固定术 A~F 术前X线、CT、MRI 提示C4/5 椎间盘突出,脊髓受压 G~I 术后1个月,1、3年随访X线提示无邻近节段退变加重 J~L 术后5年X线、CT、MRI提示内固定位置良好,无邻近节段退变加重
讨 论
ACDF是通过切除病变椎间盘来减轻脊髓或神经根的压力,从而减轻临床相应的疼痛、麻木以及无力的症状。融合器合并钛板固定被广泛应用于临床。钛板的应用可以有效提高颈椎稳定性,减少融合器的松动、脱出等情况的发生。然而,使用钛板后会出现相关并发症,包括钛板移位、螺钉松动或断裂、软组织损伤、慢性吞咽困难和相邻节段退变。而桥式固定颈部融合器ROI-C的设计采用零切迹的设计理念,包括一个零轮廓的椎间融合装置和一个独立融合的自锁钢板[14],可更好的规避传统钛板的短板。ROI-C上方弧形部分遵循自然的解剖形态,前缘高于后缘,使骨与置入物紧密接触;且外周横截面积大,增加了植骨与上下椎体的接触面积。与传统的钛板固定手术相比,ROI-C手术时间短,显露范围更小,且装置不突出于椎体前缘,避免了钢板对邻近节段的干扰,降低邻近退变发生率,术后并发症更少,初步临床效果相对比较满意。但是,鲜有文献报道患者术后5年以上的临床疗效。本研究的目的是多方面评价ROI-C和CPC治疗退行性颈椎病的中期临床疗效。
1.维持生物力学稳定性:生理性颈椎曲度对保持脊柱的稳定性至关重要。颈椎的生物力学特性是保护脊髓,将头部负荷传递到胸椎,保持最大运动幅度。它是脊柱力学传导环节的重要组成部分。因此,恢复颈椎生理曲度及椎间隙的高度受到了学者的广泛关注[14]。在本组研究中,两组患者术后及末次随访时C2-C7的Cobb角及手术节段椎间隙高度均明显升高,与术前比较差异有统计学意义。这表明这两种手术方法都能有效增强颈椎的生理曲度。两组术后均实现骨融合。但与术后1个月相比,最终随访时,ROI-C组椎间盘高度丢失高于CPC组,但两组间无统计学差异,与其他文献报道一致[15]。ROI-C融合器是将两个颈椎锚定夹插入椎体,以此提高融合段的相对稳定性,起到弹性固定的作用,但是并不能为屈伸活动提供足够的应力。当应力不足时可能会引起融合器术后下沉,最终导致椎间盘高度下降[16]。对多节段脊髓型颈椎病研究显示,钢板加融合器组和ROI-C组术后手术节段椎间隙及 C2-C7 Cobb 角均较术前明显增大,生理曲度明显改善,与本研究结果一致[17]。有研究在多节段脊髓型颈椎患者中观察到,手术后ROI-C组手术患者的颈椎序列曲度以及Cobb角度恢复均优于椎板成形术组[6]。在治疗合并骨质疏松的颈椎病中,ROI-C也能有效改善颈椎曲度,恢复椎间隙高度。在Rong等[18]的研究中发现,即使是骨质疏松引起的ROI-C插入物松动,也不会影响融合器的稳定性。骨质疏松症的病理特征为骨矿物质含量降低、骨小梁稀疏、骨质量下降;这些特征降低了正常骨的强度和应力耐受性[19]。因此,骨质疏松症也是颈椎病的危险因素之一。骨质疏松椎体失稳后轴向旋转增加扭转应力,引起椎体倾斜,加速椎间盘损伤和退行性变[20]。本研究中只有部分患者在住院后进行骨质疏松检查;其余患者根据现有的X线资料进行诊断。故ROI-C在治疗颈椎退行性病变合并骨质疏松症中具有重要意义。但在严重骨折骨质疏松的患者中,骨质量差可能导致融合器松动下沉,所以不建议使用ROI-C。
2.吞咽困难:吞咽困难是一种与颈椎前路钛板相关的术后并发症。大多数吞咽困难会随着时间的推移而消失。颈椎前路融合术中应用钛板的术后吞咽困难发生率为2%~60%[21]。可能的原因包括椎前软组织肿胀、术中食管受牵拉、血肿压迫、钛板与周围组织粘连等。较薄的钛板能显著减少吞咽困难的发生率[22-23]。虽然目前使用的钛板比早期的设计更薄,但仍会导致术后吞咽困难的发生。相比ROI-C可插入椎间隙中,无需钛板固定,避免手术直接刺激食管并减轻食管粘连,可减少吞咽困难的发生。在本研究在术后1个月随访时,ROI-C组颈前路软组织肿胀程度远低于CPC组;但末次随访时,组间比较差异无统计学意义。ROI-C组吞咽困难发生率及严重程度低于CPC组,持续时间较短,与既往研究一致。甲基泼尼松龙可显著降低ACDF患者的吞咽困难发生率[24]。而相比之下手术中局部使用类固醇对ACDF术后的吞咽功能或肿胀并没有明确的影响[25]。因此,药物干预在预防软组织肿胀导致的吞咽困难方面有待进一步的研究。颈椎手术时需要暴露颈部软组织、气管、食道,暴露手术视野范围大,可导致血液和间质液在前软组织间隙内积聚。手术区软组织严重肿胀也会压迫气管,导致窒息,危及生命[26];应在术前指导患者进行气管推移训练。气管推移可使手术侧前路椎体软组织松解,降低颈内动脉压力传感器的敏感性。这样可以更好地帮助患者适应术后局部软组织肿胀引起的不适,缓解患者的紧张,并加快术后功能恢复。
3.ASD:ASD是颈椎手术后长期临床疗效评价的重要指标。ACDF不可避免地牺牲手术节段的活动范围,而增加了融合节段邻近上下椎体的活动度。这是导致ASD的重要原因[27]。此外,ASD可能与钛板对相邻水平前纵韧带的刺激和剥离过多有关。椎间盘周围生物力学环境的改变可能导致邻近节段的变性,但具体的机制尚不清楚。钛板上下缘与相邻椎间盘的距离是ASD发生的关键危险因素。钛板上下缘与相邻椎间盘的距离越小,发生退变的可能性越大[28]。使用较长的螺钉、较短的钢板可最大限度地扩大与相邻节段的距离,显著降低ASD的发生率并改善临床症状[29]。在临床研究中,ROI-C组无邻近节段退变的发生,而CPC组相邻节段退变率为9.3%,需要在手术相邻节段进行二次固定。这是因为ROI-C未使用钢板且不受钛板上下缘与相邻椎间盘的距离影响;而且ROI-C手术术中对前纵韧带、浅筋膜等椎前软组织的损伤较小。但ROI-C是否真的降低了ASD的发生率,还需要更长的观察时间。本研究的典型病例说明ROI-C在提供与钛板加融合器相似的生物力学稳定性的同时,可最大限度的分散应力,减少邻椎病发生。有限元分析表明,钛板可能增大相邻椎体的的生物力学应力,容易引发ASD[30];该分析可有助于解释ROI-C组的ASD发生率低于CPC组。
总之,ROI-C组与CPC组在JOA评分、NDI评分、平均融合时间、融合率、颈椎生理曲度恢复等方面差异无统计学意义;但在手术指标方面,与CPC组相比,ROI-C组手术时间短、出血少。此外,ROI-C组吞咽困难和ASD的发生率低于CPC组,证明了在ACDF治疗颈椎病中应用ROI-C与CPC具有相同的疗效,同时降低了并发症的发生率。本研究对象是亚洲群体,具有一定的代表性,说明ROI-C的设计理念在亚洲人群中具有优势。本研究存在以下不足:(1)对于远期疗效的观察不够长,仍需进一步随访;(2)病例数较少,且作为回顾性研究,其研究结存在一些偏差;(3)ROI-C的远期疗效和并发症仍需多中心、大样本数据进一步研究。
