阻断B7/CD28通路对类风湿关节炎小鼠的影响
2022-05-12黄艳艳詹宇威
刘 颖,黄艳艳,詹宇威,詹 锋
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性炎症疾病,其典型特征是滑膜炎、关节破坏和全身性炎症。RA不仅影响了患者的日常生活,而且还给家庭和社会带来了沉重负担[1-3]。B7/CD28共刺激通路是主要的T细胞共刺激途径之一,在多种自身免疫性疾病中发挥作用,能够影响共刺激信号分子之间的相互作用和细胞免疫应答反应。细胞毒性淋巴细胞抗原4免疫球蛋白(cytotoxic T lymphocyte antigen-4 immunolobulin,CTLA-4Ig)是一种融合蛋白,由CTLA-4与IgG Fc段基因重组而成,能够通过与B7结合来阻断B7/CD28共刺激通路,从而诱导T细胞失能[4],目前已用于自身免疫性疾病和排斥反应的研究中,并取得了显著成效[5-6]。该研究在构建RA小鼠模型基础上,应用CTLA4-Ig阻断B7/CD28以探讨其在RA中的作用,以期为临床诊疗提供理论依据。
1 材料与方法
1.1 实验动物DBA/1小鼠40只,雄性,6~8 周龄,体质量18~20 g,由海南医学院实验动物中心饲养于SPF环境,温度为(20±3) ℃,相对湿度为45%,明暗交替12 h/12 h,期间自由饮水饮食。本实验通过海南省人民医院动物伦理委员会批准。
1.2 主要材料CTLA4-Ig购自美国BD Pharmingen公司,Ⅱ型胶原、弗氏完全佐剂和弗氏不完全佐剂购自美国 Chondrex 公司,ELISA检测试剂盒购自南京建成生物研究所,HE染色试剂盒购自北京索莱宝生物公司,TRAP染色试剂盒购自美国Sigma公司,TRIzol试剂盒购自南京诺维赞生物公司,Prime ScriptTMRT reagent Kit和SYBR Premix Ex TaqTMII购自日本Takara公司,BCA蛋白检测试剂盒、ECL化学发光液和免疫组织化学染色试剂盒购自上海碧云天生物研究所,抗体骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子(receptor activator of NF-κB,RANK)、核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)、p65、p-p65、p-IκBα、IκBα以及核因子κB(nuclear factor κB,NF-κB)均购自英国Abcam公司,肌动蛋白(β-actin)和辣根过氧化物酶标记的山羊抗兔IgG购自北京中杉金桥生物公司。其他试剂均为国内市售分析纯。
1.3 方法
1.3.1小鼠胶原诱导性关节炎模型的制备 采用Ⅱ型胶原诱导法建立小鼠CIA模型,用固定器固定小鼠尾根部,取100 μl浓度为1 mg/ml的混合牛Ⅱ型胶原和弗氏完全佐剂的乳化剂,在小鼠尾根部处皮下进针注射,进行初次免疫;在第一次免疫后21 d,将100 μl浓度为1 mg/ml的混合牛Ⅱ型胶原与弗氏不完全佐剂的乳化剂再次于小鼠尾根部皮下进针注射,进行二次免疫。
1.3.2小鼠分组与治疗 40只DBA/1小鼠采用随机数字表法分为4组,包括正常对照组、模型组、CTLA4-Ig低剂量组和CTLA4-Ig高剂量组,除正常对照组外,其余三组小鼠均制备胶原诱导性关节炎模型。在二次免疫结束后第0、5、10天,CTLA4-Ig低剂量组和CTLA4-Ig高剂量组的小鼠分别以50、100 mg/kg的剂量进行腹腔注射CTLA4-Ig溶液,同时,给予正常对照组和模型组的小鼠腹腔注射等量生理盐水。
1.3.3足肿胀度测量与关节炎评分 在二次免疫结束后第0、10、20天,采用游标卡尺测定各组小鼠的同侧后足掌厚度,每次重复测量3次。同时,二次免疫结束后第0、5、10、15、20天进行关节炎评分,评分标准为:0分,正常,无红肿;1分,小趾关节轻微肿胀,有红斑;2分,趾关节、足趾中度肿胀;3分,踝关节以下的足爪肿胀,红肿明显;4分,包括踝关节在内的全部足爪严重肿胀,四肢评分和计为关节炎指数。
1.3.4ELISA法检测各组小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-17(interleukin-17,IL-17)的水平 在二次免疫结束后第20天,测量完足肿胀度和关节炎评分后,通过各组小鼠眼球取血,收集2 ml血液,室温静置2 h,再以3 000 r/min离心10 min,留取上清液,保存于-80 ℃冰箱。ELISA法分别检测各组小鼠血清中TNF-α、IL-1β、IL-6和IL-17的水平,操作步骤严格按照试剂盒说明书进行。
1.3.5Micro-CT扫描小鼠膝关节 采血结束后脱颈处死各组小鼠,取两侧膝关节,剔除周围软组织,使用高分辨显微 CT SkyScan 1076 对小鼠膝关节进行扫描,获得图片后,CT Analyzer软件分析骨组织形态计量学参数,包括骨密度(bone mineral density,BMD)、骨小梁厚度(trabecular thickness,Tb.Th)、骨体积(bonevolume,BV)和骨体积分数(bone volume fraction,BV/TV)。
1.3.6HE染色观察组织病理形态学改变 将分离的各组小鼠膝关节组织置于4%多聚甲醛,于室温下固定24 h后,放入10% EDTA溶液(pH=8.0)中脱钙1个月。梯度乙醇溶液脱水后,常规石蜡包埋,并切成5 μm厚的切片,进行HE染色。通过二甲苯脱蜡和梯度乙醇溶液脱水,加入苏木精染色5 min,0.1%氨水中分色数秒钟,放入伊红染液中染色2 min,切片经乙醇溶液脱水、二甲苯透明后,滴加中性树胶进行封片,在光学显微镜下观察组织病理形态学改变。
1.3.7TRAP染色检测各组小鼠膝关节骨质破坏区破骨细胞表达 取制备的各组小鼠膝关节组织切片,置于60 ℃烘箱中烘烤30 min,经过脱蜡脱水后,加入2.5%的戊二醛于4 ℃固定10 min,双蒸水清洗干净,加入TRAP染液,置于暗盒中,37 ℃避光孵育1 h,双蒸水清洗后,苏木精复染2 min,自然条件下晾干,中性树胶进行封片,在光学显微镜下观察并计数破骨细胞数目,TRAP阳性细胞染色呈紫红色。
1.3.8实时荧光定量PCR 取各组小鼠膝关节组织敲碎,加预冷的TRIzol试剂研磨,提取总RNA。利用反转录试剂盒进行逆转录反应, 获得cDNA,通过实时荧光定量PCR实验检测组织中骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子(receptor activator of NF-κB,RANK)、核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL) mRNA表达情况,具体按照SYBR Premix Ex TaqTMII说明书操作,以GAPDH为内参基因。扩增条件为:95 ℃ 3 min;95 ℃ 30 s、60 ℃ 30 s、58 ℃ 30 s,40个循环。引物由上海生工生物工程公司合成,序列见表1。2-ΔΔCt法来计算各基因mRNA的相对表达量。

表1 各基因引物序列
1.3.9 Western blot法检测各蛋白相对表达量取各组小鼠膝关节组织敲碎并研磨,加入RIPA裂解液提取组织总蛋白,BCA法定量。取等量各组蛋白样品上样,通过10% SDS-PAGE凝胶分离蛋白质,电转印至硝酸纤维素膜上,置于5%脱脂奶粉室温封闭2 h后,TBST洗膜,接着加入稀释后的OPG、RANK、RANKL、p65、p-p65、p-IκBα、IκBα抗体(1 ∶1 000稀释)以及内参β-actin抗体(1 ∶5 000稀释),置于摇床上4 ℃下孵育过夜;第2天,TBST洗膜,加入对应辣根过氧化物酶标记的二抗,室温下于摇床上继续孵育1 h,TBST再次洗膜,滴加ECL化学发光液显色曝光,凝胶成像系统拍照,Image Pro Plus软件分析各条带灰度值,计算各蛋白相对表达量。
1.3.10免疫组织化学染色 取制备的各组小鼠膝关节组织切片,将切片分别用梯度乙醇溶液和二甲苯进行脱蜡脱水处理,接着置于柠檬酸盐缓冲液(95 ℃)煮沸15 min以修复抗原,加入3%H2O2去除内源性过氧化物酶后,5%山羊血清室温封闭2 h,将切片与抗体NF-κB(1 ∶200稀释)在4 ℃下共同孵育过夜;第2天,PBS冲洗切片,加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶1 000稀释),在室温下孵育1 h,PBS冲洗后,DAB显色液,苏木精复染,中性树胶进行封片,在光学显微镜下观察组织中的阳性表达情况,胞质染成黄色至棕色即为阳性,随机选择6个视野,Image-Pro Plus软件统计阳性表达面积。

2 结果
2.1 各组小鼠足肿胀度与关节炎评分比较小鼠初次免疫后21 d时开始发病,CIA模型成功率达到93.33%,筛选各组具有相似病程的小鼠各8只进行后续的研究。通过检测各组小鼠足肿胀度发现,二次免疫后小鼠开始发病,四组小鼠足肿胀之间差异有统计学意义(F=346.72),在第10、20 天时,模型组小鼠足肿胀较正常对照组增加(P<0.01),而与模型组比较,CTLA4-Ig高剂量组小鼠足肿胀降低(P<0.01)。四组小鼠关节炎评分结果表明,组间差异有统计学意义(F=234.02),与正常对照组比较,模型组小鼠在二次免疫后关节炎评分升高(P<0.01),经过CTLA4-Ig高剂量治疗后,小鼠的关节炎评分较模型组下降(P<0.01);而CTLA4-Ig低剂量组和模型组小鼠的足肿胀和关节炎评分之间的差异无统计学意义(P>0.05),见图1。
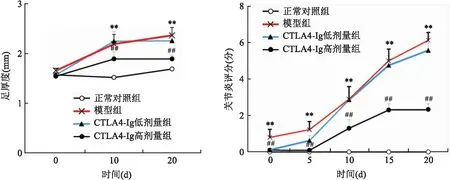
图1 各组小鼠不同时间点足肿胀厚度和关节炎评分统计与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
2.2 各组小鼠血清TNF-α、IL-1β、IL-6及IL-17水平比较ELISA法检测结果显示TNF-α、IL-1β、IL-6及IL-17在不同组间差异均有统计学意义(F=402.45、512.07、398.77、402.72),与正常对照组比较,模型组小鼠血清中TNF-α、IL-1β、IL-6及IL-17水平均增加(P<0.01);与模型组比较,CTLA4-Ig低剂量组和CTLA4-Ig高剂量组小鼠血清中TNF-α、IL-1β、IL-6及IL-17水平均减少(P<0.01),见表2。

表2 各组小鼠血清TNF-α、IL-1β、IL-6及IL-17水平比较
2.3 各组小鼠Micro-CT扫描结果Micro-CT扫描各组小鼠膝前关节显示:正常对照组小鼠关节结构完整,骨质表面光滑,关节间隙正常;模型组可观察到关节明显受损,骨质表面凹凸不平;经过CTLA4-Ig高剂量治疗的小鼠关节骨质表面凹凸不平的现象较模型组有了明显改善,骨破坏程度减小,而相较于模型组,CTLA4-Ig低剂量治疗的小鼠关节受损程度也稍有改善,但没CTLA4-Ig高剂量组明显,见图2。四组小鼠的BMD、Tb.Th、BV及BV/TV差异均有统计学意义(F=376.92、56.33、102.49、230.54),与正常对照组比较,模型组小鼠BMD降低(P<0.01),Tb.Th、BV及BV/TV也下降(P<0.01);而相较于模型组,经过CTLA4-Ig高剂量治疗的小鼠,BMD增高,同时,Tb.Th、BV及BV/TV也升高,差异均有统计学意义(P<0.01),而CTLA4-Ig低剂量治疗的小鼠,BMD、Tb.Th、BV及BV/TV变化较模型组差异均无统计学意义(P>0.05),见图3。

图2 Micro-CT扫描各组小鼠膝前关节A:正常对照组; B: 模型组; C: CTLA4-Ig低剂量组; D: CTLA4-Ig高剂量组
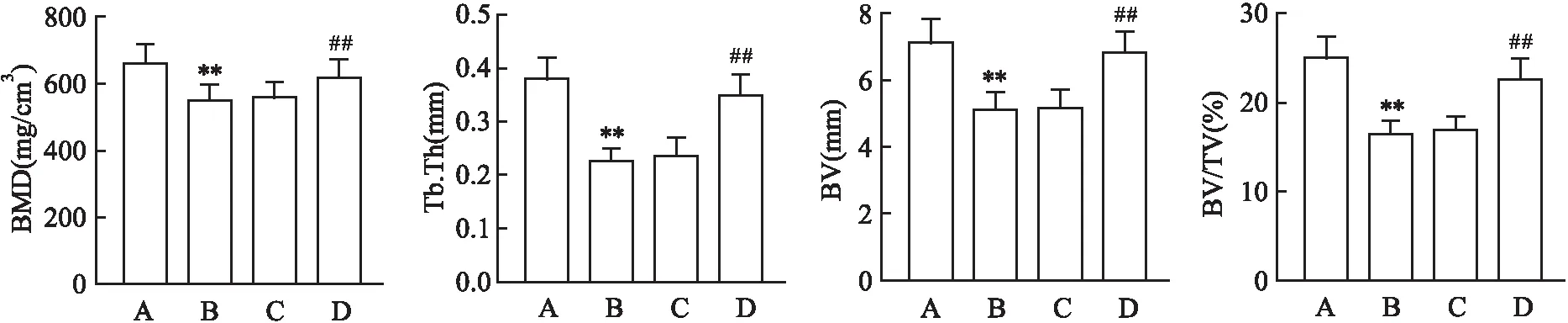
图3 各组小鼠骨组织形态计量学参数检测A:正常对照组; B: 模型组; C: CTLA4-Ig低剂量组; D: CTLA4-Ig高剂量组;与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
2.4 各组小鼠膝关节组织病理改变HE染色结果显示,正常对照组小鼠膝关节结构完整,无滑膜增生变厚和炎性细胞浸润现象;模型组小鼠膝关节面破坏,关节间隙变窄或消失,滑膜增生,并伴随大量炎性细胞浸润;CTLA4-Ig低剂量组和CTLA4-Ig高剂量组小鼠膝关节面破坏程度较模型组均有所减轻,CTLA4-Ig高剂量组小鼠滑膜组织轻度炎症,有少量炎症细胞浸润,组织病变改善较CTLA4-Ig低剂量组更为明显,见图4。
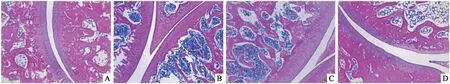
图4 各组小鼠膝关节组织病理变化 HE×100A:正常对照组; B: 模型组; C: CTLA4-Ig低剂量组; D: CTLA4-Ig高剂量组
2.5 各组小鼠膝关节破骨细胞活化状态比较TRAP染色检测结果显示,四组TRAP阳性细胞数目差异有统计学意义(F=267.43),正常对照组小鼠膝关节内可见很少量紫红染色,TRAP阳性表达水平低;模型组可见较多紫红染色,TRAP阳性细胞数目较正常对照组增加(P<0.01),说明有大量成熟破骨细胞存在;CTLA4-Ig低剂量组和CTLA4-Ig高剂量组仍可见紫红染色,与模型组比较,CTLA4-Ig低剂量组TRAP阳性细胞数目有所减少但差异无统计学意义(P>0.05),CTLA4-Ig高剂量组TRAP阳性细胞数目减少(P<0.01),见图5。

图5 各组小鼠破骨细胞数目 TRAP×200A:正常对照组; B: 模型组; C: CTLA4-Ig低剂量组; D: CTLA4-Ig高剂量组;与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
2.6 各组小鼠膝关节组织OPG、RANK、RANKL mRNA和蛋白表达变化实时荧光定量PCR和Western blot检测结果显示,四组小鼠膝关节组织OPG、RANK、RANKL的mRNA和蛋白表达差异均有统计学意义(F=88.45、57.94、74.42;F=62.48、34.50、52.66),与正常对照组比较,模型组小鼠膝关节组织中OPG mRNA和蛋白相对表达量下调,RANK、RANKL mRNA和蛋白相对表达量均上调(P<0.01);与模型组比较,CTLA4-Ig高剂量组OPG mRNA和蛋白相对表达量上调,同时,RANK、RANKL mRNA和蛋白相对表达量下调(P<0.01);而CTLA4-Ig低剂量组和模型组OPG、RANK及RANKL mRNA和蛋白表达之间差异均无统计学意义(P>0.05),见图6、7。

图6 实时荧光定量PCR检测膝关节组织OPG、RANK、RANKL mRNA表达A:正常对照组; B: 模型组; C: CTLA4-Ig低剂量组; D: CTLA4-Ig高剂量组;与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
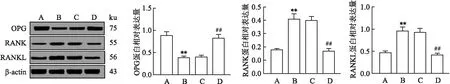
图7 Western blot检测膝关节组织OPG、RANK、RANKL 蛋白表达A:正常对照组;B:模型组;C:CTLA4-Ig低剂量组;D:CTLA4-Ig高剂量组;与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
2.7 各组小鼠膝关节组织NF-κB信号通路相关蛋白表达检测Western blot检测结果显示,四组小鼠膝关节组织p-p65、p-IκBα蛋白表达差异均有统计学意义(F=37.65、27.82),模型组小鼠膝关节组织中p-p65、p-IκBα蛋白相对表达量较正常对照组升高(P<0.01);与模型组比较,CTLA4-Ig高剂量组p-p65、p-IκBα蛋白相对表达量下降(P<0.01);而CTLA4-Ig低剂量组和模型组p-p65、p-IκBα蛋白相对表达量之间以及各组p65与IκBα蛋白相对表达量之间差异均无统计学意义(P>0.05),见图8。免疫组织化学染色实验结果显示,四组小鼠膝关节组织NF-κB阳性表达差异有统计学意义(F=172.46),正常对照组小鼠膝关节组织中未见明显染色,NF-κB阳性表达率低;模型组内可见明显的黄棕色染色区域,NF-κB阳性表达率较正常对照组升高(P<0.01);与模型组比较,CTLA4-Ig低剂量组和CTLA4-Ig高剂量组染色均变少变浅,NF-κB阳性表达率降低(P<0.01),见图9。
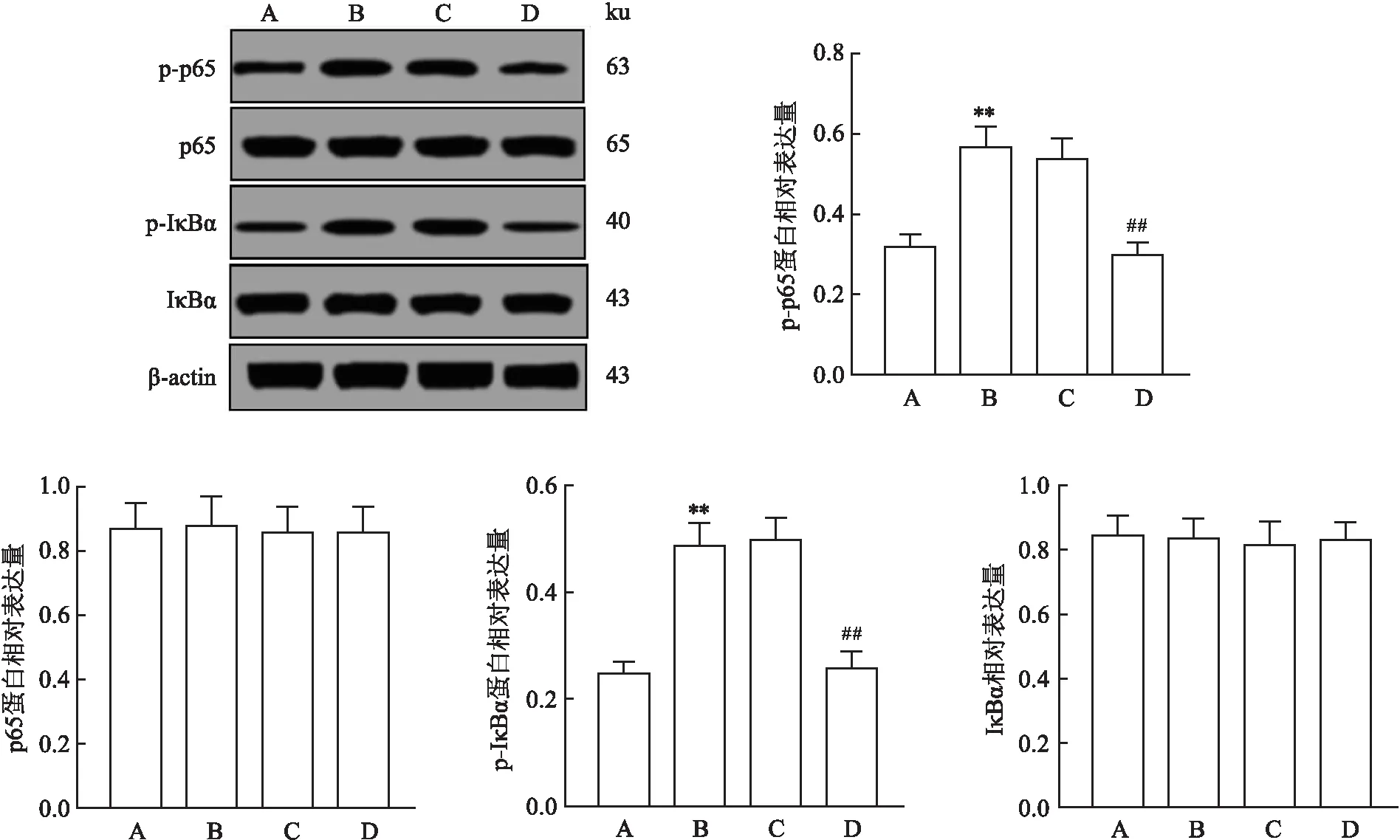
图8 Western blot检测膝关节组织NF-κB信号通路蛋白表达A:正常对照组;B:模型组;C:CTLA4-Ig低剂量组;D:CTLA4-Ig高剂量组;与正常对照组比较:**P<0.01;与模型组比较:##P<0.01
3 讨论
T细胞上的CD28与辅助细胞上的B7(CD80、CD86)的相互作用是调节T细胞活化的重要第二信号-协同刺激信号之一。B7/CD28相互作用可降低T细胞活化的阈值,增强抗原刺激细胞因子的产生,T细胞的克隆扩增以及T细胞向效应细胞的分化。在自身免疫性疾病的进展中,T细胞的募集是该过程中的一个重要现象,这些T细胞可以识别更多的抗原决定簇[7]。阻断CD28可能会阻止天然T细胞的进一步募集和激活,并干扰表位扩散的过程。CTLA4-Ig是由CTLA-4细胞外功能区和人IgG1Fc段组成的融合蛋白,其通过阻断共刺激分子CD28和CD80/CD86活化T细胞的第二刺激信号,从而抑制T细胞活化,目前,其作为一种生物制剂,已在国内外研究中广泛运用。采用CTLA4- Ig可成功预防或治疗多种自身免疫性疾病及肿瘤,这种治疗方法已被广泛用于阻断T细胞上CD28与APC上的配体CD80或CD86的结合,从而抑制了B7/CD28共刺激信号通路。Romo-Tena et al[8]报道指出CTLA4-Ig在鼠狼疮肾炎的治疗中具有良好效果;Bassi et al[9]研究发现在DN大鼠模型中,CTLA4-Ig能够修复足细胞结构与细胞活性,并对抗高糖环境、减少蛋白尿,以改善肾脏血液灌注现象。此外,CTLA-4 Ig已被证明具有治疗多发性关节炎的效果,并且耐受性良好,免疫原性低[10],但其作用功效和耐受性的潜在机制仍有待充分阐明。本研究结果显示,经100 mg/kg CTLA4-Ig治疗RA小鼠后,其足肿胀和关节炎评分均下降,骨组织破坏得到明显缓解。由此进一步说明了通过CTLA4-Ig阻断B7/CD28共刺激通路可达到治疗小鼠RA的效果。
随着RA的发生发展,促炎性介质如TNF-α、IL-1β、IL-6和IL-17由驻留在关节中的炎性细胞所释放,驱使各种炎性细胞渗入关节,加剧了促炎性物质的分泌。而这些促炎性物质能够激活成纤维样滑膜细胞,导致滑膜增生,而激活的成纤维样滑膜细胞分泌局部血管生长因子导致内皮细胞活化并刺激血管生成,从而间接诱导破骨细胞分化来加速骨吸收,降解关节软骨组织[11]。此外,活化的巨噬细胞和破骨细胞通过产生金属蛋白酶也促进了骨骼和软骨的降解。本研究结果显示,经过CTLA4-Ig治疗后,RA小鼠血清中TNF-α、IL-1β、IL-6及IL-17水平均降低,说明炎症反应得到抑制。同时,高剂量CTLA4-Ig(100 mg/kg)作用下破骨细胞数目明显减少,OPG表达升高而RANK、RANKL表达下降。OPG、RANK与RANKL均是破骨细胞分化的关键细胞因子,参与调节破骨细胞分化过程。OPG可抑制破骨细胞的生成与骨吸收,而RANK与RANKL结合可促进破骨细胞活化[12]。
在炎症信号传导途径中,已有多项研究[13]表明NF-κB介导了RA的炎症反应,该通路的激活将导致大量促炎介质释放进而触发炎症级联反应,加速RA恶化。本研究结果显示,在RA小鼠中NF-κB表达增加,p-p65、p-IκBα蛋白表达升高,经过高、低剂量CTLA4-Ig治疗后NF-κB表达降低,且在高剂量CTLA4-Ig治疗下p-p65、p-IκBα蛋白表达下降。由此可见,低剂量CTLA4-Ig作用下可能对RA小鼠NF-κB相关通路作用效果不显著,只是影响了该通路中的部分靶标,或者有其他分子机制参与其中。而相对较高剂量CTLA4-Ig能够抑制NF-κB信号通路的激活,可以推断出CTLA4-Ig可能通过抑制NF-κB炎症信号通路来减轻RA的炎性进程。
