Fe(Ⅵ)/Fenton 体系协同去除焦化废水中菲和氟离子★
2022-05-11张国凯王乐心李亚男
张国凯,王乐心,李亚男*
(1.中海国亚环保工程有限公司,山西 太原 030012;2.太原理工大学环境科学与工程学院,山西 晋中 030600)
焦化废水是一种以高浓度有机物为主、无机颗粒和多种离子并存的复合型废水,其中包含了大量的多环芳烃(PAHs)、杂环类化合物、酚类物质、小粒径煤颗粒物和多种阴离子、阳离子[1]。焦化废水中难降解有机物的有效降解和矿化是废水处理的一个难题,不仅直接影响到尾水中COD 值的大小,也是导致废水处理流程长、费用高的主要因素之一。
Fe(Ⅵ)/Fenton 体系发挥了高铁酸钾和Fenton氧化法各自的优势,一方面,合理利用Fe(Ⅵ)氧化废水中的有机物产生的Fe(Ⅱ)催化双氧水产生羟基自由基·OH,形成类Fenton 反应,另一方面,能有效利用过程中产生的Fe(Ⅱ)和Fe(Ⅲ),在发挥高价态铁离子高氧化性的同时提高羟基自由基的使用效率,并有效利用了Fe(Ⅲ)的絮凝作用[2-4]。
目前,Fe(Ⅵ)/Fenton 体系已用于氧化烃类、除草剂类、盐酸、硝酸、硫酸、卤化剂以及无机颗粒物[2-5],研究表明,该体系能有效矿化有机物,且具有处理效率高、初始成本低的技术优势。而该方法是否可用于焦化废水中PAHs 和氟离子的协同去除,目前尚未报道。本文拟选取焦化废水中的典型三环类PAHs菲和氟离子为研究对象,考察不同pH 条件下Fe(Ⅵ)对菲的氧化去除,以及在弱酸性条件下该Fe(Ⅵ)/Fenton 体系对单独菲、单独氟离子以及菲与氟离子的协同去除效果,为焦化废水处理技术的更新和研发提供参考。
1 材料与方法
1.1 试剂与仪器
主要试剂:菲(PHE,纯度97%);高铁酸钾(纯度≥95%);过硫酸钠、硫酸亚铁、硫酸铁,乙腈、盐酸羟胺、磷酸二氢钠、磷酸二氢钾、磷酸氢二钾、硼砂、盐酸、硫酸等,分析纯。
主要仪器:RF-6000 荧光分光光度计;78-1 恒温磁力加热搅拌器;PXS-F 氟离子计。
1.2 试验溶液
菲储备液:称取0.005 3 g 菲,溶于乙腈并定容至100 mL,得到0.3 mmol/L 菲储备液。
菲反应液:取2 mL 菲储备液,定容至100 mL 水(非缓冲溶液)或缓冲溶液中,得到1.1 mg/L 菲反应液。其中,弱酸性(pH=5)和中性条件(pH=7)使用磷酸盐缓冲溶液,碱性条件(pH=9)使用硼砂-盐酸缓冲溶液。
Fe(Ⅵ)储备液:称取0.039 6 g 高铁酸钾,用pH=9 的硼砂-盐酸缓冲溶液定容至100 mL,即得到2 mmol/L Fe(Ⅵ)储备液,现用现配。
1.3 试验方法
1)Fe(Ⅵ)对菲的氧化实验:分别考察碱性(pH=9)、中性(pH=7)和弱酸性(pH=5)条件下,缓冲溶液和非缓冲溶液中Fe(Ⅵ)对菲的氧化效果。室温下,取配制好的菲反应液置于250 mL 的烧杯中,加入高铁酸钾储备液,n(PHE)∶n(K2FeO4)=1∶2[4],搅拌,在固定的时间点取样至加有0.5 mol/L 盐酸羟胺溶液的离心管中以终止反应,过滤,测定菲浓度。
2)Fe(Ⅵ)/Fenton 体系对菲的氧化实验:室温下,取配制好的菲反应液(弱酸性为pH=5 的磷酸盐缓冲溶液)置于250 mL 烧杯中,加入高铁酸钾储备液反应5 min,再加入Fenton 试剂反应15 min,其中,n(PHE)∶n(K2FeO4)∶n(H2O2)=1∶2∶2,n(H2O2)∶n(FeSO4)=15∶1[2],使用盐酸羟胺终止反应,过滤,测定菲浓度。
3)Fe(Ⅵ)/Fenton 体系氧化氟离子实验:室温、弱酸性条件下,称取0.011 1g 氟化钠加入pH=5 的100 mL 磷酸盐缓冲溶液中,配制得到50 mg/L 的氟离子,置于250 mL 的烧杯中,加入高铁酸钾储备液,在固定的时间点取样,过滤,测定氟离子浓度。
4)Fe(Ⅵ)/Fenton 体系协同去除菲与氟离子实验:室温、弱酸性条件下,取配制好的菲反应液(弱酸性为pH=5 的磷酸盐缓冲溶液)100 mL 置于250 mL烧杯中,称取0.011 1 g 氟化钠加入到菲反应液,使得溶液中氟离子质量浓度为50 mg/L,加入高铁酸钾储备液,在固定的时间点取样,过滤,测定氟离子浓度及菲浓度。
1.4 分析方法及数据统计分析
菲浓度测定:采用荧光分光光度计,取Ex 波长250 nm,Em 波长300 nm~500 nm,步长3 nm,扫描速度2 000 nm·min-1[4]。
氟离子浓度测定:采用GB 7484—87 所示方法进行检测,缓冲液用柠檬酸三钠配制,盐酸调节pH。
每个样品重复测定3 次,数据分析及图形绘制采用OriginPro8.0 进行。
2 结果与讨论
2.1 碱性条件下Fe(Ⅵ)对菲的氧化
当初始pH 值为9、Fe(Ⅵ)投加量为n(PHE)∶n(K2FeO4)=1∶2 时,考察碱性条件下硼砂-盐酸缓冲溶液和非缓冲溶液体系中Fe(Ⅵ)对菲的氧化效果,如图1。可见,在碱性条件下,高铁酸盐对菲的去除率最高为72%。反应前30 s,Fe(Ⅵ)快速氧化菲,且缓冲溶液体系中菲的去除率均大于非缓冲溶液体系中去除率10%以上,30 s 后缓冲溶液体系中菲的去除率大于非缓冲溶液中的约6%~8%。反应时间段内缓冲溶液体系中pH 一直维持在9,非缓冲体系中反应末端pH=9.2。在pH=9 时,高铁酸盐的ORP 值0.70 V,高铁酸盐主要以的形式存在,存在的平衡式主要是解离常数pKa为7.23[7-8]。此时高铁酸盐的稳定性最好,且与菲接触时间较充足,使得碱性条件下菲的降解率较高。此外,硼砂缓冲溶液中,Fe(Ⅴ)和Fe(Ⅳ)可能参与了菲的氧化,提高了高铁酸盐的氧化能力,从而增强了对菲的去除[9]。

图1 pH 为9 时Fe(Ⅵ)对菲的氧化效果
2.2 中性条件下Fe(Ⅵ)对菲的氧化
当初始pH 值为7、Fe(Ⅵ)投加量为n(PHE)∶n(K2FeO4)=1∶2 时,考察中性条件下磷酸盐缓冲溶液和非缓冲溶液体系中Fe(Ⅵ)对菲的氧化效果,如图2。可见,在中性条件小,高铁酸盐对菲的去除率最高为67%。反应前3 s,Fe(Ⅵ)即可快速氧化菲,且在反应时间段内缓冲溶液体系中菲的去除率均大于非缓冲溶液体系中的去除率。反应过程中缓冲溶液体系中pH 值一直维持在7,而非缓冲体系中pH 变化较大,反应末端pH 值为8.7,这一现象可能是由于Fe(Ⅵ)发生水解产生了。在pH=7 时,高铁酸盐主要以的形式存在,存在的平衡式主要是,解离常数为3.5[7-8],因此其稳定性较碱性条件差,加之水解反应,使得对菲的降解速度快但最高降解率稍低于碱性条件。

图2 pH 为7 时Fe(VI)对菲的氧化效果
需要注意的是,磷酸盐缓冲溶液因具有稳定溶液pH、对Fe(Ⅵ)氧化具有惰性、络合Fe(Ⅲ)离子以减少其沉淀并有助于分析仪器的监控等优点而被广泛使用[9-10]。它的加入提高了菲的降解效率,这可能由于磷酸盐络合了Fe(Ⅲ),相对减缓了Fe(Ⅲ)对Fe(Ⅵ)分解的影响,增加了Fe(Ⅵ)发挥高氧化性能的时间[7-12]。
2.3 弱酸性条件下Fe(Ⅵ)及Fe(Ⅵ)/Fenton 体系对菲的氧化
当pH 为5、Fe(Ⅵ)投加量为n(PHE)∶n(K2FeO4)=1∶2 时,考察弱酸性条件下磷酸盐缓冲溶液和非缓冲溶液体系中Fe(Ⅵ)对菲的氧化效果,如图3。可见,在弱酸性条件小,高铁酸盐对菲的去除率最高为62%。与中性条件相似,反应前3s,Fe(Ⅵ)快速氧化菲,且在反应时间段内缓冲溶液体系中菲的去除率均大于非缓冲溶液体系中的去除率。反应过程中缓冲溶液体系中pH 值一直维持在5,而非缓冲体系反应末端pH 值为8.2,这一现象同样可能是由于Fe(Ⅵ)发生水解产生OH-导致的。在pH=5 时,高铁酸盐的存在形式同中性条件,因此其稳定性也较碱性条件差,菲的降解速度快但最高降解率也低于碱性条件。
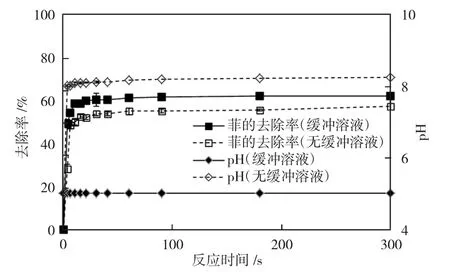
图3 pH 为5 时Fe(Ⅵ)对菲的氧化效果
为提高弱酸性条件下菲的降解率,在高铁酸盐氧化菲后,继续向体系中投加Fenton 试剂,其中,H2O2投加量为0.41 mg/L,FeSO4投加量为0.12 mg/L,形成Fe(VI)/Fenton 体系,考察该体系对菲的氧化效果,如图4。可见,该体系对菲的去除率可达到79%。Fe(Ⅵ)/Fenton 体系能合理利用Fe(Ⅵ)氧化菲产生的Fe(Ⅱ),减少Fenton 反应中Fe(Ⅱ)的投加,既发挥高价态铁的强氧化性,也利用了·OH(通过链式反应的非选择性,同时还可有效提高菲的矿化,使其更易被生物代谢[4]。

图4 Fe(Ⅵ)/Fenton 对菲的氧化效果
2.4 Fe(Ⅵ)/Fenton 体系对氟离子的去除
在弱酸性条件下,将50 mg/L 的氟化钠溶液100 mL 置于250 mL 的烧杯中,加入高铁酸钾储备液,考察Fe(Ⅵ)/Fenton 体系对氟离子的去除,如图5。可见,该体系对氟离子的去除率仅为25%。酸性溶液中的Fe(Ⅵ)和·OH 的ORP 分别为2.20V和2.80 V[15],均低于氟的ORP(2.88 V),因此,在理论上氟离子的氧化率不占主导地位。Wang 等[16]研究表明,在酸性条件下Fe(Ⅵ)自分解产生的弱结晶亚铁水合物可吸附Cd(Ⅱ)等离子,氟离子可能会因Fe(Ⅵ)水解产物的吸附作用而去除。

图5 Fe(Ⅵ)/Fenton 对氟离子的氧化效果
2.5 Fe(Ⅵ)/Fenton 体系对菲和氟离子的协同去除
在Fe(Ⅵ)/Fenton 氧化菲的体系中加入0.011 1 g氟化钠,使得溶液中氟离子浓度为50 mg/L,考察Fe(Ⅵ)/Fenton 协同菲去除氟离子的效果,如图6。可见,该体系协同菲对氟离子的去除率可达到39%,比单独去除氟离子的去除率高14%。协同氟离子对菲的最高去除率仍保持在79%,说明在协同去除氟离子的同时不会影响到菲的去除效果,即氟离子的去除与菲的氧化去除之间无竞争关系。因此,氟离子可能未消耗该体系的氧化能力,氟离子的去除可能是三价铁离子的絮凝吸附作用导致的。研究也证明了高铁炉渣可高效吸附氟化物,且对聚偏氟乙烯中氟的原位吸附率高达99.0%以上[17]。Fe(Ⅵ)/Fenton 氧化菲的过程中发生了菲的羟基化、脱碳、加氢而最终转化为CO2和H2O[4]。Fe(Ⅵ)/Fenton 协同菲去除氟离子,可能是菲的羟基化产物中,羟基的氧原子和氢原子之间的共用电子更多偏向氧,导致氢显正电性,对水中的氟离子产生的吸附作用[18]。
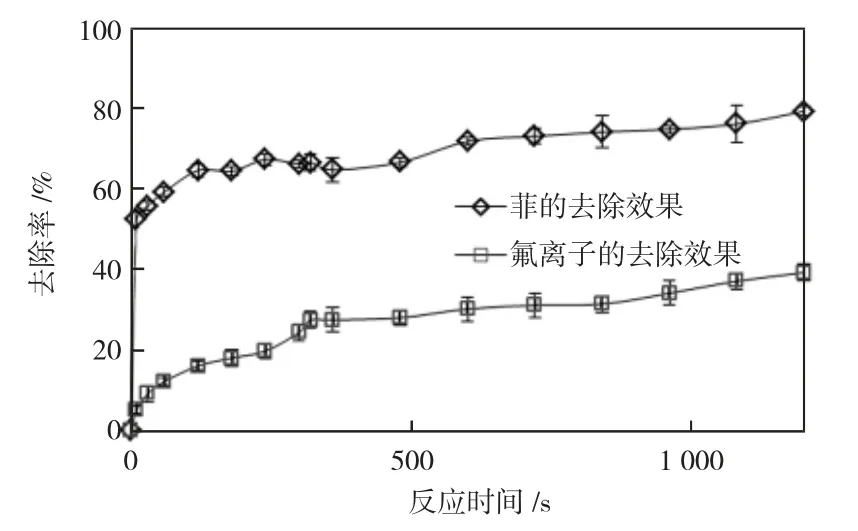
图6 Fe(Ⅵ)/Fenton 对菲和氟离子的协同去除效果
3 结论
1)弱酸性条件下Fe(Ⅵ)对菲的去除率稍差于中性及碱性条件,但该条件下Fe(Ⅵ)/Fenton 体系可提高菲的降解率至79%。
2)无论在碱性、中性、或弱酸性条件下,缓冲溶液均有利于Fe(Ⅵ)对菲的去除,这可能是由于对Fe(Ⅲ)的络合作用相对减缓了Fe(Ⅵ)的分解。
3)Fe(Ⅵ)/Fenton 体系对氟离子的去除仅为25%,但该体系协同菲对氟离子的去除率可达到39%,菲的羟基化产物可能是氟离子去除率提高的重要因素。
4)Fe(Ⅵ)/Fenton 体系中氟离子的去除与菲的氧化去除间无竞争关系,菲的去除受氟离子的影响小。
综上所述,Fe(Ⅵ)/Fenton 体系可实现协同去除焦化废水中的菲和氟离子,反应体系中Fenton 试剂的用量少,过程中无需调节pH 值。该体系对菲的去除主要以氧化作用为主,对氟离子的去除主要以吸附作用为主,且比Fe(Ⅵ)单独去除菲效率高,比该体系单独去除氟离子效果好。
