“丙二酸对琥珀酸脱氢酶竞争性抑制作用”实验的改进及分析★
2022-05-11陈舒丽邓秋红黎威巍金科华刘汉才
陈舒丽,邓秋红,黎威巍,金科华,刘汉才
(湖北科技学院医学部,湖北 咸宁 437100)
酶的抑制剂是与酶结合使酶催化活性降低或消失,但酶分子不发生变性的一类化合物。根据抑制剂与酶是否共价结合,可将酶的抑制作用分为可逆性抑制作用和不可逆性抑制作用[1]。竞争性抑制作用是可逆性抑制作用的一种,即抑制剂与底物竞争同一酶的活性中心,使底物分子无法与酶的活性中心结合,从而抑制酶的活性。竞争性抑制剂的抑制程度取决于抑制剂与酶的相对亲和力和抑制剂与底物浓度的相对比例[2]。当抑制剂浓度不变时,抑制程度随底物浓度的增加而减弱,最终可以通过加大底物浓度,消除竞争性抑制剂的抑制作用[3]。
丙二酸对琥珀酸脱氢酶竞争性抑制作用是生物化学实验里面的一个研究酶的抑制作用的经典实验。琥珀酸脱氢酶是三羧酸循环过程中一个重要的酶,能催化琥珀酸脱氢生成延胡索酸,脱下的2H 由辅基FAD 接受还原成FADH2,然后琥珀酸氧化呼吸链将2H 传递给氧生成水[4]。丙二酸与琥珀酸结构类似,是琥珀酸脱氢酶的竞争性抑制剂,如果有丙二酸存在时,此酶的活性受到抑制。丙二酸与琥酸脱氢酶的亲和力远大于琥珀酸本身对它的亲和力,当丙二酸浓度仅为琥珀酸浓度的1/50 时,酶的活性便被抑制50%[5],因此抑制作用很强。实验中用甲烯蓝(MB)作为受氢体。在隔绝空气的条件下,脱下的氢被蓝色的甲烯蓝接受还原成无色的甲烯白(MBH+H),在总的反应体系体积相同时,通过观察甲烯蓝颜色消退的快慢来衡量反应体系内部脱氢反应的快慢,同时判断丙二酸对琥珀酸脱氢酶活性的抑制程度。
该实验传统做法实验结果欠佳、现象不明显,从而影响了实验成功率。为了更有效、经济地开展该实验,针对以上实际问题,在以往教学研究的基础上,对实验进行了一些改进,并取得了良好的效果。
1 传统的竞争性抑制作用实验
1.1 实验器材
手术剪;玻璃研钵;离心机;恒温水箱。
1.2 实验试剂
1/15 mol/L(pH=7.4)磷酸缓冲液;0.2 mol/L 琥珀酸溶液:称取琥珀酸23.62 g,加蒸馏水溶解后定容至1000 mL;0.02 mol/L 丙二酸溶液:称取丙二酸22.92 g,加蒸馏水溶解后定容至1 000 mL;0.01%甲烯蓝溶液;液体石蜡。
所用磷酸盐、琥珀酸、丙二酸、甲烯蓝等试剂均为市售化学纯,天津市科密欧化学试剂有限公司。
1.3 实验步骤[6]
取小白鼠一只,颈椎脱臼法处死,取出肝脏,约1.5 g,加入7 mL pH=7.4 磷酸缓冲液,充分研磨至糊状。将肝匀浆离心,取上清液备用,此即含琥珀酸脱氢酶的肝糜液。取试管5 支,按第8 页表1 操作。
将上述各管摇匀,于各管滴加液体石蜡隔绝空气(第8 页图1),置37℃水浴中保温,随时观察各管甲烯蓝褪色情况,记录时间。

图1 反应前各管颜色
1.4 实验结果
按表1 操作,重复3 次,实验结果见第8 页图2(第一支试管完全褪色时拍摄)。

图2 各管颜色变化情况

表1 酶的竞争性抑制作用
各管开始褪色,时间见表2,37℃水浴后开始计时。褪色时间依次延长,反应最快的第一支试管在水浴20 min 后开始褪色。
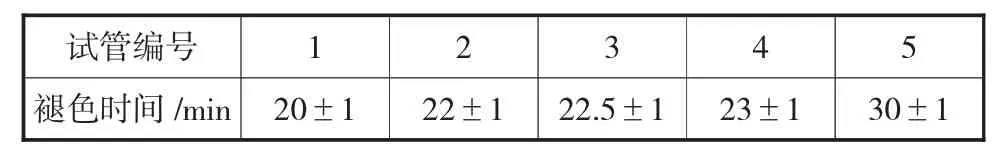
表2 各试管开始褪色时间
1.5 实验分析
随着抑制剂浓度的增大,酶的活性逐步降低,5支试管褪色时间依次延长,与理论分析相一致。
1.6 实验缺陷
在传统实验过程中,由于未将琥珀酸和丙二酸溶液的pH 调至7.4,因此在各试管中加入了pH=7.4的磷酸缓冲液来调节溶液的pH 及整个反应体系的体积。但是加入磷酸缓冲液后,各个试管的pH 不尽相同且偏低。经测定,5 支试管的pH 分别为6.3、6.1、6.6、6.4、和6.9。pH 不同,导致酶的催化活性不同;pH 偏低,导致酶的活性下降。而且由于磷酸缓冲液加入体积较大,导致肝糜液中酶的浓度降低,所以催化速度较慢,各试管褪色时间较长。尽管试管1 中未加抑制剂,但退色完全时仍长达20 min。长时间观察,容易产生视觉疲劳,且更易产生烦躁情绪,不利于实验的开出。
2 竞争性抑制实验的改进
2.1 实验器材
实验器材同1.1。
2.2 实验试剂
1/15 mol/L(pH=7.4)磷酸缓冲液;0.2 mol/L 琥珀酸溶液(pH=7.4):称取琥珀酸23.62 g 加蒸馏水600 mL,用5 mol/L NaOH 调pH 至7.4,再加蒸馏水至1000 mL;0.02 mol/L 琥珀酸溶液(pH=7.4):0.2 mol/L琥珀酸溶液(pH=7.4)稀释10 倍;0.2 mol/L 丙二酸溶液(pH=7.4):称取丙二酸22.92 g,加蒸馏水600 mL;用5mol/LNaOH 调pH 至7.4,再加蒸馏水至1000mL;0.02 mol/L 丙二酸溶液(pH=7.4):0.2 mol/L 丙二酸溶液(pH=7.4)稀释10 倍;0.01%甲烯蓝溶液;液体石蜡。
所用磷酸盐、琥珀酸、丙二酸、甲烯蓝等试剂,均为市售化学纯,天津市科密欧化学试剂有限公司。
2.3 改进的竞争性抑制实验的过程
肝糜液的制备同1.3。取试管5 支,按表3 操作。
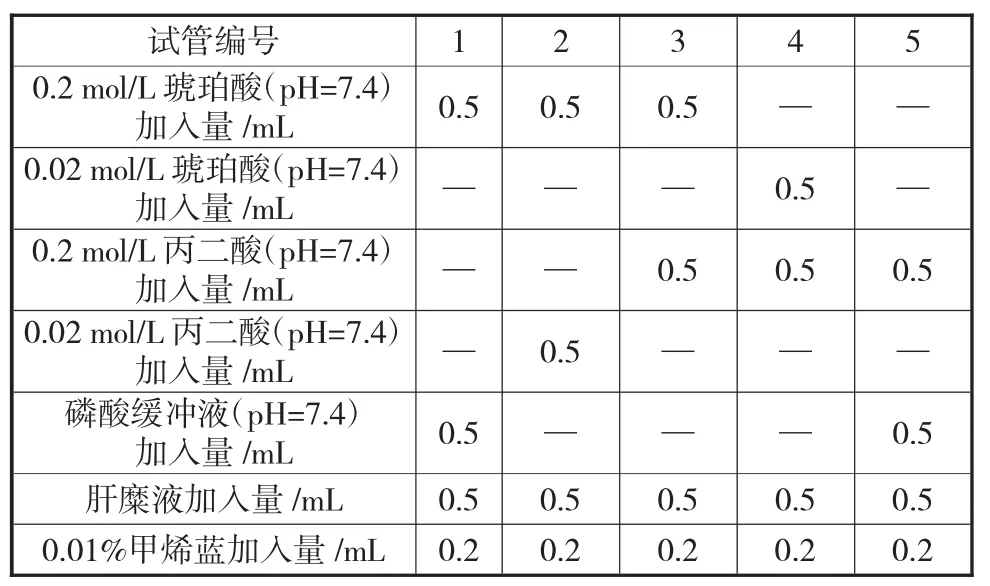
表3 改进的酶的竞争性抑制作用
将各管摇匀,加石蜡封住液面(图3),放入37℃水浴保温,记录时间。

图3 反应前各管颜色
2.4 实验结果
按表3 操作,重复3 次,实验结果见第9 页图4(第一支试管完全褪色时拍摄)。从图4 中可以看到,5 支试管依次褪色,梯度明显。1 号试管蓝色完全褪去;2 号试管还有少许蓝色;3、4、5 褪色逐渐减少,颜色越来越深。

图4 各管颜色变化
各管开始褪色时间见第9 页表4(37℃水浴后开始计时)。褪色时间依次延长,反应最慢的第5 支试管在水浴后15 min 开始褪色。
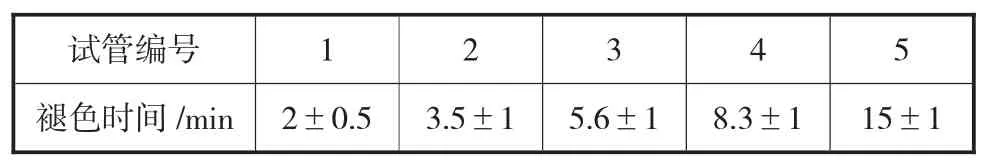
表4 各试管开始褪色时间
2.5 实验分析
随着抑制剂浓度的增大,酶的活性逐步降低,5支试管褪色时间依次延长,与理论分析一致。与改进前相比较,时间缩短了近20 min。改进前及改进后统计学分析如第9 页图5,可以看出改进前后时间变化具有明显的差异性。
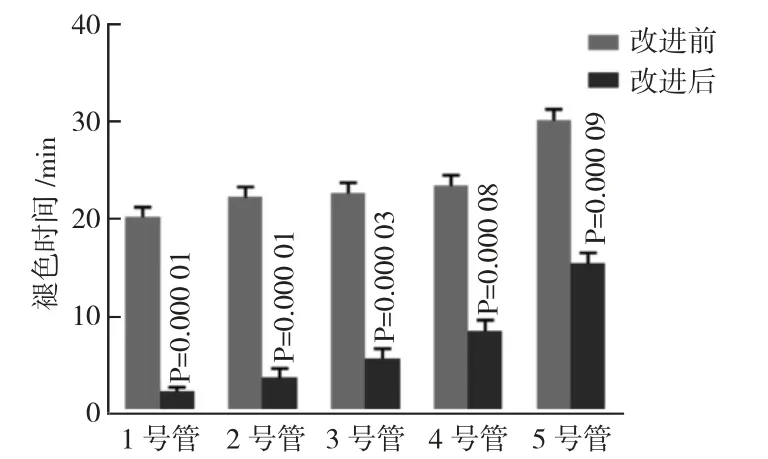
图5 改进前、后各管褪色时间
3 讨论
在改进的实验过程中,第一个改进是将琥珀酸和丙二酸溶液的pH 调至7.4,这样就使整个反应体系的酸碱度维持在pH=7.4,使酶在最适pH 下进行催化,保证了酶的最高活性,因此各管反应速度明显增快,褪色时间变短,每支试管开始褪色时间都比原来提前了将近20 min。此项改进将实验时间缩短,学生不易产生视觉疲劳和烦躁情绪,有利于实验的开出。
本项实验的第二个改进是将肝糜液的加入量减少,由原来的1.0 mL减至0.5 mL。经笔者反复实验,发现用0.5 mL的肝糜液就可将甲烯蓝完全还原,溶液由蓝色变成肉红色。在传统实验中,一只小鼠只能供一组实验使用,经过改进,一只小鼠可以供两组实验使用。此项改进既节省了原材料和试剂的用量,又减少了经费的支出,同时培养了学生节约的意识。
本项实验的第三个改进是加大了底物与抑制剂的浓度比。丙二酸对琥珀酸脱氢酶的亲和力较大,当丙二酸浓度仅为琥珀酸浓度的1/50 时,酶的活性便被抑制50%。在传统的实验中,第2、3、4 试管中琥珀酸与丙二酸的浓度比分别为20∶1、10∶1 和5∶1,在改进的实验中,浓度比分别为10∶1、1∶1 和1∶10。二者的浓度比达到1∶10 时,也能观察到抑制作用,更好地体现了丙二酸对琥珀酸脱氢酶的抑制作用。
本项实验的第四个改进是将甲烯蓝定量,由4滴改为0.2 mL。由于滴管口径大小不同,每一滴的量也不同。加入不同量的甲烯蓝,可能会导致各试管褪色时间产生较大误差。经笔者反复实验,发现0.2 mL比较合适,不仅可以完全接受琥珀酸脱下的氢,而且也不存在过量问题,经过一段时间之后,各试管均能褪色。
另外,第5 支试管没有底物,理论上不褪色,为何经过一段时间后也开始褪色(如图6)。笔者认为是由于肝脏里面存在一定量的琥珀酸和其他的脱氢反应。由于肝脏是从活体组织取出,且所处体系pH=7.4,跟体内环境相差不大,所以细胞内的一些代谢活动仍在进行。因此第5 支试管即使不加底物,最终也会褪色。至于要加多少丙二酸才能完全抑制酶的活性,溶液不会褪色,笔者同样进行了多次实验,发现当0.2 mol/L 丙二酸加至1 mL,即丙二酸浓度达到0.1 mol/L 时,溶液便不再褪色。

图6 反应完毕各试管褪色情况
4 结语
经过上述优化,丙二酸对琥珀酸脱氢酶的竞争性抑制作用的实验教学取得了良好的效果。实验设计更加科学化、合理化,实验成本减小,实验成功率也得以提高。
