PPARD通过JAK2/STAT3信号通路对急性髓系白血病细胞增殖的作用
2022-05-11徐艳朋施晓琦蒋学琴李纯莎吴柳松何志旭
李 雪,黄 佩,徐艳朋,施晓琦,蒋学琴,李纯莎,吴柳松,陈 艳,何志旭
(1.贵州省儿童医院,遵义医科大学附属医院 小儿内科,贵州 遵义 563099;2.贵州省儿童医院,遵义医科大学附属医院 小儿外科,贵州 遵义 563099;3.遵义医科大学组织损伤修复与再生医学省部共建协同创新中心,贵州 遵义 563099)
急性髓系白血病(Acute myeloid leukemia,AML)是骨髓造血干/祖细胞恶性疾病,5年生存率低于30%[1-2]。近年来,虽然AML的治疗方案有很大改进,临床缓解率也得到了相应的提高,却依旧存在耐药、复发导致死亡率高的问题[3-4]。因此,寻找其发病机制尤为重要。过氧化物酶增殖物激活型受体δ(Peroxisome-proliferator-activated receptorβ/δ,PPARD)属于核受体转录因子[5],在多种实体瘤中出现高表达,促进肿瘤的进展[6-7]。Janus激酶/信号转导与转录激活子(The Janus kinase/signal transducer and activator of tran-ions,JAK/STAT)信号通路广泛参与细胞增殖、分化、凋亡以及炎症等过程,可促进包括AML在内的多种肿瘤的发生、发展[8-9]。文献报道了在慢性淋巴细胞白血病 (Chronic lymphocytic leukemia,CLL)细胞中PPARD促进STAT3的表达,而拮抗JAKs可抑制此过程[10],说明PPARD与JAK-STAT信号通路存在一定联系。AML中PPARD是否与JAK-STAT信号通路有关尚未见报道。本研究旨在探索PPARD在AML患者中的表达及意义,进一步研究PPARD在AML细胞(THP-1)中是否可通过JAK-STAT信号通路发挥作用,为AML的靶向治疗提供相关依据。
1 材料与方法
1.1 对象 收集2019年5月至 2021年4月就诊遵义医科大学附属医院初次确诊为 AML 的46例患者,其中女性20例,男性26例;中位年龄为 16(10~59)岁。诊断及治疗依据中华医学会制定的儿童急性髓细胞白血病诊疗建议和成人急性髓系白血病中国诊疗的方案[11-12]。选取非血液疾病患者为对照组,共17例,女10例,男7例,中位年龄 20(3~57)岁。取得家属同意,收集骨髓标本2~3 mL,-80℃保存,备用。该研究已通过了我院伦理委员会的审批。人急性髓系白血病细胞株THP-1由北京大学馈赠。
1.2 主要试剂及仪器 β-actin、PPARD、JAK2、STAT3基因引物均由生工生物有限公司合成;PPARD抑制剂(GSK3787)和激活剂(GW501516)购于MedChemExpress公司;PPARD抗体购于abcam公司;JAK2和STAT3抗体购于成都睿雅生物公司;RPMI-1640培养基购买于America Gibco公司;胎牛血清购于Biological Industries公司;RT-qPCR实验耗材均购于TaKaRa 公司;SDS-PAGE配胶试剂盒购买于碧云天公司;PVDF膜购自美国Millipore公司;双色预染蛋白Marker、ECL显影液均购自成都睿雅生物公司;CO2培养箱(型号:3110)购买于America Forma Scientific公司;TDGC2-0.5超净工作台购自上海先锋电器厂;A-5082 酶标仪购自TECAN公司;成像系统、CFX96 TMReal-Time PCR仪购买于America BIO-RAD公司。
1.3 THP-1细胞复苏及培养 在37℃的水浴箱中将装有THP-1细胞的冻存管完全解冻后,在生物安全柜中用移液管吸出细胞悬液,使用含10%的FBS和1%的青霉素、链霉素抗生素的1640培养基悬浮,细胞置于37℃,5%CO2饱和湿度的培养箱中培养。再依据THP-1细胞的生长情况,酌情更换培养基和传代。
1.4 CCK-8法检测细胞增殖 收集状态良好且处于对数期的THP-1细胞,1 000 r/min离心5 min,细胞计数约为5×104个/孔,GSK3787浓度梯度分别为0、0.1、1、5及10 μM,每个浓度梯度设置3个复孔;细胞培养24、48、72 h后,向每孔中加入10 μL CCK-8试剂,在培养箱内孵育1 h,然后酶标仪检测波长设定为450 nm时的细胞OD值,每个时间点重复3次,进行统计学分析。抑制率=[(对照组-实验组)/对照组-空白组]×100%。
1.5 RNA提取及RT-qPCR 收集AML患者及正常对照组骨髓细胞,未干预和GSK3787干预的THP-1细胞,按照TRIzol试剂的说明书提取细胞总RNA。按TaKaRa逆转录试剂盒说明书合成所需cDNA,-80℃冻存备用。PPARD、JAK2、STAT3基因及内参基因(β-actin)的引物序列(见表1)。PCR反应体系(cDNA 1 μL,上下引物各0.4 μL,荧光试剂:5 μL,补水至10 μL。反应条件:95℃预变性(30 s),95℃变性(5 s),60℃退火(30 s),40个循环后72℃延伸(3 min),PPARD、JAK2、STAT3 的mRNA相对表达量用2-ΔΔCT来表示,ΔCt=目的基因Ct值-管家基因β-actin Ct值,-ΔΔCT=目的标本ΔCt-对照标本ΔCt)。
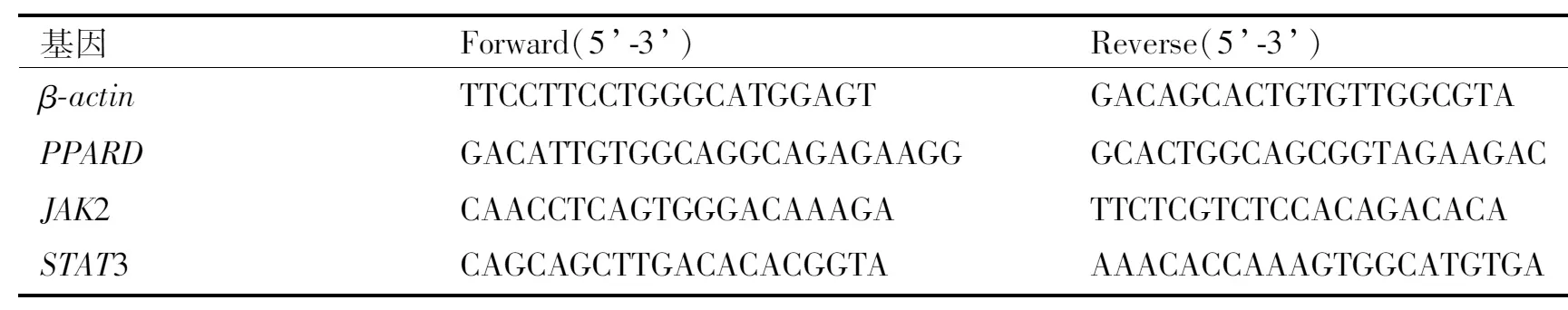
表1 引物序列
1.6 Western Blot检测蛋白水平 收集AML患者和对照组骨髓细胞;THP-1细胞培养至对数期后分组,分为对照组,PPARD激活剂(GW501516)组和抑制剂(GSK3787)组,收集不同组的细胞,在低温条件下提取细胞的总蛋白。用BCA法蛋白定量。每孔蛋白上样60 μg,电泳后将蛋白转移至PVDF膜上,5%脱脂奶粉封闭PVDF膜1.5 h,TBST洗3次后孵一抗并在4℃下孵育至过夜,第2天用TBST再洗3次后孵二抗,在室温下孵育1 h,之后曝光显影,分析显影后的蛋白灰度值用Image Lab软件。目的蛋白的相对表达量用各组蛋白的灰度值与内参的比值来表示。
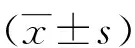
2 结果
2.1 AML患者的PPARDmRNA表达情况 RT-qPCR检测患者和对照组PPARDmRNA表达,结果显示:AML患者PPARDmRNA表达(0.772 9±0.484 0)低于对照组(1.260 8±0.865 1),两组间存在统计学差异(P=0.022) ,见图1。
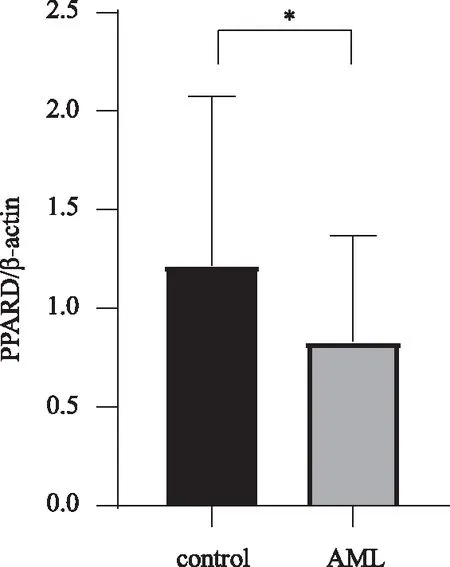
*:与对照组比较,P<0.05。 图1 RT-qPCR检测患者与正常对照组PPARD mRNA表达
2.2PPARDmRNA在AML患者中的意义 为表明PPARDmRNA的表达与AML患者各临床指标之间的相关性,将纳入本研究中的患者临床指标进行分组,分为性别、年龄、外周血幼稚细胞数、外周血白细胞数,骨髓幼稚细胞百分比、肝脾肿大、FAB分型组,对不同组别内PPARD表达水平进行分析和统计。结果显示,PPARD与AML患者性别、年龄、FAB分型有关,其中男性患者高于女性,儿童高于成人,M2高于M4/5(P=0.029、0.044、0.014),见表2。

表2 AML患者临床资料分析
2.3 AML患者中PPARD蛋白的表达水平 Western blot检测患者与对照组中PPARD蛋白的表达情况,并用软件分析灰度值计算其表达量。结果显示:AML患者PPARD蛋白表达(0.819 8±0.015 9)水平高于对照组(1.066 0±0.001 4),差异有统计学意义(P=0.037),见图2。
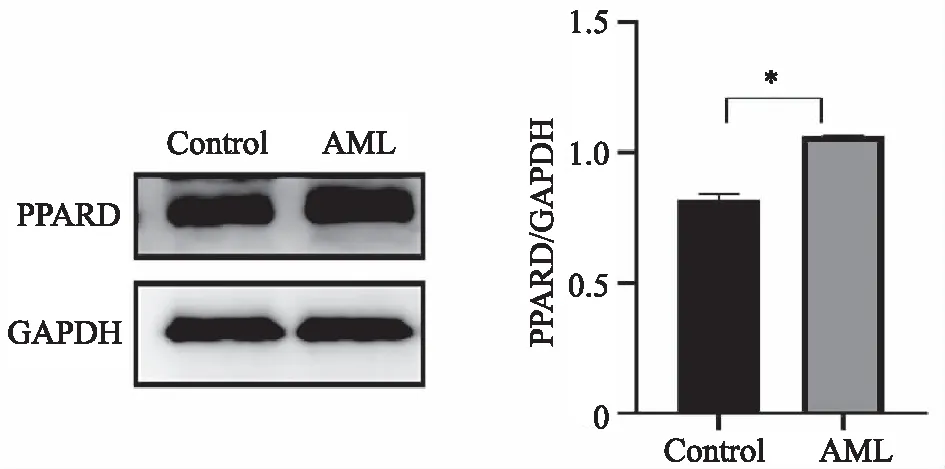
*:与对照组比较,P<0.05图2 AML患者和对照组中PPARD蛋白表达
2.4PPARD抑制剂(GSK3787)对THP-1细胞增殖的影响 通过CCK8法检测使用GSK3787在(0、0.1、1、5、10 μM)浓度作用THP-1细胞3个时间点(24、48、72 h)的增殖抑制情况,结果表明,GSK3787在1 μM浓度作用24 h对细胞增殖抑制作用最明显(见图3);因此,后续实验选1 μM为GSK3787的作用浓度,24 h为作用时间点。
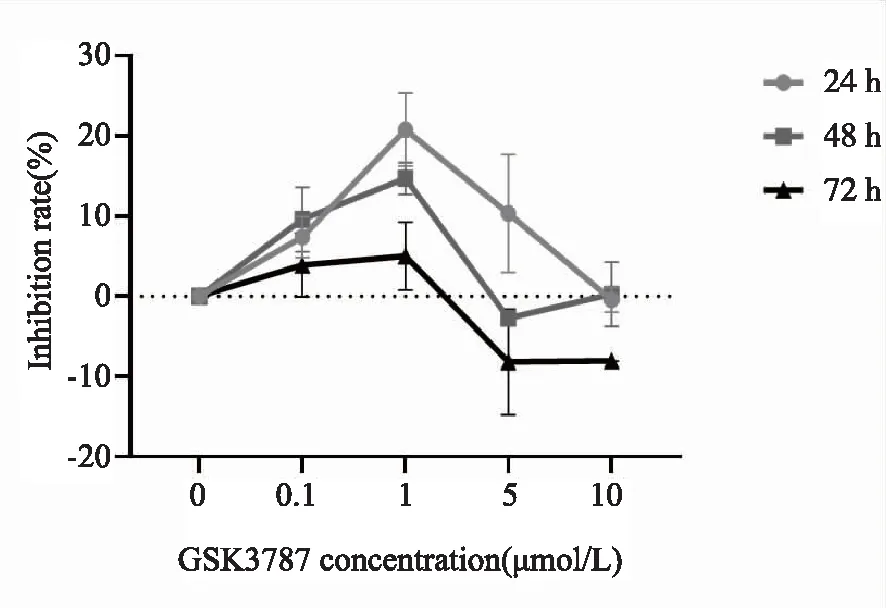
图3 各时间段GSK3787对THP-1细胞增殖的影响
2.5 GSK3787对THP-1细胞PPARD基因和蛋白水平的影响 结果显示:与对照组比较,GSK3787组PPARDmRNA无明显变化(P=0.161),PPARD蛋白表达明显降低(P=0.002)。表明GSK3787抑制PPARD表达成功(见图4)。
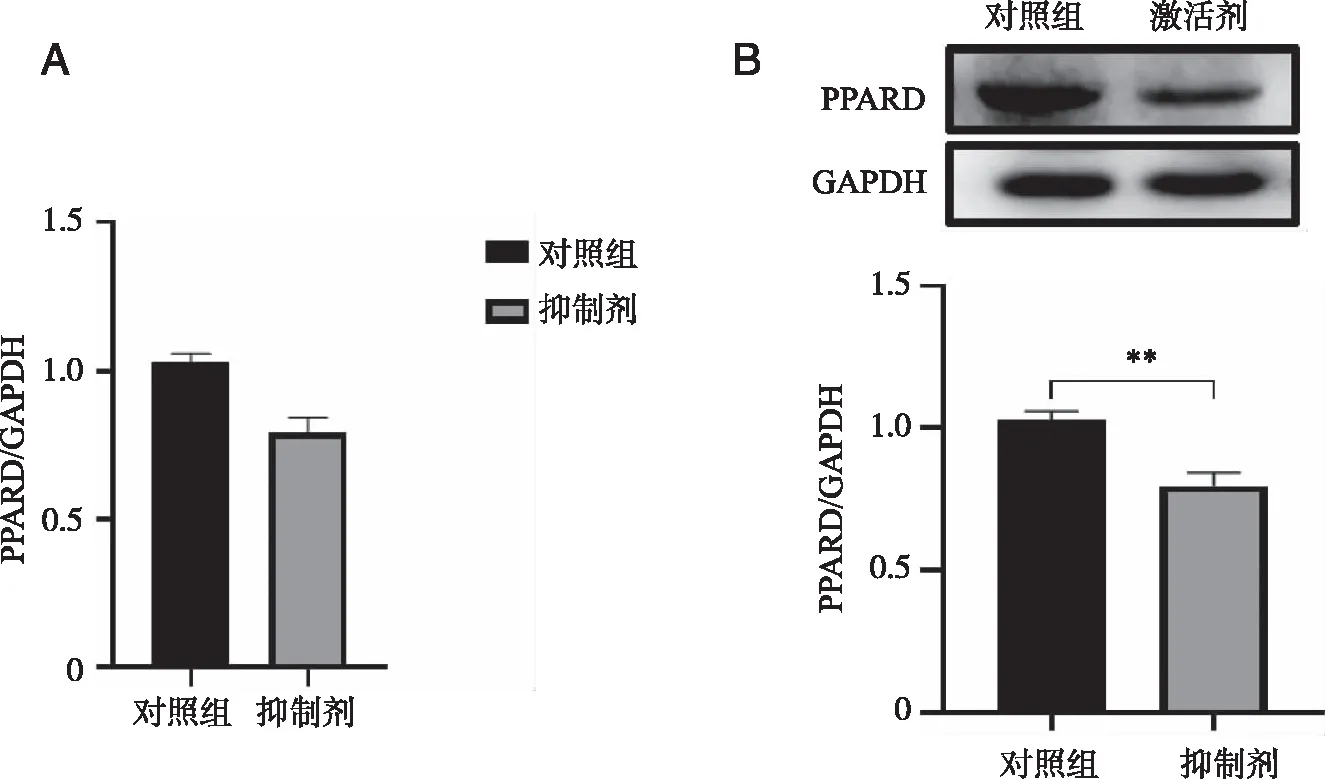
**:与对照组比较,P<0.01;A:mRNA表达情况;B:蛋白表达情况。图4 GSK3787处理后PPARD mRNA和蛋白表达
2.6 GSK3787作用THP-1细胞后对JAK2及STAT3基因及蛋白水平 结果显示:与对照组比较,GSK3787组JAK2、STAT3 mRNA表达均下调(P=0.029、0.042),蛋白表达水平也明显降低(P=0.017、0.004)。表明PPARD表达的下调会抑制JAK2、STAT3的表达(见图5)。
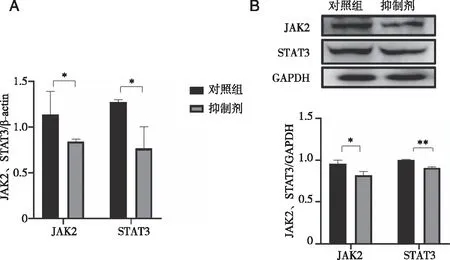
*:与对照组比较,P<0.05; **:与对照组比较,P<0.01;A:mRNA表达情况;B:蛋白表达情况。图5 GSK3787处理后JAK2、STAT3 mRNA和蛋白表达
2.7PPARD激活剂(GW501516)作用THP-1细胞后对PPARD表达的影响 结果显示:与对照组相比,GW501516组PPARD蛋白表达上调(P=0.043),表明GW501516促进PPARD表达(见图6)。

*:与对照组比较,P<0.05图6 GW501516处理后PPARD蛋白表达
2.8 GW501516作用THP-1细胞后对JAK2及STAT3蛋白表达的影响 结果显示:与对照组相比,GW501516组JAK2、STAT3蛋白表达均升高(P=0.013、0.034),提示PPARD的上调会促进JAK2、STAT3的表达(见图7)。
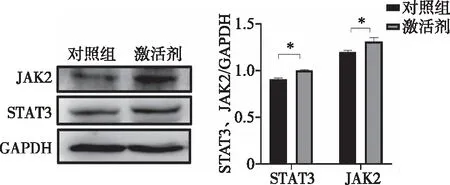
*:与对照组比较,P<0.05图7 GW501516处理后JAK2、STAT3蛋白表达
3 讨论
随着对AML的深入研究,发现许多潜在的生物学机制与其发生、发展紧密相关。本研究中的PPARD是一种以经典域为特征的核受体,作为核转录因子参与正常细胞的分化、发育和代谢,与人体生长发育息息相关,在各种生理活动中具有组织特异性[5,13-14]。PPARD在不同疾病中的作用和意义也存在差异,特别是在肿瘤疾病中[15-16]。PPARD高表达能促进结肠癌和肺癌细胞的增殖,敲低PPARD则降低了细胞活力并增加细胞凋亡[7,17-19]。而另有研究发现,PPARD可抑制人前列腺癌细胞(DU145)的活性,减弱肝癌细胞(HepG2)增殖,增加其凋亡[20-21]。本课题组研究了AML与PPARD表达的关系,结果显示,患者PPARD蛋白表达水平高于对照组,但PPARDmRNA表达却低于对照组,推测PPARD在AML中的表达可能存在转录后调控的机制。Roche等[22]研究发现,在人子宫颈癌细胞中PPARD也涉及到转录后调控作用。有研究表明,PPAR亚家族成员PPARD可与异二聚体结合形成复合物,这些复合物影响核受体与共调节因子的相互作用或改变染色质来调节目的基因的转录,触发共加压复合物的释放和辅激活复合物与组蛋白乙酰转移酶(HAT)或ATP依赖的核小体重塑活性的募集,这些辅激活物复合物进一步触发组蛋白乙酰化、染色质去浓缩和转录激活,这可能是导致PPARD基因蛋白表达增加的原因[23]。此外,在AML患者中,PPARDmRNA的表达水平结果为女性患者低于男性,成人患者低于儿童,M4/5型患者低于M2型,推测PPARD在AML中的表达可能与性别、年龄及FAB分型有关。
为了进一步探索PPARD在AML中的作用,我们在细胞上进行了相关的研究,结果显示,使用PPARD抑制剂GSK3787后,THP-1细胞增殖受抑制,说明下调PPARD表达会抑制AML细胞THP-1的增殖,但抑制率并未出现浓度依赖性,即在0~1 μM间随浓度增加抑制率升高,但在1~10 μM间随浓度增加抑制率降低,推测在0~1 μM浓度是PPARD的特异性靶标所致,而在1~10 μM浓度除了对PPARD本身的作用外还对其他靶标起了作用,可能出现脱靶效应;或者对THP-1细胞的增殖抑制作用存在量 - 效局限性[24]。但PPARD是通过何种作用途径抑制THP-1细胞的增殖?有研究发现,在CLL中PPARD能促进STAT3的表达,表明PPARD与JAK-STAT信号通路有关联[10]。JAK - STAT信号通路参与了包括AML在内的多种癌症的发生发展[25-26]。近年来,有研究认为JAK2/STAT3信号传导途径可保护肿瘤细胞免于凋亡,使用JAK2抑制剂能逆转其作用;而STAT3也是难治复发性AML患者的潜在靶标[27-28];因此,抑制JAK2、STAT3可能成为AML的靶向治疗方法。本课题组前期研究发现,在AML患者中STAT3基因为高表达,在体外和体内实验中也发现,敲低STAT3后能显著抑制THP-1的增殖和减少小鼠体内成瘤[29-30]。为进一步阐明PPARD是否通过 JAK2/STAT3 信号通路影响AML细胞THP-1的增殖,故本研究在激活PPARD后,JAK2、STAT3蛋白表达均上升;而抑制PPARD后,发现JAK2、STAT3的mRNA及蛋白表达均下调,同时THP-1细胞增殖受抑,这提示PPARD可能通过抑制JAK2、STAT3的表达进而抑制THP-1细胞的增殖。推测PPARD可能通过调控JAK2/STAT3信号通路在白血病细胞中发挥重要作用,但PPARD是如何干预JAK2/STAT3信号通路有待进一步深入研究。
综上所述,AML患者中PPARDmRNA低于对照组,蛋白水平高于对照组,抑制PPARD后,AML细胞增殖受到抑制,推测可能是通过下调JAK2/STAT3 信号通路来发挥作用。说明PPARD与AML的发生发展密切相关,这有望成为临床上治疗AML的可能靶点。
