LHX3 基因调控Sonic hedgehog 信号通路影响原发性肝癌发生和发展的研究
2022-05-10李荣军游忠岚徐春霞杨小丽向洪志杨伟兴
李荣军 游忠岚 徐春霞 王 健 杨小丽 向洪志 杨伟兴
原发性肝癌(以下简称肝癌)是常见的恶性肿瘤,全球范围内肝癌的发病率和病死率呈持续升高趋势,且患者的预后较差,每年约有100 万例肝癌患者死亡[1-3]。目前手术切除仍是治疗肝癌的主要方法,但多数患者确诊时已处于晚期或已发生转移从而失去了手术机会,而化学治疗因受到多种因素(如药物不良反应和耐药性)的影响而效果有限[4]。因此,亟需通过探究肝癌发病机制和分子靶点以期寻找有效且安全的肝癌治疗策略。
LIM基因主要参与调控细胞骨架相关蛋白、蛋白激酶和转录因子的表达, 并在胚胎发育中发挥着重要作用[5],其还参与了多种肿瘤的发生[6]。LHX3 基因为LIM同源盒基因家族成员,在垂体和神经系统发育过程中起着关键的基因调控作用[7]。研究表明LHX3 是预测晚期肝癌患者预后的生物标志物[8]。本研究通过检测肝癌患者肿瘤及癌旁组织中LHX3 表达水平,并构建移植瘤裸鼠模型,从而探究沉默LHX3 表达对肝癌发生、发展的影响,并初步探究了其分子机制。
1 材料与方法
1.1 材料
1.1.1 患者的一般资料 收集2017 年1 月至2019年1 月在泸州市中医医院接受手术治疗的54 例肝癌患者的肿瘤组织及癌旁组织(距离肿瘤边缘>3 cm)。54 例患者中,男性39 例,女性15 例,年龄35~68 岁,平均年龄为(44.81±5.36)岁,所有患者均未曾接受放射治疗、化学治疗、免疫治疗及靶向药物治疗。按照Edmondson-Steiner 病理分级标准,分为Ⅰ级9 例,Ⅱ级13 例,Ⅲ级23 例,Ⅳ级9 例。按照肝癌分化程度,分为高分化17 例,中分化22 例,低分化15 例。上述病理诊断均由2 位及以上经验丰富的病理科医生判定。所有患者均签署知情同意书,本研究经医院医学伦理委员会批准。
1.1.2 实验材料 选取30 只4 周龄SPF 级雌性BALB/c 裸鼠,购自北京维通利华实验动物技术有限公司,体质量为18~20 g,用标准饲料喂养,自由饮水摄食,光照与黑暗环境12 h 交替。人肝癌细胞株HepG2 购自中国科学院细胞库(上海)。主要试剂:Sonic hedgehog(Shh)信号通路激动剂Purmorphamine、Polybrene 试 剂 购 自 美 国Sigma 公司,免疫组织化学染色试剂盒和H-E 染色试剂盒购自南京凯基生物公司,总RNA 提取试剂盒、反转录试剂盒和SYBR®Premix Ex TaqTM Ⅱ试剂盒购自日本TaKaRa 公司,CCK-8 试剂盒、TUNEL 试剂盒和Transwell 小室购自美国Invitrogen 公司,BCA蛋白检测试剂盒和PVDF 膜购自上海碧云天生物研究所,兔抗LHX3、Shh、Gli-l 单克隆抗体购自美国Santacruz 公司,兔抗GAPDH 单克隆抗体和辣根过氧化物酶标记的山羊抗兔 IgG 单克隆抗体购自武汉博士德生物公司。引物合成、NC-shRNA 和LHX3-shRNA 慢病毒载体的构建、包装及效价测定由上海吉凯基因公司完成。
1.2 方法
NC-shRNA 组(转染阴性对照NC-shRNA 慢病毒质粒)、LHX3-shRNA 组(转染LHX3-shRNA 慢病毒质粒沉默LHX3)和LHX3-shRNA+Pur 组(转染LHX3-shRNA 慢病毒质粒后用终浓度为1 μmol/L 的Purmorphamine 试剂处理24 h)。转染时,当细胞感染复数(MOI)为100 时加入5 μg/mL 的Polybrene试剂,培养12 h 后更换为新鲜培养液,用0.5 mg/L的嘌呤霉素持续筛选,期间每隔1 d 换液1 次,2 周后获得稳定转染细胞株。
1.2.2 实时荧光定量PCR 法 使用TRIzol 试剂提取各组HepG2 细胞的总RNA,用紫外分光光度计检测总RNA 的纯度和浓度。用反转录试剂盒将总RNA 反转录为cDNA,并以cDNA 为模板,用SYBR®Premix Ex TaqTM Ⅱ试剂盒采用实时荧光定量PCR(real-time qPCR)法检测LHX3 mRNA 表达量,以β-actin 作为内参。扩增条件:95 ℃ 5 min,循环1 次;95 ℃ 30 s,60 ℃ 30 s,58 ℃ 30 s,共循环38 次。采用2-ΔΔCt法计算LHX3 mRNA 的相对表达量。引物序列见表1。
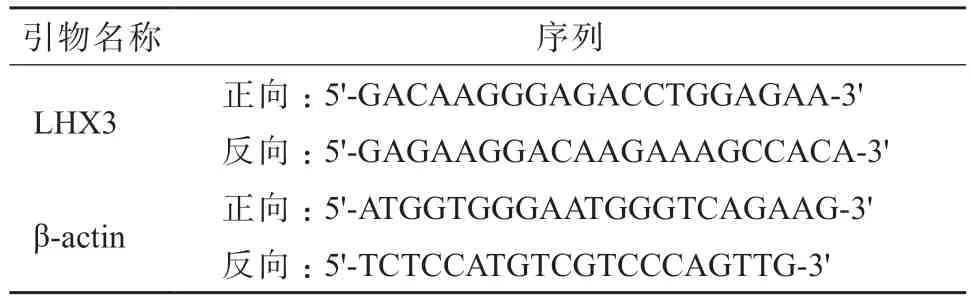
表1 引物序列
1.2.3 CCK-8 法 将各组HepG2 细胞接种于96 孔板(1×104个/孔),置于37 ℃、5% CO2培养箱中过夜培养,每孔设置 3 个复孔,分别于24 h、48 h和72 h 时每孔加入10 μL CCK-8 试剂,混匀后于培养箱中继续培养4 h,用全自动酶标仪在450 nm 处检测各孔细胞的光密度(OD)值。
1.2.4 Transwell 实验 侵袭实验:在Transwell 小室上室中加入50 μL 稀释的Matrigel 胶,置于37 ℃培养箱中40 min。分别吸取100 μL 各组HepG2 细胞悬液(1×106个/mL)加入Transwell 小室上室,下室加入600 μL 含10%胎牛血清的DMEM 培养液,培养至细胞贴壁时,更换为无血清培养液继续培养12 h,置于37 ℃、5% CO2培养箱中孵育12 h,取出小室弃去培养液,轻轻擦去上室多余细胞,用4%多聚甲醛固定15 min,0.1%结晶紫染色10 min,PBS 洗涤后封片,在显微镜下观察并统计侵袭细胞数量。迁移实验:除不加入Matrigel 胶外,其余操作均与侵袭实验相同。
1.2.5 移植瘤裸鼠模型构建 将30 只裸鼠随机分为对照组、NC-shRNA 组和LHX3-shRNA 组,每组10 只,分别接种HepG2 细胞、转染NC-shRNA 慢病毒质粒的HepG2 细胞和转染LHX3-shRNA 慢病毒质粒的HepG2 细胞。细胞用PBS 漂洗并重悬,吸取0.5 mL 细胞悬液(1×107个/mL)在裸鼠右侧腋窝皮下接种(全程接种1 次)。接种后第6 天观察接种部位移植瘤的生长状况,接种后第21天处死裸鼠,解剖取出肿瘤,测量体积并称重,一部分肿瘤用10%甲醛溶液固定,用于H-E 染色、TUNEL 染色及免疫组织化学染色以检测肿瘤组织内细胞生长、凋亡及Gli-1 阳性表达率,另一部分肿瘤置于液氮后保存于-80 ℃冰箱中,用于蛋白质印迹法(Western blotting)检测Shh 和Gli-l 蛋白表达水平。
1.2.6 H-E 染色和TUNEL 染色 取各组裸鼠的肿瘤组织,用10%甲醛溶液固定,脱水、透明,石蜡包埋,然后切成4 μm 厚的切片,切片经脱蜡、脱水后行H-E 染色,脱水、透明后用中性树胶封片,在显微镜下(×400)观察病理变化。将肿瘤组织的石蜡切片脱水后,加入蛋白酶K,37 ℃下孵育30 min,室温下孵育20 min,PBS 冲洗后在切片上滴加TUNEL 检测液,37 ℃孵育1 h,加过氧化物酶转化剂,37 ℃孵育30 min。在切片上滴加DAB 显色,用苏木精复染,脱水、透明后用中性树胶封片,在显微镜下(×400)观察计数TUNEL染色阳性细胞数:随机选取5 个视野(取均值),计数凋亡细胞和肿瘤细胞总数,计算肿瘤细胞凋亡率(肿瘤细胞凋亡率=凋亡细胞数量/肿瘤细胞总数量×100%)。
1.2.7 免疫组织化学染色 将切除的患者肝癌组织、癌旁组织及各组裸鼠的肿瘤组织用4%多聚甲醛溶液固定24 h 后以石蜡包埋,切成4 μm 厚度的组织切片,脱蜡复水后,加入3% H2O2溶液室温孵育10 min,置于4 ℃枸橼酸盐缓冲液中微波高温进行抗原修复,自然冷却,在切片上分别滴加兔抗LHX3 单克隆抗体(1 ∶200)、兔抗Gli-l 单克隆抗体(1 ∶200),4 ℃孵育过夜。次日弃去一抗,PBS清洗切片后滴加辣根过氧化物酶标记的山羊抗兔IgG(1 ∶1 000),室温孵育1 h,PBS 再次清洗后用DAB 显色,自来水冲洗干净,苏木精复染,盐酸乙醇分化,脱水、透明后用中性树胶封片,在显微镜下(×400)观察。细胞质着色呈棕黄色至褐色为阳性细胞。随机选取5 个视野计数细胞(取均值),计算阳性细胞数占总细胞数的百分比即阳性细胞比例并计分:<5%记0 分,5%~25%记1 分,26%~50%记2 分,51%~75%记3 分,>75%记4分。按照细胞质着色强度计分:未着色记0 分,淡黄色记1 分,棕黄色记2 分,棕色至棕褐色记3 分。两项得分的乘积为总分,<4 分判定为免疫组织化学阴性表达,≥4 分判定为免疫组织化学阳性表达。1.2.8 Western blotting 法 在各组HepG2 细胞及研磨后的各组裸鼠肿瘤组织中加入预冷的RIPA 缓冲液裂解后提取总蛋白,采用BCA 法检测蛋白水平。取提取的等量各组HepG2 细胞或各组裸鼠肿瘤组织蛋白样品,用10% SDS-PAGE 分离蛋白质并转移至PVDF 膜,室温下在5%脱脂奶粉中封闭2 h,加入兔抗LHX3(1 ∶1 000)、 Shh(1 ∶1 000)、Gli-l(1 ∶1 000)单克隆抗体作为一抗,以GAPDH 为内参,4 ℃孵育过夜。次日弃去一抗,TBST 洗膜,加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶5 000)作为二抗,室温孵育1 h,TBST 再次洗膜,滴加ECL化学发光液显色曝光,凝胶成像系统拍照,Quantity One 图像分析软件分析各条带的灰度值。
1.3 统计学分析
采用SPSS 21.0 软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
3S技术就是包括遥感技术、地理信息系统和全球定位系统在内的三种测绘技术的统称,而且它的研发是以信息技术为载体,充分融合了空间技术、传感器技术、卫星定位与导航技术以及计算机通讯技术,作为一种新兴的测绘技术已经在建筑工程测量中普及[2]。该技术主要可以实现采集、处理、管理、分析、表达、传播和应用空间信息的目的并进一步推动了社会和科技的进步,对建筑工程测量行业向现代化和自动化发展提供了技术支撑。
2 结果
2.1 肝癌组织和癌旁组织中LHX3 表达水平比较
免疫组织化学染色结果显示,肝癌组织中LHX3 阳性表达率[97.74%(49/54)]较癌旁组织[5.56%(3/54)]明显升高,两者的差异有统计学意义(P<0.05)。见图1。

图1 免疫组织化学染色法检测肝癌组织和癌旁组织中LHX3 表达水平 ×100 A 肝癌组织 B 癌旁组织
2.2 各组HepG2 细胞中LHX3、Shh、Gli-l 表达水平比较
Real-time qPCR 和Western blotting 检 测 结 果显示,与空白对照组比较,LHX3-shRNA 组细胞中LHX3 mRNA 和蛋白相对表达量均显著下降(P均<0.05),NC-shRNA 组 与 空 白 对 照 组 细 胞 中LHX3 mRNA 和蛋白相对表达量的差异均无统计学意义(P均>0.05)。见表2、图2。

表2 各组HepG2 细胞中LHX3 mRNA 和蛋白相对表达量比较(x±s)

图2 Western blot 法检测各组HepG2 细胞中LHX3 蛋白表达水平
Western blotting 检测结果显示,与空白对照组比较,LHX3-shRNA 组细胞中Shh、Gli-l 蛋白相对表达量均显著下降(P均<0.05);与LHX3-shRNA组 比 较,LHX3-shRNA+Pur 组 细 胞 中Shh、Gli-l蛋白相对表达量均显著升高(P均<0.05);NCshRNA 组与空白对照组细胞中Shh、Gli-l 蛋白相对表达量的差异均无统计学意义(P均>0.05)。见表3、图3。
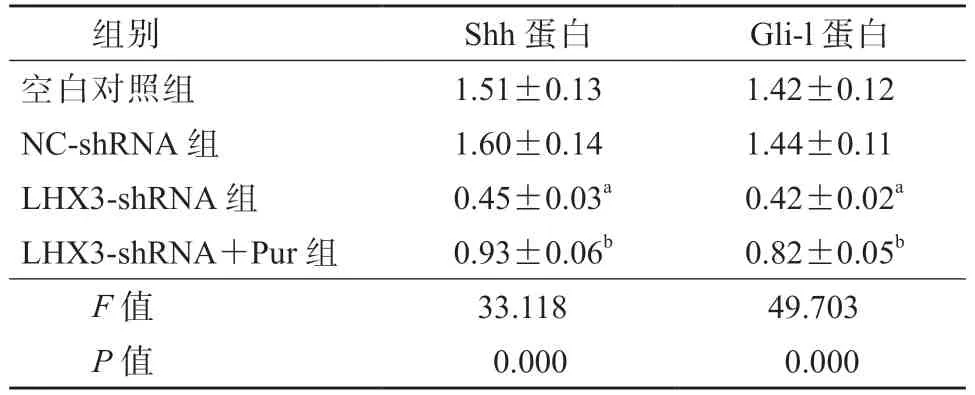
表3 各组HepG2 细胞中Shh、Gli-l 蛋白相对表达量比较(x±s)
2.3 各组HepG2 细胞的增殖能力比较
采用CCK-8 法检测各组细胞的增殖能力,结果显示,与空白对照组比较,LHX3-shRNA 组细胞在培养48 h、72 h 时,OD 值均显著下降(P均<0.05),表明细胞的增殖能力均显著减弱。与LHX3-shRNA组 比 较,LHX3-shRNA+Pur 组 细 胞 在 培 养48 h、72 h 时,OD 值均显著升高(P均<0.05),表明细胞增殖能力均显著增强。NC-shRNA 组与空白对照组的各时间点OD 值差异均无统计学意义(P均>0.05)。见图4。

图3 Western blotting 法 检 测 各 组HepG2 细 胞 中Shh、Gli-l 蛋白表达水平

图4 CCK-8 法检测各组HepG2 细胞的增殖能力
2.4 各组HepG2 细胞侵袭和迁移能力比较
采用Transwell 实验检测各组细胞的侵袭和迁移能力,结果如图5 所示,HX3-shRNA 组的侵袭和迁移细胞数量均较空白对照组显著减少(P均<0.05),LHX3-shRNA+Pur 组的侵袭和迁移细胞数量均较LHX3-shRNA 组显著增加(P均<0.05),NC-shRNA 组与空白对照组的侵袭和迁移细胞数量的差异均无统计学意义(P均>0.05)。

图5 Transwell 实验检测各组HepG2 细胞的侵袭和迁移能力 ×100 A 侵袭实验 B 迁移实验
2.5 各组裸鼠的肿瘤体积及肿瘤细胞生长情况比较
如图6A 所示,LHX3-shRNA 组裸鼠肿瘤的体 积 较 对 照 组 明 显 缩 小[(0.35±0.02)cm3比(0.96±0.08)cm3,P<0.05],湿重较对照组明显降低[(0.25±0.02)g 比(0.45±0.04)g,P<0.05];对照组与NC-shRNA 组裸鼠肿瘤的体积及湿重差异均无统计学意义(P均>0.05)。
肿瘤组织经H-E 染色或TUNEL 染色后在显微镜下观察,如图6B、6C 所示,对照组和NC-shRNA 组裸鼠的肿瘤组织中细胞均较密集,核仁均较厚,细胞凋亡率差异无统计学意义[(8.23±0.68)%比(8.73±0.72)%,P>0.05];与对照组比较,LHX3-shRNA 组裸鼠的肿瘤组织中细胞密度较低,细胞凋亡率[(47.97±3.58)%]较对照组显著升高(P<0.05)。

图6 各组裸鼠的肿瘤体积和肿瘤细胞生长及凋亡情况 A 肿瘤体积 B 肿瘤组织病理图 H-E 染色×400 C 肿瘤组织病理图 TUNEL 染色 ×400
2.6 各组裸鼠肿瘤组织中Shh 和Gli-1 蛋白表达情况比较
免疫组织化学染色结果显示,对照组和NCshRNA 组裸鼠肿瘤组织染色均较深,着色细胞均较多,Gli-l 蛋白阳性表达率分别为(28.42±1.88)%和(30.73±2.27)%,两组的差异无统计学意义(P>0.05);LHX3-shRNA 组 裸 鼠 肿 瘤 组 织 染色较浅,着色细胞较少,Gli-l 蛋白阳性表达率[(18.24±1.23)%]较对照组显著下降(P<0.05)。见图7。

图7 免疫组织化学染色法检测各组裸鼠肿瘤组织中Gli-l 蛋白表达情况 ×200 A 对照组 B NC-shRNA 组C LHX3-shRNA 组
Western blotting 检测结果显示,与对照组比较,LHX3-shRNA 组裸鼠肿瘤组织中Shh 和Gli-l 蛋白相对表达量均显著下降(P均<0.05);NC-shRNA组与对照组裸鼠肿瘤组织中Shh 和Gli-l 蛋白相对表达量的差异均无统计学意义(P均>0.05)。见表4、图8。

表4 各组裸鼠肿瘤组织中Shh 和Gli1 蛋白相对表达量比较(x±s)

图8 Western blotting 法检测各组裸鼠肿瘤组织中Shh、Gli-l 蛋白表达量
3 讨论
肝癌是全球范围内常见的恶性肿瘤,其恶性程度较高,病情进展迅速且容易发生转移,患者的预后较差[2]。肝癌的发病机制涉及多个重要的基因和多条信号通路,具体分子机制尚不清楚。近年来学者们逐渐关注到肝癌在细胞和分子水平的病理学调控机制[9]。本研究对肝癌的发病机制进行了探讨,以期了解参与肝癌发病的关键因子,为寻找特异性靶向治疗方法提供新的思路。
转录因子是通过不同的调控网络影响多种基因表达的全局性调控因子,可影响机体的各种生物学过程和功能。LIM同源盒基因是一类具有LIM结构的基因家族,该基因家族编码的蛋白序列中含有LIM 结构域和同源蛋白序列,其蛋白质翻译产物为LIM 同源盒转录因子,可在多种组织发育和细胞分化中发挥作用[5]。LHX3 基因作为LIM同源盒基因家族的重要成员,是细胞分化过程中的主要调控基因。此外,有研究表明LHX 基因与一些恶性肿瘤相关。Cha 等[10]的研究发现LHX4 表达在结直肠癌中显著上调,可促进肿瘤细胞增殖,并可促使转录因子4(TCF4)与β-连环蛋白(β-catenin)结合形成稳定的LHX4/TCF4/β-catenin 复合物,从而激活下游靶标Wnt/β-catenin 信号通路以促进肿瘤发展。Dietrich 等[11]的研究表明LHX3 的DNA甲基化与乳腺癌明显相关。在本研究中,肝癌组织中LHX3 的表达水平显著升高,表明LHX3 可能参与了肝癌的发生、发展;进一步通过体外实验沉默LHX3 表达以探究其对肝癌细胞生物学行为的影响,研究结果表明,在沉默LHX3 表达后,肝癌细胞的增殖、侵袭和迁移均明显受到抑制。给予裸鼠接种沉默LHX3 表达的肝癌细胞后,肿瘤体积缩小、湿重降低,肿瘤组织中凋亡细胞增多,说明肿瘤的生长受到了抑制。本研究结果表明,抑制LHX3 的异常高表达可阻遏肝癌的发生、发展。
Hedgehog(Hh)是一种分泌性局域蛋白质配体,其在肿瘤中被异常激活,参与肿瘤的发生、侵袭和转移[12]。Shh 信号通路是Hh 通路的重要分支,在细胞增殖和分化中起着至关重要的作用,Shh 通路涉及胚胎发育、维护成熟器官内环境和肿瘤发生等过程[13-16]。Shh 从细胞中输出后能与跨膜蛋白Patched1(PTCH1)结合,促进跨膜蛋白Smoothened(SMO)的活性,激活SMO 启动信号转导级联,活化的SMO 从细胞质隔离中释放出与神经胶质瘤相关的转录因子,进而导致Gli 在核内定位,从而调节各种基因表达[17]。在本研究中,沉默LHX3 表达的肝癌细胞中Shh、Gli-l蛋白表达水平均下降,使用Shh 信号通路激动剂Purmorphamine 处理细胞后,肿瘤细胞的增殖、侵袭和迁移能力增强;在沉默LHX3 表达的肝癌移植瘤裸鼠模型的肿瘤组织中,Shh、Gli-l 蛋白表达水平也下降了。由此推测,LHX3 可能通过调控Shh信号通路参与肝癌的发生、发展。
综上所述,LHX3 在肝癌组织中表达上调,沉默该基因的表达可抑制肝癌细胞的增殖、侵袭和迁移能力,并可抑制裸鼠模型肝癌移植瘤的生长,其机制可能与调控Shh 信号通路相关。本研究表明,LHX3 在肝癌组织中呈高表达,沉默LHX3 表达可抑制肝癌发生和发展,为肝癌的诊治提供了理论依据。
