微小RNA-7调节脑源性神经营养因子/α-突触核蛋白轴对帕金森病细胞模型细胞凋亡的影响
2022-05-09李云单艳华刘永萍赵鹏
李云,单艳华,刘永萍,赵鹏
帕金森病(PD)是仅次于Alzheimer’s病的第二大神经系统退行性疾病,多发于中老年,主要症状是运动缓慢、肌肉僵硬等,对社会和家庭的影响甚大[1]。目前,PD患者不能被治愈,只能采取药物控制,且长时间使用药物会导致患者并发症的产生。以往的研究[2]表明,PD的发展进程与细胞凋亡、氧化应激、线粒体功能障碍关系密切。因此,研究PD的发病机制、寻找合适的靶点对PD患者的临床治疗来说是非常重要的。微小RNA(miR)不仅参与肿瘤细胞的生物学进程,还与PD等神经系统疾病有关,主要参与调控细胞自噬、凋亡等过程。周巍等[3]研究表明,miR-221在PD细胞模型中低表达,过表达miR-221可显著抑制PD细胞模型的凋亡、自噬。刘金泉等[4]研究表明,miR-34a低表达可通过靶向调控沉默信息调控因子1表达,抑制PD模型细胞调亡以及氧化应激损伤。徐向玲等[5]通过实验发现,过表达miR-103a-3p通过靶向钙调蛋白1表达促进MPP+诱导的SH-SY5Y细胞存活并抑制凋亡。miR-7与神经系统疾病的发展有关,其在脑组织中表达升高[6]。有研究[7]表明,α-突触核蛋白(α-syn)的异常表达是导致PD发病的原因之一,miR-7则能调控α-syn的表达水平。然而,目前对于miR-7在PD中的分子作用机制还不完全清楚。据报道[8],脑源性神经营养因子(BDNF)和α-syn均与神经系统发育和PD的发病机理有关。BDNF能够影响海马体的发育,从而对学习和记忆功能产生影响[9]。α-syn过度聚集使细胞通透性增加,从而导致神经元坏死[10]。生物信息学预测发现BDNF是miR-7的潜在靶点,由此推测miR-7可能通过调节BDNF表达影响PD的进程。因此,本研究将通过构建PD细胞模型,探讨miR-7对PD细胞模型细胞凋亡的影响以及其与BDNF和α-syn的作用关系,为进一步研究PD的分子作用机制提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞与主要试剂 人神经母细胞瘤SH-SY5Y购自中国科学院上海细胞库。6-羟多巴胺购自上海源叶生物科技有限公司;1-甲基4-苯基吡啶离子(MPP+)和MTT试剂购自美国sigma公司;RPM1640培养基、胎牛血清购自上海浩然生物技术公司;Lipofectamine 2000转染试剂盒、qRT-PCR试剂盒购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒购自碧云天生物公司;细胞凋亡试剂盒购自北京天根生物公司;引物、miR-7模拟物或抑制物(miR-7 mimics或anti-miR-7)及阴性对照(miR-NC或anti-miR-NC)、BDNF过表达载体/小干扰RNA(pc-BDNF/si-BDNF)及其对照(pcDNA/si-NC)购自上海生工生物公司;兔抗人BDNF、α-syn、线粒体融合蛋白(Mfn2)、核呼吸因子1(NRF1)、微管相关蛋白轻链3(LC3)Ⅰ、LC3Ⅱ、B淋巴细胞瘤(Bcl)-2、Bcl-2相关蛋白(Bax)、裂解的半胱氨酸天冬氨酸蛋白酶(cleaved caspase)-3抗体均购自美国赛默飞公司;辣根过氧化物酶(HRP)标记的二抗购自美国Santa Cruz公司。
1.1.2 实验动物、分组及模型制备 本研究涉及的大鼠实验经过本院动物伦理委员会许可。将购自河南中检检测技术有限公司[许可证号:SYXK(豫)2018-0006]的12只健康SPF级雄性SD大鼠(体重160~180 g)随机分成对照组和模型组,每组6只。
1.2 方法
1.2.1 PD细胞模型的构建 所有大鼠根据Barata-Antunes等[11]采用的单侧6-羟多巴胺注射法构建PD大鼠模型。将人神经母细胞瘤SH-SY5Y细胞在RPM11640培养基中培养,待细胞融合时,加入100 μmol/L MPP+,继续培养24 h,PD细胞模型建立完成[12]。
1.2.2 细胞转染与分组 采用Lipofectamine 2000转染试剂盒对SH-SY5Y细胞进行转染,并将其随机分组为对照组(正常培养,未经MPP+诱导细胞)、MPP+组(100 μmol/L MPP+诱导细胞)、MPP++miR-NC组(miR-NC转染细胞后加入100 μmol/L MPP+诱导)、MPP++miR-7 mimics组(miR-7 mimics转染细胞后加入100 μmol/L MPP+诱导)、MPP++si-NC组(si-NC转染细胞后加入100 μmol/L MPP+诱导)、MPP++si-BDNF组(si-BDNF转染细胞后加入100 μmol/L MPP+诱导)、miR-NC组(miR-NC转染细胞)、miR-7 mimics组(miR-7 mimics转染细胞)、anti-miR-NC组(anti-miR-NC转染细胞)、anti-miR-7组(anti-miR-7转染细胞)、MPP++miR-7 mimics+pcDNA组(miR-7 mimics与pcDNA共转染细胞后加入100 μmol/L MPP+诱导)、MPP++miR-7 mimics+pc-BDNF组(miR-7 mimics和pc-BDNF共转染细胞后加入100 μmol/L MPP+诱导)。24 h后,取对数生长期的各组细胞进行下一步实验。
1.2.3 qRT-PCR检测PD大鼠模型与细胞模型中miR-7、BDNF和α-syn mRNA表达水平 造模成功后,将大鼠处死,取出其脑组织,于冰上将大鼠左侧黑质组织迅速分离,将其制备成组织匀浆,离心,取上清液。提取各组黑质组织及细胞总RNA,检测浓度后,将其逆转录成cDNA,并以此为模板,进行PCR扩增。反应体系:2 μl模板cDNA,10 μl SYBR mix,正反向引物各0.4 μl,7.2 μl ddH2O;反应条件:94 ℃预变性3 min,94 ℃变性20 s,59 ℃退火25 s,72 ℃延伸25 s,38个循环。使用2-ΔΔCt方法计算miR-7、BDNF和α-syn mRNA的相对表达水平。所用引物序列见表1。
1.2.4 流式细胞术检测PD细胞模型细胞凋亡 将各组细胞消化、洗涤后,制备成细胞悬液,室温下依次加入Annexin V-FITC和PI,混匀后,检测细胞凋亡情况并计算其凋亡率。
1.2.5 双荧光素酶报告基因实验检测miR-7与BDNF的靶向关系 Target Scan预测显示miR-7与BDNF的存在互补的核苷酸位点。分别构建野生型载体WT-BDNF和突变型载体MUT-BDNF,并将其转染至SH-SY5Y细胞,随机分成四组:WT-BDNF+miR-NC组、WT-BDNF+miR-7 mimics组、MUT-BDNF+miR-NC组、MUT-BDNF+miR-7 mimics组。48 h后,检测各组SH-SY5Y细胞的相对荧光素酶活性。

表1 miR-7、BDNF和α-syn引物序列引物名称序列(5′-3′)miR-7FTGCGGTTCACAGTGGCTAAGRCTCAACTGGTGTCGTGGABDNFFACTATGGTTATTTCATACTTCGGTTRCCATTCACGCTCTCCAGAα-synFGGTGTGGCAACAGTGGCTGAGRAATGCTCCCTGCTCCCTCCACGAPDHFGCAAGTTCAACGGCACAGRGCCAGTAGACTCCACGACATU6FCTCGCTTCGGCAGCACARAACGCTTCACGAATTTGCGT
1.2.6 Western Blotting法检测相关蛋白表达 将各组SH-SY5Y细胞洗涤、裂解后,提取总蛋白,测定浓度后,取20 μg蛋白样品进行电泳,将其转至PVDF膜,室温下,封闭1 h,加入BDNF、α-syn、Mfn2、NRF1、LC3Ⅰ、LC3Ⅱ、Bcl-2、Bax、cleaved caspase-3一抗,4 ℃,培养过夜;加入二抗,2 h后,加入ECL发光试剂显影,并分析各组细胞内蛋白表达水平。
1.2.7 统计学方法 应用SPSS 21.0软件对实验数据进行统计分析,两组间和多组间比较分别采用t检验和单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-7、BDNF和α-syn在PD大鼠模型中的表达水平 见表2。与对照组相比,模型组大鼠脑黑质组织中miR-7、α-syn mRNA表达水平明显降低,BDNF mRNA表达水平明显升高(均P<0.05)。
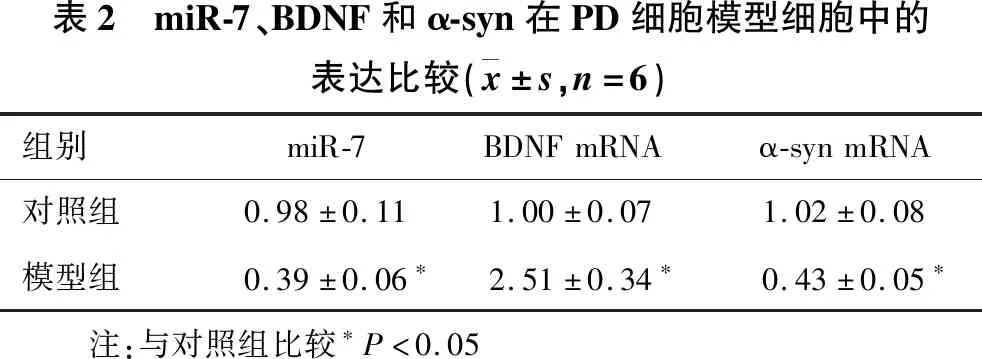
表2 miR-7、BDNF和α-syn在PD细胞模型细胞中的表达比较( x±s,n=6)组别miR-7BDNFmRNAα-synmRNA对照组0.98±0.111.00±0.071.02±0.08模型组0.39±0.06∗2.51±0.34∗0.43±0.05∗ 注:与对照组比较∗P<0.05
2.2 miR-7、BDNF和α-syn在PD细胞模型中的表达水平 见表3。与对照组相比,MPP+组细胞中miR-7、α-syn mRNA表达水平明显降低,BDNF mRNA表达水平明显升高(均P<0.05)。
2.3 过表达miR-7或干扰BDNF表达对PD细胞模型细胞凋亡的影响 见表4。与对照组相比,MPP+组细胞凋亡率明显升高,Bcl-2蛋白表达水平明显降低,而Bax、cleaved caspase-3蛋白表达水平均明显升高(均P<0.05)。与MPP+组、MPP++miR-NC组相比,MPP++miR-7 mimics组细胞凋亡率明显降低,Bcl-2蛋白表达水平明显升高,而Bax、cleaved caspase-3蛋白表达水平均明显降低(均P<0.05)。与MPP+组或MPP++si-NC组相比,MPP++si-BDNF组细胞凋亡率也明显降低,Bcl-2蛋白表达水平也明显升高,而Bax、cleaved caspase-3蛋白表达水平均明显降低(均P<0.05)。
2.4 过表达miR-7或干扰BDNF表达对PD细胞模型细胞中线粒体、自噬相关蛋白表达的影响 见表5。MPP+组细胞中miR-7及Mfn、NRF1蛋白表达显著低于对照组,BDNF、LC3Ⅱ蛋白表达显著高于对照组(均P<0.05);与MPP+组和MPP++miR-NC组相比,MPP++miR-7 mimics组细胞中miR-7及Mfn、NRF1蛋白表达显著升高,BDNF、LC3Ⅱ蛋白表达显著降低(均P<0.05);与MPP+组和MPP++si-NC组相比,MPP++si-BDNF组细胞中BDNF、LC3Ⅱ蛋白表达显著下降,Mfn、NRF1蛋白表达显著升高(均P<0.05)。

表3 miR-7、BDNF和α-syn在PD细胞模型细胞中的表达比较( x±s,n=9)组别miR-7BDNFmRNAα-synmRNA对照组1.00±0.081.01±0.091.00±0.05MPP+组0.41±0.03∗2.44±0.25∗0.45±0.07∗ 注:与对照组比较∗P<0.05
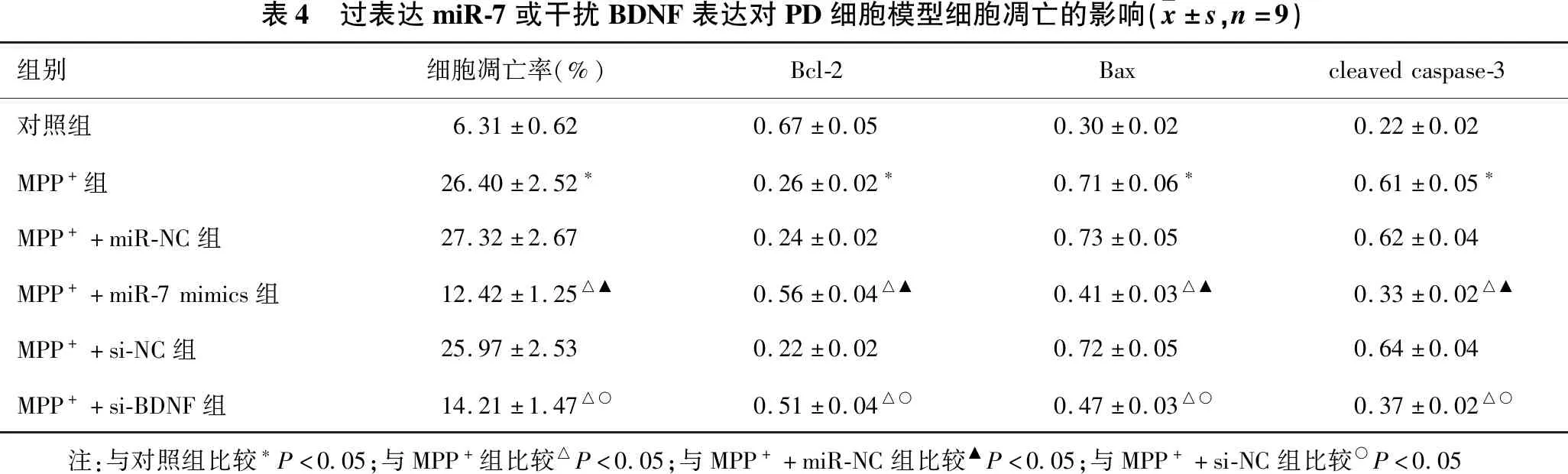
表4 过表达miR-7或干扰BDNF表达对PD细胞模型细胞凋亡的影响( x±s,n=9)组别细胞凋亡率(%)Bcl-2Baxcleavedcaspase-3对照组6.31±0.620.67±0.050.30±0.020.22±0.02MPP+组26.40±2.52∗0.26±0.02∗0.71±0.06∗0.61±0.05∗MPP++miR-NC组27.32±2.670.24±0.020.73±0.050.62±0.04MPP++miR-7mimics组12.42±1.25△▲0.56±0.04△▲0.41±0.03△▲0.33±0.02△▲MPP++si-NC组25.97±2.530.22±0.020.72±0.050.64±0.04MPP++si-BDNF组14.21±1.47△○0.51±0.04△○0.47±0.03△○0.37±0.02△○ 注:与对照组比较∗P<0.05;与MPP+组比较△P<0.05;与MPP++miR-NC组比较▲P<0.05;与MPP++si-NC组比较○P<0.05

表5 过表达miR-7或干扰BDNF表达对PD细胞模型细胞中线粒体、自噬相关蛋白表达的影响( x±s,n=9)组别miR-7BDNFMfnNRF1LC3ⅠLC3Ⅱ对照组0.99±0.070.40±0.030.74±0.060.63±0.050.65±0.050.21±0.02MPP+组0.38±0.03∗0.85±0.07∗0.32±0.02∗0.24±0.02∗0.63±0.040.65±0.05∗MPP++miR-NC组0.35±0.020.87±0.090.30±0.020.22±0.020.61±0.060.66±0.06MPP++miR-7mimics组0.82±0.07△▲0.60±0.07△▲0.63±0.04△▲0.52±0.03△▲0.64±0.030.34±0.02△▲MPP++si-NC组0.39±0.040.84±0.060.28±0.020.21±0.020.62±0.040.68±0.04MPP++si-BDNF组0.41±0.050.51±0.04△○0.60±0.04△○0.48±0.03△○0.59±0.030.38±0.03△○ 注:与对照组比较∗P<0.05;与MPP+组比较△P<0.05;与MPP++miR-NC组比较▲P<0.05;与MPP++si-NC组比较○P<0.05
2.5 抑制miR-7表达对PD细胞模型细胞凋亡的影响 见表6。与MPP+组和MPP++anti-miR-NC组相比,MPP++anti-miR-7组细胞凋亡率明显增加,Bcl-2蛋白表达下调,Bax、cleaved caspase-3蛋白表达上调(均P<0.05)。
2.6 miR-7靶向调控BDNF的表达 Targetscan软件预测结果显示,BDNF是miR-7的潜在靶基因,其结合位点见图1。与WT-BDNF+miR-NC组相比,WT-BDNF+miR-7 mimics组细胞相对荧光素酶活性显著降低(1.00±0.07vs.0.40±0.03)(P<0.05),而MUT-BDNF+miR-NC组和MUT-BDNF+miR-7 mimics组细胞相对荧光素酶活性(1.02±0.08, 1.01±0.08)无显著变化。同时,miR-7 mimics组细胞中BDNF蛋白表达显著低于miR-NC组(0.35±0.03vs.1.01±0.05),而anti-miR-7组BDNF蛋白表达显著高于anti-miR-NC组(2.47±0.06vs.1.00±0.04)(均P<0.05),说明BDNF是miR-7的直接靶基因,且BDNF被miR-7负调控。

表6 抑制miR-7表达对PD细胞模型细胞凋亡的影响( x±s,n=9)组别细胞凋亡率(%)Bcl-2Baxcleavedcaspase-3MPP+组25.69±2.340.23±0.040.68±0.090.57±0.08MPP++anti-miR-NC组26.82±2.130.25±0.030.65±0.070.59±0.05MPP++anti-miR-7组57.35±5.46∗△0.12±0.04∗△0.89±0.15∗△0.78±0.12∗△ 注:与MPP+组比较∗P<0.05;与MPP++anti-miR-NC比较△P<0.05
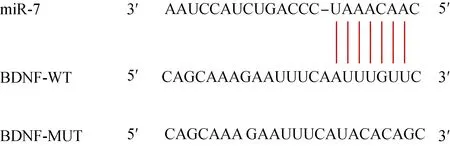
图1 miR-7与BDNF的结合位点
2.7 BDNF过表达逆转了miR-7过表达对PD细胞模型细胞凋亡的影响 见表7。与MPP++miR-7 mimics组和MPP++miR-7 mimics+pcDNA组比较,MPP++miR-7 mimics+pc-BDNF组细胞凋亡率显著升高,Bcl-2蛋白表达显著下降,Bax和cleaved caspase-3蛋白表达显著升高(均P<0.05)。

表7 BDNF过表达逆转了miR-7过表达对PD细胞模型细胞凋亡的影响( x±s,n=9)组别细胞凋亡率(%)Bcl-2Baxcleavedcaspase-3MPP++miR-7mimics组12.64±1.220.57±0.040.40±0.020.32±0.02MPP++miR-7mimics+pcDNA组11.46±1.170.60±0.050.38±0.030.31±0.02MPP++miR-7mimics+pc-BDNF组19.64±0.92∗△0.34±0.02∗△0.63±0.04∗△0.52±0.03∗△ 注:与MPP++miR-7mimics组比较∗P<0.05;与MPP++miR-7mimics+pcDNA组比较△P<0.05
2.8 BDNF过表达逆转了miR-7过表达对PD细胞模型细胞中线粒体、自噬相关蛋白表达的影响 见表8。与MPP++miR-7 mimics组和MPP++miR-7 mimics+pcDNA组比较,MPP++miR-7 mimics+pc-BDNF组细胞中BDNF、LC3Ⅱ蛋白表达明显升高,Mfn、NRF1蛋白表达明显降低(均P<0.05),LC3Ⅰ蛋白表达无明显变化。
2.9 miR-7过表达或miR-7与BDNF共同过表达对PD细胞模型细胞中α-syn蛋白表达的影响 见表9。与对照组相比,MPP+组细胞中α-syn蛋白表达显著降低(P<0.05);与MPP+组和MPP++miR-NC组相比,MPP++miR-7 mimics组细胞中α-syn蛋白表达显著降低(P<0.05);而与MPP++miR-7 mimics组和MPP++miR-7 mimics+pcDNA组比较,MPP++miR-7 mimics+pc-BDNF组细胞中α-syn蛋白表达显著降低(均P<0.05)。

表8 BDNF过表达逆转了miR-7过表达对PD细胞模型细胞线粒体、自噬相关蛋白的影响( x±s,n=9)组别BDNFMfnNRF1LC3ⅠLC3ⅡMPP++miR-7mimics组0.38±0.020.62±0.050.51±0.040.65±0.040.33±0.02MPP++miR-7mimics+pcDNA组0.36±0.020.64±0.040.53±0.030.62±0.040.31±0.02MPP++miR-7mimics+pc-BDNF组0.70±0.06∗△0.40±0.03∗△0.31±0.02∗△0.63±0.030.55±0.05∗△ 注:与MPP++miR-7mimics组相比∗P<0.05;与MPP++miR-7mimics+pcDNA组相比△P<0.05

表9 各组细胞中α-syn蛋白表达比较( x±s,n=9)组别α-syn对照组1.01±0.05MPP+组0.52±0.04∗MPP++miR-NC组0.53±0.05MPP++miR-7mimics组0.29±0.03△▲MPP++miR-7mimics+pcDNA组0.30±0.04MPP++miR-7mimics+pc-BDNF组0.15±0.02○● 注:与对照组比较∗P<0.05;与MPP+组比较△P<0.05;与MPP++miR-NC组比较▲P<0.05;与MPP++miR-7mimics组比较○P<0.05;与MPP++miR-7mimics+pcDNA组比较●P<0.05
3 讨 论
据报道[13],多种因素可引起PD,如遗传、氧化应激、免疫异常等。PD产生的病理基础是路易小体引起的多巴胺能神经元丢失,其中路易小体的主要成分是α-syn[14]。有研究[15-16]表明,PD的发展进程与细胞自噬和凋亡有关,且miRNA能够通过与靶基因结合共同调控细胞自噬和凋亡进而影响PD的发展。Kim等[17]研究显示,短暂局灶性缺血可诱导大鼠模型中大脑miR-7表达下降,并抑制α-Syn的表达丰度。本研究发现,PD大鼠脑黑质组织中miR-7、α-syn mRNA水平显著降低,BDNF mRNA显著升高(均P<0.05)。因此,本研究通过在体外对SH-SY5Y细胞使用目前最常用的PD造模剂MPP+[18]进行诱导建立PD细胞模型,观察过表达或沉默miR-7及抑制BDNF表达对PD模型细胞生物学行为的影响。
细胞凋亡是细胞主动死亡的过程,在维持机体稳态方面发挥着非常重要的作用,而异常凋亡会打破机体的稳态从而导致疾病的发生。Bcl-2、Bax、cleaved caspase-3是调控细胞凋亡过程的标志蛋白。Bcl-2、Bax位于caspase-3的上游,当Bcl-2过量表达时会抑制caspase-3活化,进而减少cleaved caspase-3含量,抑制凋亡[19]。相关研究[20]显示,LC3Ⅱ/LC3Ⅰ比值可反映自噬程度的大小,比值增大,自噬增强。NRF1与Mfn水平的下调可促进线粒体自噬和细胞凋亡,进而加重神经细胞损伤。本研究结果显示,与对照组相比,MPP+组Bcl-2、Mfn、NRF1蛋白表达水平显著下降,细胞凋亡率及LC3Ⅱ、LC3Ⅰ、Bax、cleaved caspase-3蛋白表达水平均明显增加,说明MPP+可促进SH-SY5Y细胞凋亡、线粒体自噬。过表达miR-7后,Bcl-2、Mfn、NRF1蛋白表达水平显著升高,细胞凋亡率及LC3Ⅱ、LC3Ⅰ、Bax、cleaved caspase-3蛋白表达水平均明显降低;而抑制miR-7后细胞凋亡率及Bax、cleaved caspase-3蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低,揭示miR-7过表达可抑制MPP+诱导的SH-SY5Y细胞凋亡和线粒体自噬。
通过Targetscan软件预测发现,BDNF和miR-7有互补的结合位点。抑制BDNF表达可促进精神分裂症大鼠海马神经元细胞增殖并抑制凋亡[21]。而且,有研究[22]表明,BDNF与抑郁症有关,且在抑郁症患者血浆中BDNF表达降低。本研究通过双荧光素酶报告基因实验发现,共转染WT-BDNF和miR-7 mimics的PD细胞模型细胞中荧光素酶活性显著降低,且miR-7过表达后PD细胞模型细胞中BDNF蛋白表达降低,而抑制miR-7表达后BDNF蛋白表达显著升高,说明miR-7直接负调控BDNF蛋白表达。此外,BDNF沉默表达后,PD细胞模型细胞凋亡率及BDNF、LC3Ⅱ、LC3Ⅰ、Bax、cleaved caspase-3蛋白表达水平显著下降,Bcl-2、Mfn、NRF1蛋白表达水平显著升高,提示沉默BDNF表达可降低细胞自噬活性、抑制细胞凋亡。进一步研究表明,BDNF过表达逆转了miR-7过表达对PD细胞模型细胞凋亡、凋亡相关蛋白及线粒体自噬相关蛋白的抑制作用。
α-syn是在大脑中广泛表达的神经元蛋白。已有研究[23]表明,BDNF可与酪氨酸激酶受体B(TrkB)结合来抑制α-syn表达,从而参与PD的发展。Ma等[24]发现α-syn与TrkB的结合受BDNF负调控,海马组织BDNF的下调表达可造成认知障碍。本研究通过Western blotting实验发现,MPP+诱导后SH-SY5Y细胞中α-syn蛋白表达水平降低,miR-7过表达后α-syn蛋白表达水平下降,而miR-7和BDNF同时过表达时α-syn蛋白表达水平也下降。说明miR-7和BDNF负向调控α-syn表达,且BDNF过表达可促进miR-7过表达对α-syn蛋白表达的抑制作用。
综上所述,PD细胞模型的miR-7表达降低,且miR-7可抑制细胞凋亡,其机制可能与下调BDNF对α-syn的抑制作用有关,有望为PD的临床治疗提供新的靶点和思路。
