卡瑞利珠单抗联合仑伐替尼治疗晚期肝癌的临床效果评价
2022-05-09邓泽锋潘丽娟
邓泽锋 潘丽娟
【摘要】 目的:探究卡瑞利珠单抗联合仑伐替尼对晚期肝癌治疗的临床效果评价。方法:选取2019年3月-2020年7月九江市第三人民医院收治的100例晚期肝癌患者,按照随机数字表法将其分为研究1组与研究2组,每组50例。研究1组予以卡瑞利珠+仑伐替尼治疗,研究2组予以卡瑞利珠+索拉非尼治疗。比较两组治疗4个周期的客观缓解率(ORR)和疾病控制率(DCR);比较两组生活质量评分,比较两组1年生存率。结果:研究1组ORR、DCR分别为52.00%、72.00%,均高于研究2组的32.00%、48.00%,差异均有统计学意义(P<0.05)。治疗后1个月,研究1组各维度SF-36评分均高于研究2组,差异均有统计学意义(P<0.05)。研究1组1年生存率高于研究2组,差异有统计学意义(P<0.05)。结论:对晚期肝癌采取卡瑞利珠单抗联合仑伐替尼治疗后,可显著提升疗效,改善生活质量,此方法值得应用与推广。
【关键词】 晚期肝癌 仑伐替尼 卡瑞利珠单抗 生存率
Clinical Study of Camrelizumab Combined with Lenvatinib in the Treatment of Advanced Hepatocarcinoma/DENG Zefeng, PAN Lijuan. //Medical Innovation of China, 2022, 19(09): -157
[Abstract] Objective: To explore the clinical effect of Camrelizumab combined with Lenvatinib in the treatment of advanced hepatocarcinoma. Method: A total of 100 patients with advanced hepatocarcinoma admitted to Third People’s Hospital of Jiujiang City from March 2019 to July 2020 were selected, and they were divided into study group 1 and study group 2 according to random number table method, with 50 patients in each group. Study group 1 was treated with Camrelizumab + Lenvatinib, and study group 2 was treated with Camrelizumab + Sorafenib. Objective response rate (ORR) and disease control rate (DCR) were compared between two groups after 4 cycles of treatment; quality of life scores were compared between two groups, and 1-year survival rate was compared between two groups. Result: The ORR and DCR of the study group 1 were 52.00% and 72.00%, respectively, which were higher than 32.00% and 48.00% of the study group 2, the differences were statistically significant (P<0.05). 1 month after treatment, the SF-36 score of all dimensions of the study group 1 were higher than those of the study group 2, the differences were statistically significant (P<0.05). The 1-year survival rate of study group 1 was higher than that of study group 2, the difference was statistically significant (P<0.05). Conclusion: The treatment of advanced hepatocarcinoma with Camrelizumab combined with Lenvatinib can significantly improve the curative effect and improve the quality of life, this method is worthy of application and promotion.
[Key words] Advanced hepatocarcinoma Lenvatinib Camrelizumab Survival rate
First-author’s address: Third People’s Hospital of Jiujiang City, Jiangxi Province, Jiujiang 332000, China
doi:10.3969/j.issn.1674-4985.2022.09.038
近年來,原发性肝癌(primary hepatic carcinoma,PHC)发病率呈逐年上升趋势,该疾病属于临床常见的消化道恶性肿瘤之一[1]。依据2018年美国癌症协会数据发现,肝癌已归纳为全球第六大常见肿瘤,其死亡率占全球恶性肿瘤的第4位,每年死亡率、新发病例各占78万、84万例[2]。现阶段,临床对PHC发病机制尚未明确,通常认为与黄曲霉毒素、病毒性肝炎、肝硬化及环境因素存在一定联系[3]。但PHC发病隐匿、侵袭性高,多数患者在确诊时已为中晚期,加上常合并有肝硬化,若不经治疗患者平均生存期仅3~6个月,严重危害患者生命健康[4]。我国近80%的肝癌均是因乙肝病毒感染引起的慢性肝炎,进而发展成为肝硬化和肝癌,与国外肝癌的病因(丙肝病毒感染、酒精肝、脂肪肝)有很大的区别。但目前我国晚期PHC的抗肿瘤治疗中,一线标准治疗药物少,可选方案仅有索拉非尼、仑伐替尼和含奥沙利铂的系统化疗[5-6]。临床表现和药物疗效与国外患者差异明显,索拉非尼等治疗客观缓解率低,生存获益有限。本研究采用卡瑞利珠单抗联合仑伐替尼治疗晚期肝癌,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年3月-2020年7月九江市第三人民医院收治的100例晚期肝癌患者。纳入标准:(1)经肝组织学或肝外组织学证实为肝细胞癌。(2)肝内实性占位,除血管瘤等良性病变及转移性肝癌外并具以下条件之一:①甲胎蛋白(alpha fetoprotein,AFP)>200 mg/mL;②典型原发性肝癌影像学表现2项,同期多排CT增强扫描、动态对比增强MRI检查、超声造影中至少两项增强影像学检查阳性结果,显示肝脏占位在动脉期快速不均质血管强化(arterial hypervascularity),而静脉期或延迟期快速洗脱(venous or delayed phase washout),超声造影呈快进快退表现;③无黄疸而碱性磷酸酶(alkaline phosphatase,ALP)或γ-谷氨酰转肽酶(γ-glutamyltranspeptidase,γ-GT)明显升高;④远处有明确转移性病灶或有血性腹水或在腹水中找到癌细胞;⑤明确乙型肝炎标志阳性的肝硬化[7]。(3)均给予肝切除术治疗,且术后患者血常规、肝肾功能、甲状腺及心肺功能检查均正常,无免疫及靶向治疗禁忌证。排除标准:(1)有严重心肺功能疾患或免疫性疾病不能耐受免疫及靶向治疗。(2)因其他特殊原因不能按时、规律、全程服药。(3)预计生存期<3个月。按照随机数字表法将其分为研究1组与研究2组,每组50例。本研究经过本院伦理委员会批准,患者均知情同意。
1.2 方法 所有研究对象均给予提供的卡瑞利珠单抗(生产厂家:苏州盛迪亚生物医药有限公司,批准文号:国药准字S20190027,规格:200 mg)200 mg/次,静脉滴注,每3周一次,3周为一个周期。研究1组联合仑伐替尼(生产厂家:Eisai Co.Ltd,批准文号:国药准字H20180052,规格:4 mg)8 mg/d,1次/d;研究2组给予索拉非尼(生产厂家:Bayer AG,批准文号:H20160201,规格:0.2 g/支)400 mg,2次/d,每3周为一个周期。应持续治疗至疾病进展或出现不可耐受的毒性反应。使用RECIST在第24周之前每6周评估一次客观缓解,之后每12周评估一次。患者疾病进展(progression of disease,PD),但仍能从治疗中获益可继续接受治疗,并在4周后重新接受评估。卡瑞利珠+索拉非尼、卡瑞利珠+仑伐替尼,治疗在出现≥3级治疗相关不良反应(treatment related adverse reactions,TRAE)后暂停,直至毒性降至≤1级。如果需要>4周的治疗延迟,则停用索拉非尼或仑伐替尼。禁止卡瑞利珠单抗剂量调整。
1.3 观察指标及判定标准 (1)比较两组近期疗效。治疗4个周期进行评估,完全缓解(CR):肿瘤完全消失,>1个月未复发;部分缓解(partial remission,PR),肿瘤缩小≥50%,>1个月未见增大;稳定(steady,SD):肿瘤缩小<50%,1个月内增大≤25%;进展(progress,PD):肿瘤增大>25%或出现新病变。客观缓解率(objective mitigation rate,ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%[8]。(2)比较两组治疗前和治疗后1个月的生活质量。使用生活质量评估量表SF-36评估每组患者生活质量水平,对比每组患者生活质量得分,生活质量量表分别从社会功能、生理职能、精神健康、生理功能、一般健康状况、情感职能、躯体疼痛及精力方面进行评估,每项满分100分,最终得分越低则表示患者生活质量水平越低[9]。(3)比较两组1年生存率。
1.4 统计学处理 采用SPSS 19.0统计软件,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料用率(%)表示,比较采用字2检验,P<0.05为差异有统计学意义。
2 结果
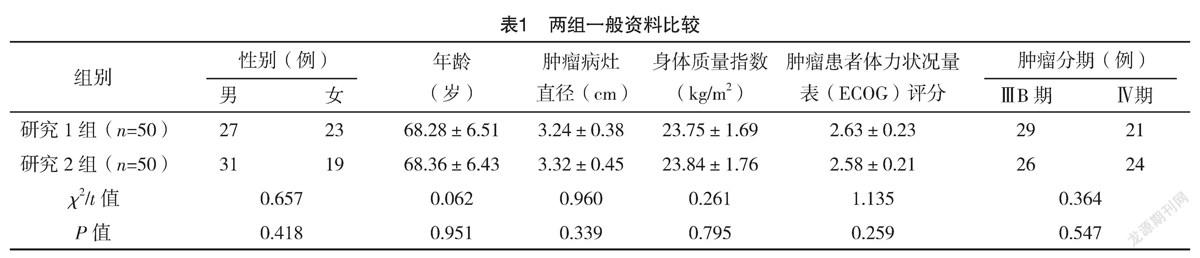
2.1 两组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
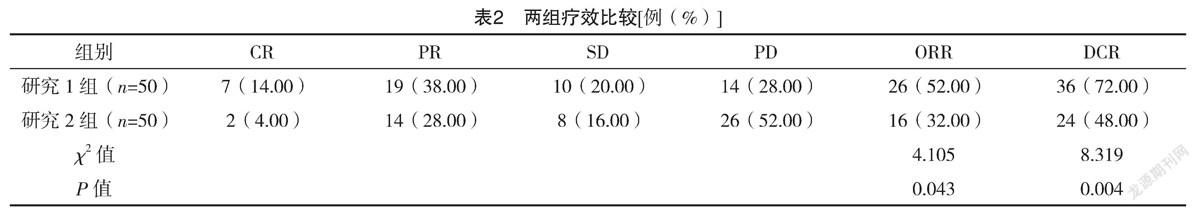
2.2 两组疗效比较 研究1组ORR、DCR分别为52.00%、72.00%,均高于研究2组的32.00%、48.00%,差异均有统计学意义(P<0.05)。见表2。
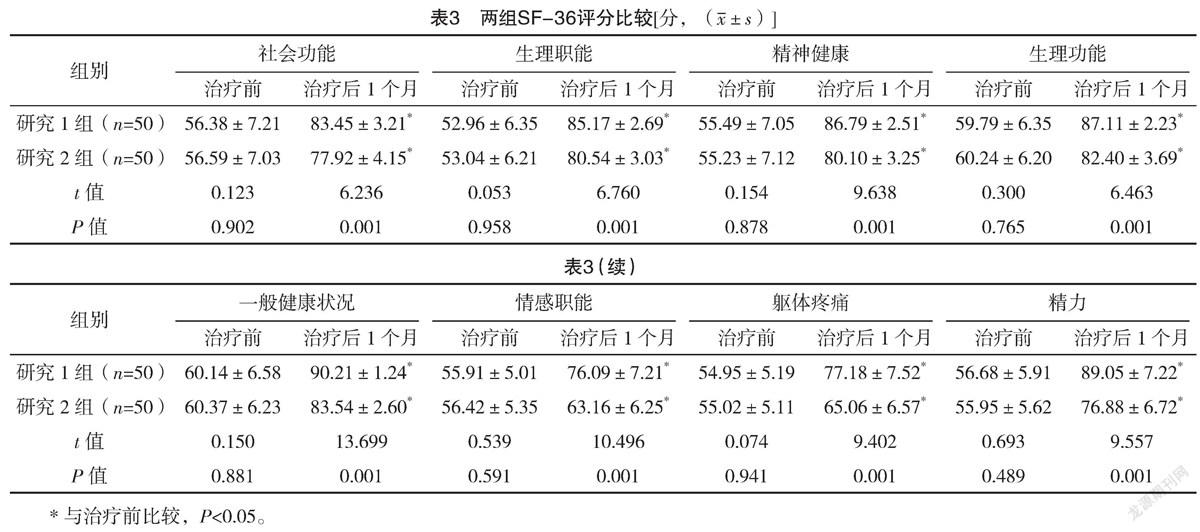
2.3 两组SF-36评分比较 治疗前,两组各维度SF-36评分比较,差异均无统计学意义(P>0.05);治疗后1个月,研究1组各维度SF-36评分均高于研究2组,差异均有统计学意义(P<0.05)。见表3。
2.4 两组生存率比较 研究1组1年生存率为46.00%(23/50),高于研究2组的26.00%(13/50),差异有统计学意义(字2=4.340,P<0.05)。
3 讨论
PHC属于临床常见恶性肿瘤之一,其早期症状以肝区疼痛最为常见,且伴有刺痛、持续性钝痛,主要由肿瘤快速进展,使肝包膜逐渐扩增而造成。相关数据统计,55%以上的PHC患者伴有典型肝區疼痛时,普遍已失去最佳治疗时机,且病灶完全切除率不足30%[10]。
肝癌恶性程度很高,很多患者就诊时已无外科手术指征,即使早期患者能进行外科根治性手术切除,术后5年死亡率也达40%。晚期PHC患者的治疗选择也有限[11]。此外,对局部病灶也可行肝动脉化疗栓塞术、局部消融术等。但这些治疗失败后,缺乏相应的补救措施。基于此现状,针对该病因而展开最新的临床研究显得尤为重要。目前的抗肿瘤一线标准治疗药物少,可选方案有限。一线治疗失败后,二线标准治疗捉襟见肘,且药物可及性差,临床对新的抗肿瘤药物需求十分迫切。与欧美国家肝癌不同,中国约80%的肝癌源于乙型肝炎感染[12]。我国PHC在流行病学特征、分子生物学、临床表现和分期、治疗策略手段、疗效及预后等方面有别于欧美国家和日本[13]。因此,我国PHC治疗不能生搬硬套欧美日的经验,必须基于中国人群取得高级别循证医学证据,从而制订完善的PHC诊疗规范,指导临床实践。阻断PD-1及其配体间的相互作用是晚期肝细胞癌的一种潜在的有效治疗策略[14]。多项研究证实了PD-1抑制剂卡瑞利珠单抗在既往经过治疗的晚期肝细胞癌患者中的抗肿瘤活性和安全性良好。近年来在肝细胞癌治疗领域,靶向和免疫治疗均有突破。多项研究表明,免疫治疗将给肝癌患者带来更多生存选择,同时,由于抗血管生成改善肿瘤微环境在肿瘤免疫治疗中具有显著作用,可以从免疫抑制过渡到免疫支持,因此免疫联合靶向正成为新的研究趋势[15]。本课题研究卡瑞利珠+仑伐替尼的安全耐受性以及联合治疗的效果,研究1组ORR、DCR分别为52.00%、72.00%,均高于研究2组的32.00%、48.00%,差异均有统计学意义(P<0.05)。治疗前,两组各维度SF-36评分比较,差异均无统计学意义(P>0.05);治疗后1个月,研究1组各维度SF-36评分均高于研究2组,差异均有统计学意义(P<0.05)。研究1组1年生存率高于研究2组,差异均有统计学意义(P<0.05)。分析原因卡瑞利珠单抗是一种针对PD-1的人源化单克隆抗体,可靶向结合表达于CD4+及CD8+T细胞、B淋巴细胞等表面的PD-1,阻断PD-1与PD-L1的结合,解除PD-1通路介导的T细胞免疫抑制作用,从而抑制肿瘤细胞的免疫逃逸,重建机体免疫系统监测及杀灭肿瘤细胞的能力,产生持续的抗肿瘤效应。有研究数据表明,对晚期PHC患者而言,仑伐替尼疗效并不劣于索拉菲尼标准治疗,并且仑伐替尼在药物不良反应和患者的药物耐受性方面的表现也与之前的研究结果一致,表现出了较好的稳定性[16]。一些基础研究,仑伐替尼与PD-1/PD-L1抑制剂联用可能会提高PD-1的疗效[17]。在临床前研究中,仑伐替尼降低在肿瘤微环境中被称为免疫调节剂的肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)的数量[18]。通过降低TAM使细胞因子和免疫调节受体的表达水平发生变化,进而促进免疫激活。本研究发现,相比索拉非尼,仑伐替尼结合卡瑞利珠单抗治疗后不仅效果显著,还能提升生活质量。仑伐替尼是一种口服的多靶点酪氨酸激酶抑制剂(TKI),对于激酶的产生有着一定的抑制作用,可作用于血管内皮生长因子受体1~3、成纤维细胞生长因子受体1~4、血小板衍生生长因子受体α等位点,同时能够有效地控制肿瘤的相关变化,其中就包含对于肿瘤细胞的繁殖的控制及抑制肿瘤血管生成致病性等方面,能有效起到抗肿瘤的作用[19-20]。
综上所述,对晚期肝癌采取卡瑞利珠单抗联合仑伐替尼治疗后,可显著提升疗效,改善生活质量,此方法可广泛应用于临床。
参考文献
[1]石丰豪,孟蕊,王子婧,等.卡瑞利珠单抗二线治疗晚期肝细胞癌的成本-效果分析[J].中国卫生经济,2021,40(2):62-65.
[2]袁国盛,何伟猛,胡晓云,等.卡瑞利珠单克隆抗体联合阿帕替尼二线治疗不可切除肝细胞癌的临床疗效及安全性分析:一项多中心回顾性研究[J].中华肝脏病杂志,2021,29(4):326-331.
[3]罗详冲,李高峰.PD-1抑制剂卡瑞利珠单抗在晚期恶性肿瘤中的应用进展[J].解放军医学杂志,2020,45(6):672-679.
[4]佘明金.卡瑞利珠单抗治疗恶性肿瘤的临床研究进展[J].癌症进展,2020,18(9):865-890,900.
[5]朱彦军.阿帕替尼联合卡瑞利珠单抗及化疗治疗晚期恶性肿瘤的观察与护理[J].中国药物与临床,2020,20(17):2967-2969.
[6]张伟,殷海涛,周冲,等.甲磺酸阿帕替尼联合卡瑞利珠单抗治疗原发性肝癌伴肺转移一例[J].国际肿瘤学杂志,2020,47(8):510-512.
[7]姜仲春,谷带利,唐才喜.仑伐替尼治疗肝细胞癌的研究进展[J].中国肿瘤临床,2021,48(7):371-375.
[8]滕颖,丁晓燕,李文东,等.程序性细胞死亡受体1抑制剂联合仑伐替尼治疗晚期原发性肝癌的效果及不良反应[J].临床肝胆病杂志,2021,37(3):606-610.
[9]徐彬,朱小东,黄成,等.仑伐替尼联合程序性死亡受体-1抗体治疗不可切除或进展期肝细胞癌的临床疗效[J].中华消化外科杂志,2021,20(2):197-204.
[10]陈晨,刘海,张新娟,等.仑伐替尼的不良反应信号挖掘与评价[J].实用药物与临床,2021,24(6):557-561.
[11]王慧,顾红燕,彭德明,等.仑伐替尼致不良反应文献分析[J].中国新药杂志,2020,29(14):1675-1680.
[12]袁冰,王燕,張金龙,等.仑伐替尼治疗经肝动脉化疗栓塞术无效的中晚期肝细胞癌患者的临床观察[J].中华医学杂志,2020,100(11):833-836.
[13] COLQUHOUN D A,SHANKS A M,KAPELES S R,et al.
Considerations for integration of perioperative electronic health records across institutions for research and quality improvement: the approach taken by the multicenter perioperative outcomes group[J].Anesthesia & Analgesia,2020,130(5):1133-1146.
[14]宁会彬,李宽,尚佳.免疫治疗新时代下晚期肝癌患者的希望之路[J].中华肝脏病杂志,2021,29(4):301-303.
[15]王媒西,赵圆圆,杨博,等.不同抗肿瘤治疗方法对肝癌肝移植术后复发转移的疗效比较[J].器官移植,2021,12(3):302-308.
[16]肖永胜,郭磊,周俭.原发性肝癌新辅助治疗进展[J].腹部外科,2021,34(1):1-3,9.
[17]郑健豪,戴朝六.复发性肝癌的诊断及治疗策略[J].现代肿瘤医学,2021,29(13):2381-2386.
[18]万雪帅,杜顺达,毛一雷.综合治疗时代晚期肝癌治疗的全局观[J].腹部外科,2021,34(2):92-97,100.
[19] GAWADE P L,BERLIN J A,HENRY D H,et al.Changes in the use of erythropoiesis-stimulating agents (ESAs) and red blood cell transfusion in patients with cancer amidst regulatory and reimbursement changes[J].Pharmacoepidemiology and Drug Safety,2017,26(11):1357-1366.
[20] TOMITA D,CRITCHLOW C W,BERLIN J A,et al.Changes in the use of erythropoiesis-stimulating agents(ESAs)and red blood cell transfusion in patients with cancer amidst regulatory and reimbursement changes[J].Pharmacoepidemiology and Drug Safety,2017,26(11):1357-1366.
(收稿日期:2021-09-22)
基金项目:江西省卫生健康委科技计划项目(SKJP220202287)
①江西省九江市第三人民医院 江西 九江 332000
通信作者:邓泽锋
