基于近红外荧光标记蛋白芯片的多肿瘤标志物联合定量检测技术
2022-05-08王志慧项华中许颖原
王志慧,项华中,郑 刚,许颖原
(1.上海理工大学 上海市介入医疗器械工程研究中心,上海 200093;2.上海萨迦生物科技有限公司,上海 201203)
引 言
恶性肿瘤(即癌症)的发病率、死亡率逐年升高[1],原因是肿瘤在早期并没有明显的临床症状,等到发现时已到了中晚期[2],所以,寻求有效降低死亡率的方法尤为重要。研究表明,早发现、早诊断、早治疗是降低死亡率的有效途径[3-4],然而,常用的检测方法,如CT、核磁共振(MRI)等,不仅对人体存在一定程度的损害,而且检测费用昂贵[5-6],并不适合定期检测。研究发现,血清中肿瘤标志物的定量检测对肿瘤的早期筛查、疗效检测、预后评估等方面具有重要的临床意义[7-8]。肿瘤标志物是指因恶性肿瘤存在或机体对其反应而异常产生或升高的一种特征性物质,在正常人体细胞中没有或者含量很低[9-10],临床上,常把肿瘤标志物的定量检测作为肿瘤诊断的重要辅助手段。由于肿瘤标志物的低特异性,单一肿瘤标志物不足以诊断癌症,而多肿瘤标志物联合检测在成本控制、分析时间、所需样本量等方面存在优势[8,11-13],因此,多肿瘤标志物联合检测分析引起越来越多的关注。
多肿瘤标志物联合检测的分析方法主要有基于电化学发光(ECLIA)的微流控芯片检测法[13]、基于化学发光(CLIA)的多肿瘤标志物蛋白芯片检测系统[14]等。基于电化学发光的微流控芯片检测法多用于即时检测(POCT)领域,可对单人份进行快速检测,整个检测过程时间可控制在15 min内,然而,该方法并不适合大规模人群的检测。基于化学发光的多肿瘤标志物蛋白芯片检测系统采用双抗体夹心的化学发光法检测,兼具化学发光法和蛋白芯片法的优点,即检测背景低、成本低、检测速度快、通量高、所需样本量少等,但因采用化学发光法,存在易受反应环境影响、反应时间难控制等缺点。
免疫荧光分析法(IFA)[15]是肿瘤标志物检测的常用方法之一。IFA是用荧光染料直接标记待测血清中的肿瘤标志物抗原,或用荧光染料标记的二抗与蛋白芯片上的待测抗原结合,然后通过荧光扫描仪对标记的荧光染料激发荧光信号进行分析,最后计算出待测血清中抗原的浓度。目前,IFA中用于荧光标记的多为Cy3、Cy5等处于可见光波段的荧光染料,相比于CLIA具有背景噪声高、易受蛋白质自发荧光的干扰等缺点。由于组织蛋白自发荧光处于可见光范围,在近红外波段有较低的吸收和散射[16],因此,选用光谱处于近红外波段的荧光染料标记肿瘤标志物的蛋白芯片法不仅具有背景噪声低、检测灵敏度高等优点,同时具备通量大、易操作、成本低、特异性高、稳定性好、检测速度快等优点[17]。
生物芯片扫描仪是蛋白芯片检测的重要工具[18],是蛋白芯片检测的一个重要环节,通过检测标记物上荧光信号强度的大小来定量分析血清中肿瘤标志物抗原的浓度。生物芯片扫描仪的性能对检测结果具有重要的影响,在当下市场,并没有专门用于近红外荧光标记蛋白芯片的检测仪器。基于此,根据蛋白芯片的特点及检测需求,研制了用于蛋白芯片检测的生物芯片扫描仪。与市场上存在的电化学发光或化学发光类的检测仪器相比,该扫描仪具有信噪比高、线性范围宽、灵敏度高、分辨率高、使用方便、可减少芯片中多人份样本之间的交叉污染等优点。
本文通过近红外荧光标记蛋白芯片法定量检测血清中的多个肿瘤标志物的含量,实现了多项癌症的一次性筛查。文中详细阐述了近红外荧光标记蛋白芯片多肿瘤标志物的联合定量检测原理,并比较了10例患者血清的4项肿瘤标志物检测与罗氏电化学发光法仪器的检测结果,结果表明二者高度相关。
1 近红外荧光标记蛋白芯片定量检测原理
1.1 近红外荧光标记多肿瘤标志物蛋白芯片免疫分析原理
近红外荧光标记多肿瘤标志物蛋白芯片采用双抗体夹心的近红外荧光标记法检测,在固相载体上按一定的顺序(或方法)包被多种带有不同肿瘤标志物靶标的抗体,捕获被检者血清中对应肿瘤标志物的抗原,再结合生物素化的第二抗体(即二抗),然后与近红外荧光染料标记的链霉亲和素进行非特异性结合,最后通过生物芯片扫描仪检测分析,获得被检者血清中各项肿瘤标志物含量的生物信息,实现血清中多个肿瘤标志物的定量检测。近红外荧光标记多肿瘤标志物蛋白芯片免疫分析原理如图1所示。
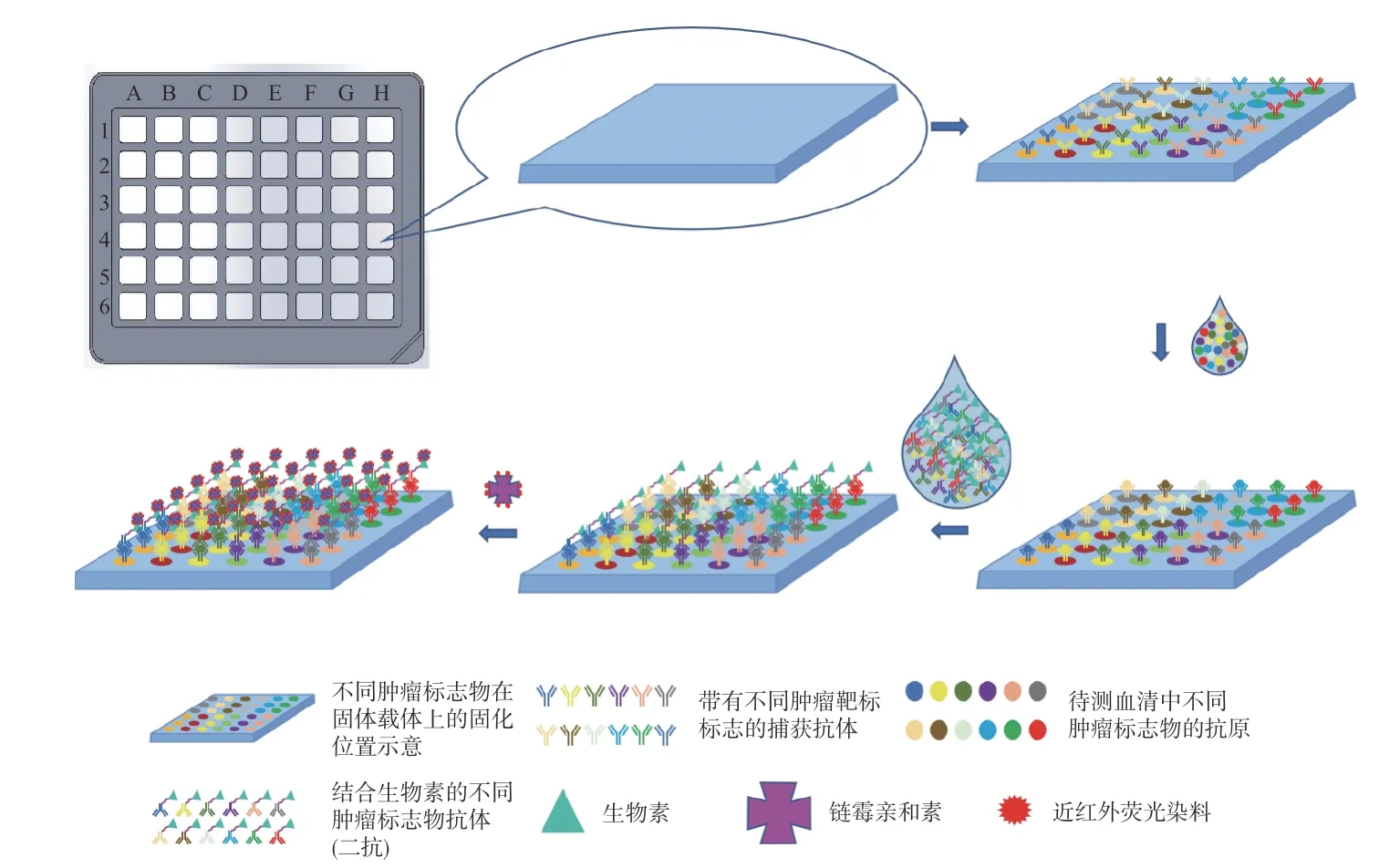
图1 近红外荧光标记多肿瘤标志物蛋白芯片免疫分析原理Fig. 1 The principle of immunoassay for near-infrared fluorescent-labeled multi-tumor markers protein chip
对于多孔板来说,每个孔板内的反应相同。首先,将带有不同肿瘤标志物靶标的捕获抗体固定于修饰过的固相载体的指定位置上,为了提高检测的准确性,带有同样肿瘤标志物靶标的捕获抗体可重复固定几个位置。然后加入待测血清进行孵育,捕获抗体会与血清中相应肿瘤标志物的抗原发生特异性结合,待充分反应后,清洗掉多余的血清,再加入不同肿瘤标志物生物素化的第二抗体(即二抗),二抗与之前抗体-抗原对中的抗原发生特异性结合,形成双抗体夹心结构,待充分的孵育反应后,清洗掉多余的二抗,再加入近红外荧光染料标记的链霉亲和素,链霉亲和素与生物素之间发生非特异性结合,待充分反应后,将多余的链霉亲和素清洗干净。此时,近红外荧光染料的分子数与血清中的肿瘤标志物抗原浓度正相关,荧光染料的发光强度(I)正比于荧光染料分子的摩尔消光系数(ε)、量子产率(Q)以及荧光染料的摩尔浓度(C)[19],即

式中K为常系数。
对于单位体积的近红外荧光染料,其荧光分子数(N)与近红外荧光染料的摩尔浓度(C)之间的关系为

式中阿伏伽德罗常数NA=6.02×1023mol-1。
根据式(1)、式(2),可得

由式(3)可知,荧光染料的发光强度与荧光分子数成正比,即荧光分子数越多,发射的荧光越强。
在上述蛋白芯片反应过程中,通常会选择指定数量的孔位,将加入待测血清这一环节用已知浓度的不同肿瘤标志物抗原取代,并按抗原浓度由低到高(或由高到低)的顺序分别加入各个孔位中,其余反应过程与其他孔位相同。生物芯片扫描仪检测分析后,根据检测的荧光信号强度值与相应的肿瘤标志物抗原浓度作标准曲线,并得到标准曲线方程,再将待测血清的荧光信号强度代入标准曲线方程,线性回归得到相应的抗原浓度值,最终实现不同肿瘤标志物抗原浓度的定量检测。
1.2 生物芯片扫描仪的工作原理及设计
生物芯片扫描仪的结构主要由光学系统、运动扫描系统、电气控制系统、信号处理放大系统和软件分析系统5部分构成,其工作原理如图2所示。
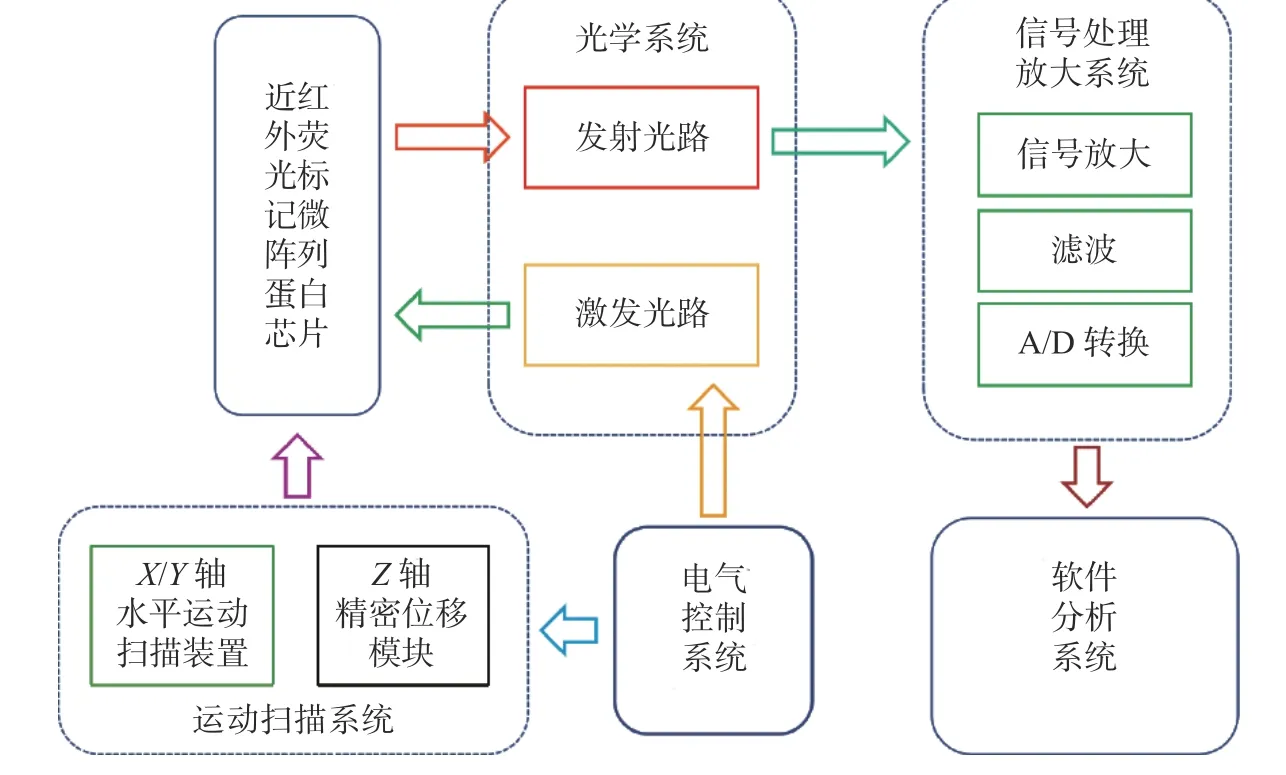
图2 生物芯片扫描仪工作原理Fig. 2 Working principle of biochip scanner
生物芯片扫描仪采用激光共聚焦原理结合机械扫描的方式完成近红外荧光标记多肿瘤标志物蛋白芯片的扫描成像。电气控制系统控制光学系统中激光器的温度和电流,使得激光器能够稳定地工作,激发光路激发肿瘤标志物上的荧光染料产生荧光信号,经发射光路收集、光电转换后变为电信号,再经信号处理放大系统的信号放大、滤波、A/D转换,进入软件分析系统成像。近红外荧光标记多肿瘤标志物蛋白芯片位于运动扫描系统中X轴的载物平台,电气控制系统控制运动系统三轴的走位和扫描,完成整个蛋白芯片的扫描。
为了实现多孔位的单独反应,近红外荧光标记蛋白芯片采用固定装置将固相载体上的各个微阵列隔开,同时,为了使反应更充分,固定装置需要有一定的深度容纳足够多的反应液。待反应结束后,检测蛋白芯片时,需要去除固定装置,这样不仅使得操作复杂,而且容易损坏芯片,造成芯片中不同人份样本之间的交叉感染。所以,在设计仪器时,需考虑固定装置的尺寸、检测的要求以及能容忍的最大轴向分辨率等因素[20]。
因此,在对上述因素综合考虑的基础上,并结合近红外荧光染料的吸收发射光谱等条件,对光学系统中的元器件参数进行选型设计,最终研制出了可用于近红外荧光标记蛋白芯片检测的生物芯片扫描仪(生物芯片扫描仪的详细工作原理及光路设计请查阅参考文献[17]中1.3节《生物芯片扫描仪的检测原理》)。
2 血清检测实验和结果
2.1 血清检测实验
选用文中介绍的近红外荧光标记蛋白芯片(上海萨迦生物科技有限公司蛋白芯片试剂盒)检测10例不同患者样本血清(血清样本来自医疗机构:上海萨迦生物科技有限公司),用生物芯片扫描仪分析检测数据;用罗氏电化学发光全自动免疫分析仪(cobas e411)对同样的样本血清按指标糖类抗原(CA125)、癌胚抗原(CEA)、糖类抗原(CA19-9)、甲胎蛋白(AFP)的顺序分别进行检测,比较两仪器的测量结果。
2.2 结果和讨论
生物芯片扫描仪对蛋白芯片试剂盒进行检测,得到CA125、CEA、CA19-9、AFP的标准曲线,如图3所示。
利用罗氏电化学发光全自动免疫分析仪(cobas e411)和近红外荧光标记蛋白芯片法对10例样本血清4项肿瘤标志物的检测结果如表1所示。
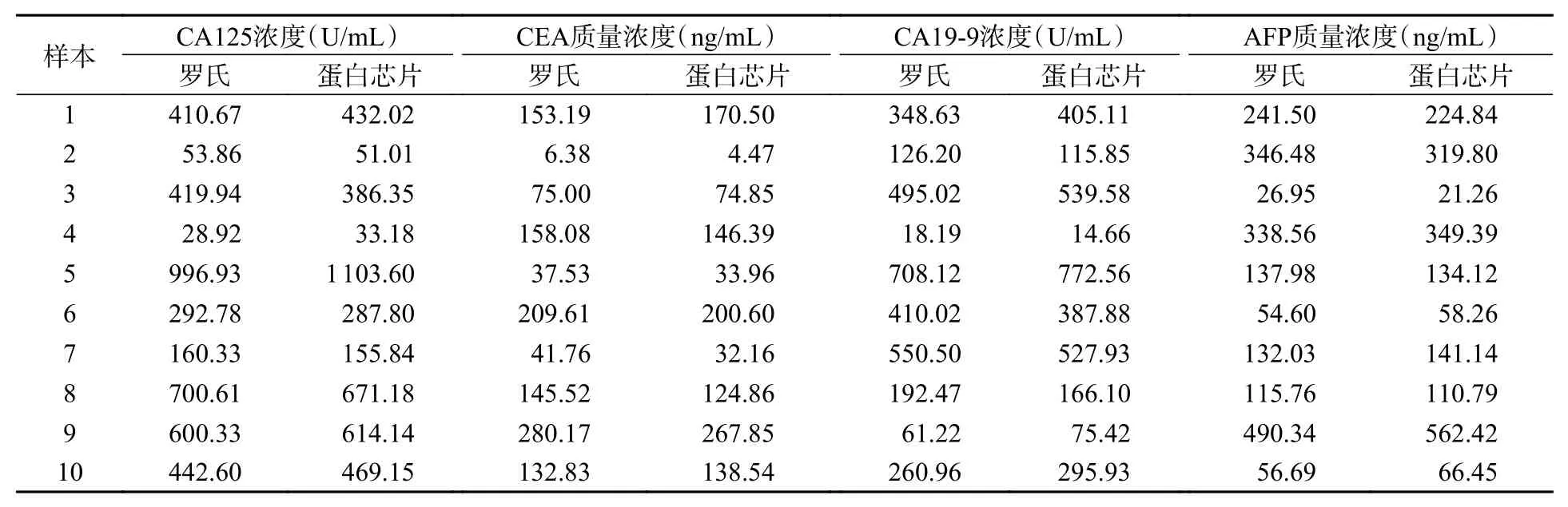
表1 罗氏分析仪和生物芯片扫描仪对血清样本的检测结果Tab. 1 Test results of serum samples from the Roche analyzer and biochip scanner
根据罗氏电化学发光全自动免疫分析仪和近红外荧光标记蛋白芯片对10例样本血清的检测结果,通过Excel软件,以罗氏仪器的检测结果为横坐标,以生物芯片扫描仪的检测结果为纵坐标作散点图,如图4所示。
由图4可以看到,两仪器对血清中的CA125、CEA、CA19-9和AFP含量的检测结果线性相关。
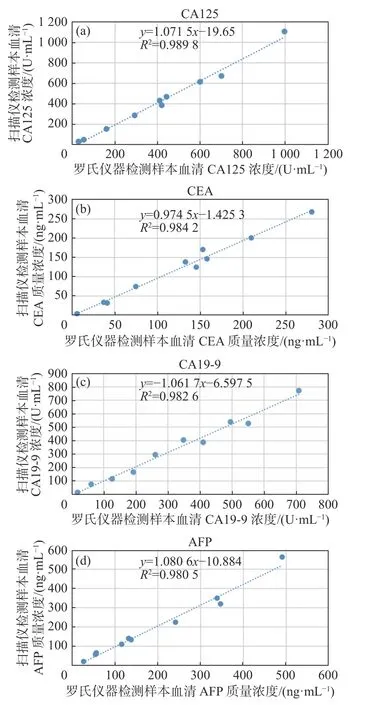
图4 罗氏分析仪和生物芯片扫描仪检测样本血清指标含量相关性Fig. 4 The correlation between the Roche analyzer and the biochip scanner detection of serum index levels
罗氏电化学发光全自动免疫分析仪和近红外荧光标记蛋白芯片法检测样本血清4项肿瘤标志物含量的线性相关系数和线性回归方程,如表2所示。
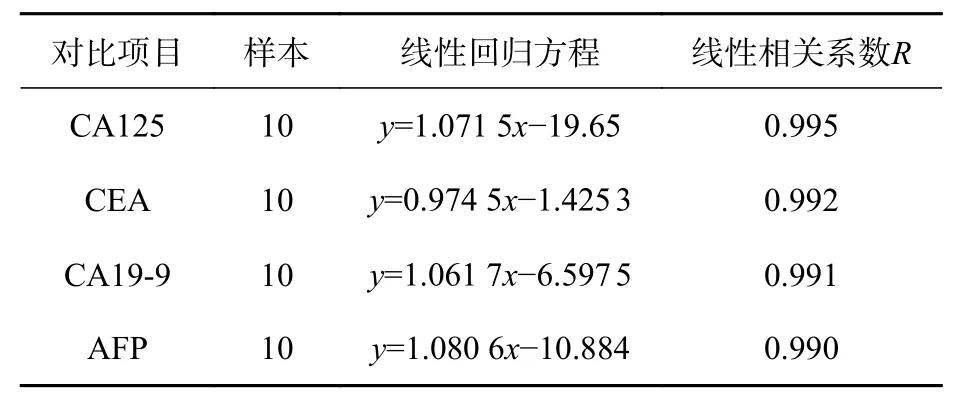
表2 两仪器对样本血清检测结果的线性相关性Tab. 2 Linear correlation between the two instruments on the sample serum test results
由表2可知,利用生物芯片扫描仪近红外荧光标记蛋白芯片法检测样本血清的结果与罗氏电化学发光全自动免疫分析仪单指标测量的结果线性相关系数均不小于0.99,表明两种检测方法高度相关。
3 结 论
本文结合近红外荧光标记蛋白芯片的免疫反应分析原理和生物芯片扫描仪的检测原理,实现了近红外荧光标记蛋白芯片多肿瘤标志物联合定量检测技术。通过对10例患者血清4项肿瘤标志物的检测,获得多个肿瘤标志物的检测结果,CA125、CEA、CA19-9和AFP含量的检测结果与罗氏电化学发光法单指标检测的结果比较,线性相关系数(R)分别为0.995、0.992、0.991、0.990,结果表明,二者具有高度相关性。因此,近红外荧光标记蛋白芯片多肿瘤标志物联合定量检测技术,不仅可一次性筛查多项癌症,而且具有通量大、操作简单、样本用量少、检测速度快、灵敏度高等优点,对大规模人群的检测筛查具有重要的临床意义。
由于肿瘤病变的复杂性,肿瘤标志物与肿瘤之间的关系并非是一一对应,而是多对多的关系[21-22],即某一肿瘤对应多项肿瘤标志物或一项肿瘤标志物对应多个肿瘤。所以,选用特异性比较高的多个肿瘤标志物进行联合定量检测,通过不同肿瘤标志物的组合,可提高肿瘤筛查的特异性[23-26]。利用近红外荧光标记蛋白芯片的优势定期对健康人群进行多肿瘤标志物联合定量检测,对肿瘤的早期筛查具有重要的现实意义[27-28]。
本文的近红外荧光标记蛋白芯片已通过国家食品药品监督管理局上海医疗器械检测研究院的检测,并取得相应的检测报告;生物芯片扫描仪已通过国家食品药品监督管理局浙江医疗器械检测研究院的检测,并取得相应的检测报告,目前二者均处于临床试验阶段。
