MAPK信号通路及内质网应激对心肌缺血再灌注损伤的影响
2022-05-07杨天睿苗云波段靳岚杨起江张思思
杨天睿,叶 堃,苗云波,段靳岚,杨起江,张思思
(1.云南省第一人民医院 老年病科,云南 昆明 650032; 2.昆明理工大学附属医院,云南 昆明 650032;3.昆明理工大学 医学院,云南 昆明 650500)
0 引 言
据国家心血管病中心发布的《中国心血管病报告2019》数据显示,我国心血管病现患病人数为2.9亿,每年我国约有350万人死于心血管病,占总死亡病因的41%,居各种疾病之首.1990-2017年,中国人群缺血性心脏病(ischemic heart disease,IHD)疾病负担及其危险因素的变化趋势分析中显示,IHD 伤残调整寿命年(DALY)率由1990年 1 116.4/10万增至2017年 2 131.0/10万,增长率为90.9%;且≥70岁人群伤残寿命损失年(YLD)率的2007-2017年均增长率(0.4%)高于1990-2007年均增长率(0.2%),证明了虽然IHD所致的过早死亡得到了有效控制,但其所致伤残负担增大,成为疾病负担的主要来源[1].目前针对缺血性心脏病主要治疗手段包括冠状动脉旁路移植术、经皮冠状动脉介入、药物等,治疗机制均是通过快速恢复心肌血流灌注,从而减轻心肌损伤甚至心肌坏死.然而,在心肌缺血恢复的同时,即可激发因再灌注导致细胞功能受损,即缺血再灌注损伤(Ischemia Reperfusion Injury, I/R)[2].已有研究表明[3],在心肌细胞发生缺血再灌注损伤后常伴随着细胞凋亡的增加,但尚缺乏从丝裂原活化蛋白激酶通路(Mitogen-Activated Protein Kinase, MAPK)及内质网应激等方面入手,分析其在细胞凋亡与心肌缺血再灌注损伤过程中的病理生理机制.
为此,本研究关注于心肌缺血再灌注后细胞凋亡率及其包括凋亡蛋白B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2), Bax蛋白,磷酸化的P38蛋白,磷酸化应激活化蛋白激酶-1(p-c-Jun N-terminal kinase-1,P-JNK-1), 磷酸化细胞外调节蛋白激酶(p-extracellular regulated protein kinases,P-ERK),葡萄糖调节蛋白78(glucose regulated protein 78kD,GRP78), 内质网应激相关蛋白,即C/EBP同源蛋白(C/EBP-Homologous Protein,CHOP)在内的蛋白表达水平的变化.
1 材料与方法
1.1 实验动物
健康成年雄性实验树鼩滇西亚种40只,4~6月龄,体重120~150 g,由中国医学科学院医学生物学研究所树鼩种质资源中心提供,合格证 SCXK(滇)K2015-0002.本研究经本院伦理委员会审核通过,编号(2017)伦审【科】第(025)号.
1.2 试剂及主要仪器
全蛋白提取试剂盒(Wanleibio),TUNNEL细胞凋亡检测试剂盒,TUNNEL检测液,Western洗涤液(wanleibio),PVDF膜(Millipore),Anti-Bcl-2抗体[E17](Abcam),Anti-Bax抗体[E63](Abcam),Anti-CHOP抗体[9C8](Abcam),Anti-GRP78 BiP抗体(Abcam),Anti-ERK1抗体[Y72](Abcam),Anti-ERK1 (phospho Y204)抗体(Abcam),Anti-JNK1抗体[EPR140(2)](Abcam),Anti-p38抗体[E229](Abcam),山羊Anti-Rabbit IgG H&L (HRP)(Abcam),Anti-beta Actin抗体[mAbcam 8226](Abcam).PowerLab型Langendorff离体心脏灌流系统,DYY-7C型电泳仪,DYCZ-24DN型双垂直蛋白电泳仪,WD-9413B型凝胶成像系统,石蜡切片机,荧光显微镜.
1.3 实验方法
健康成年雄性实验树鼩滇西亚种40只,随机分为持续灌注对照组(一组)、缺血模型组(二组)、缺血再灌注模型组(三组),共3组,保证每组试验成功10只.建模方法和标准参考文献[4],用3.6%的水合氯醛腹腔麻醉给药(1 mL/只),经腹腔肝素化(普通肝素 1 000 U/只)抗凝.迅速开胸将心脏分离,并移至Langendorff灌注装置上,逆行插管主动脉,用K-H液恒温(37 ℃)恒压(60 mmHg,1 mm Hg=0.133 kPa)稳定灌注,保证冠状动脉回流通畅,冠脉流量为6~12 mL/min.待灌注系统稳定后,空白对照组持续灌注 60 min,缺血组持续灌注 30 min 后停灌 30 min,缺血再灌注组稳定灌注后停灌 30 min,再灌注 30 min.
1.4 标本采集
待灌注结束,立即取下心脏,冲去血渍,用滤纸吸干水分,将心脏置于 -20 ℃ 冷冻 2 h 后,沿心脏冠状面以 2 mm 间隔切出6片心肌,之后将心室肌组织分割成 0.2 g 大小的组织块.
1.5 TUNEL法检测心肌细胞凋亡指数
按试剂盒说明书操作(每张切片上,随机抽取凋亡的细胞核高倍视野必须达5个以上,并且心肌细胞核数不得少于200个).
凋亡指数(Apoptotic Index)=阳性细胞/(阳性细胞+阴性细胞)×100%
通过切片包埋,切片脱蜡到水,染色,抗荧光淬灭后封片,在荧光显微镜下进行观察(波长为 570 nm,红色荧光),于200×镜下拍照并计数凋亡率.
1.6 Western-blot法检测
将心室肌组织块放入 5 mL 的小烧杯中,与预冷的匀浆介质1∶9配比,剪碎后倒入玻璃匀浆器中研磨成10%的心肌均浆,按照蛋白提取试剂盒说明书提取树鼩心肌组织蛋白,利用BCA蛋白浓度测定试剂盒,完成样品蛋白浓度测定.以 20 μL/孔上样进行SDS-PAGE电泳,电泳结束后迅速将蛋白转膜至PVDF 膜,封闭后的PVDF膜用TBST 漂洗5 次后,分别加入稀释一抗和二抗 ( TBST 1∶5 000 稀释),室温孵育及漂洗后将ECL化学发光试剂A、B等体积混合,凝胶成像仪下显影成像.用Image J图象处理软件分析目的条带,以目的条带与β-actin条带之比进行半定量分析.
1.7 统计学分析
采用SPSS 20.0统计学软件进行数据分析.符合正态分布的计量资料表示以均数±标准差表示,使用单因素方差分析方法比较各组间的计量资料;多重比较使用方差齐性时采用LSD方法,方差不齐时采用Dunnett-t检验分析方法,以P<0.05表示有统计学意义.

表1 凋亡率比较(x±s)

图1 凋亡率比较Fig.1 Comparison of apoptosis rate
2 结 果
2.1 Tunnel凋亡率组间比较
由表1及图1可见,Tunnel凋亡率两两比较发现缺血模型组显著高于对照组,再灌注模型组显著高于对照组、缺血模型组,且均具有统计学意义,即再灌注模型组呈现大量的凋亡细胞,tunel染色呈阳性,而缺血模型组次之,对照组发生凋亡的细胞则最少.
2.2 凋亡蛋白 Bcl-2与BAX组间表达量比较
由表2及图2可知,凋亡蛋白BCL-2蛋白表达量:空白对照组>缺血模型组>再灌注模型组;Bax蛋白表达量:空白对照组<缺血模型组<再灌注模型组;再灌注模型组Bcl-2/Bax比值下降明显.

表2 Bcl-2与Bax表达量比较(x±s, n=10)

图2 Bcl-2与Bax表达量比较Fig.2 Comparison of expression in Bcl-2 and Bax
2.3 P38、JNK-1、ERK组间表达量比较
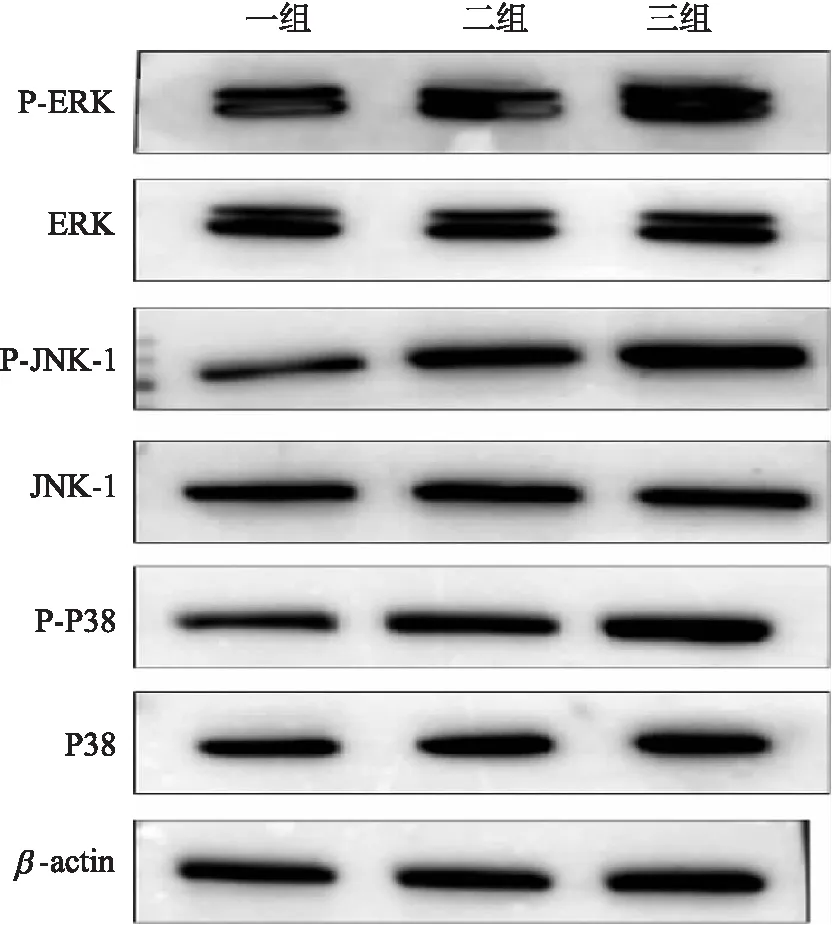
图3 P38、JNK-1、ERK表达量比较Fig.3 Comparison of expression in Lin P38, JNK-1, ERK
由表3可知,心肌组织P38、JNK-1、ERK磷酸化水平两两比较,发现缺血再灌注模型组显著高于缺血模型组,缺血模型组显著高于空白对照组.由图3可知,从空白对照组、缺血模型组至缺血再灌注模型组,磷酸化P38、JNK-1、ERK蛋白量均呈现逐渐增高表达趋势.

表3 心肌组织P38、JNK、ERK表达量比较(x±s)
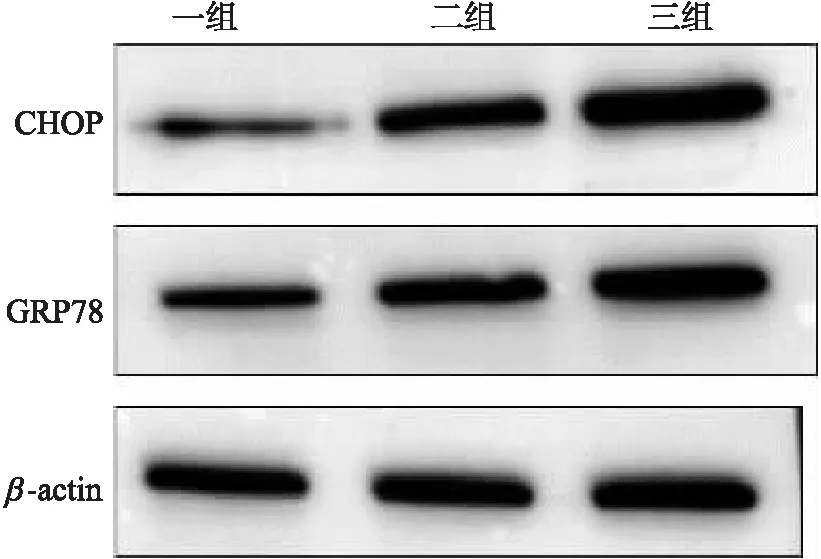
图4 GRP78、CHOP-1表达量比较Fig.4 Comparison of expression in GRP78 and CHOP-1
2.4 GRP78、CHOP-1组间表达量比较
由表4及图4可见,心肌组织GRP78、CHOP-1表达量水平:空白对照组<缺血模型组<缺血再灌注模型组,且各组GRP78、CHOP-1蛋白量表达呈现逐渐增高趋势.

表4 心肌组织GRP78、CHOP-1表达量比较(x±s)
3 讨 论
本研究采用动物离体心脏模型模拟缺血再灌注损伤过程,挖掘心肌缺血再灌注损伤的病理生理机制.细胞凋亡是通过激活信号通路,启动细胞内死亡蛋白系统,诱导细胞发生程序化死亡.研究发现细胞凋亡参与了缺血再灌注损伤过程始终,并受多种基因调控,与Bcl-2家族密切相关[5].研究证实[6-7],Bcl-2/Bax比值直接影响着细胞存亡,Bcl-2/Bax值增加,细胞趋于存活;比值下降,细胞趋于凋亡.当心肌缺血再灌注发生时,Bax基因表达显著上调,Bcl-2基因表达显著下调.MAPK家族是细胞内重要的信息传递系统,正常情况下这类激酶分布于细胞质中,以弱活化状态或静止状态存在,当细胞受到刺激,该系统往往被激活,通过磷酸化作用,进而调节下游分子底物的生物学活性,介导包括细胞凋亡等多种细胞的病理生理过程[8].当细胞处于缺血再灌注损伤状态,MAPK应急信号通路p38信号途径迅速启动,增强了胞质蛋白质和转录因子的磷酸化水平,加重细胞凋亡.JNK作为MAPK家族的重要信号通路,在I/R损伤发生时,其通过介导线粒体释放促凋亡因子,直接促进Bcl-2高表达,诱导促炎细胞因子大量表达[9-10],与细胞调亡有着密切联系.大量研究表明[11],ERK信号通路参与调节多种细胞生理功能,虽然不同的实验模型中,ERK作用可能存在差异,但ERK对细胞存活或损伤发挥着重要作用.ERK往往在心损早期参与启动细胞内源性保护机制,而在长时间I/R过程中,其作用则为介导细胞损伤[12].内质网应激(Endoplasmic Reticulum Stress,ERS)发生时[13],应激性蛋白分泌增加,激活促凋亡编码基因,其中GRP78蛋白作为内质网应激的标志性蛋白,在维持内质网稳态中扮演着重要角色[14].当细胞受到缺氧、缺血等有害刺激时,GRP78蛋白则大量表达,调控细胞信号传导,减少内质网上尚未折叠或错误折叠蛋白的积累,维持钙离子平衡,保持细胞内环境稳定,尽可能延长处于有害要素刺激下的细胞存活期[15].GRP78下游的信号分子CHOP是增强子结合蛋白同源蛋白,为特异性转录因子,其作用机制主要是启动胱天蛋白酶级联反应,从而参与到细胞凋亡过程中[16].
本研究发现,与空白对照组及缺血模型组相比较,缺血再灌注模型组细胞凋亡率明显升高,再灌注模型组Bcl-2蛋白相对表达量较对照组显著下调,Bax表达量明显增加,其Bcl-2/Bax比值下降,细胞趋于凋亡,以上结果与之前研究相一致,再次证明了细胞凋亡是心肌缺血再灌注损伤的重要环节.在缺血再灌注模型组中磷酸化P38、JNK、ERK蛋白表达量均显著增加,激活了MAPK家族信号通路系统,将信息传导至细胞核内,调控多种转录因子表达,最终诱导细胞凋亡.GRP78、CHOP-1蛋白表达量显著增高,可能启动了细胞内质网应激的发生,削弱了细胞的自我保护作用,加重了细胞凋亡.本实验结果证实在心肌缺血再灌注损伤发生及其发展过程中,细胞通过启动MAPK信号通路、激活内质网应激系统,调控相关蛋白表达,加速细胞凋亡.
但本研究也存在一定的局限性,样本量相对较小,尚缺乏临床研究数据等.细胞凋亡贯穿于缺血再灌注损伤过程中,但因其涉及诸多环节,并存在交互作用,要从机制根源阻止损害发生,今后的工作将任重而道远.
4 结 论
本研究运用离体心肌缺血再灌注模型,避免神经体液因素的干扰,直接显现心肌缺血再灌注损伤过程,首次以实验树鼩作为实验动物,在生物医药研究方面具有重要价值.细胞凋亡是缺血再灌注损伤机制中关键环节,MAPK家族是细胞内的重要信息传递系统,研究发现,在缺血再灌注损伤中心肌细胞通过活化P38 MAPK信号通路表达,激活JNK信号通路,调节ERK信号通路水平,引起细胞凋亡.细胞内质网功能障碍是心肌缺血再灌注损伤的重要原因,研究证实缺血再灌注损伤活化了内质网分子伴侣GRP78和特异性促凋亡分子CHOP,心肌细胞出现过度的ERS,内质网稳态失调,加重线粒体损伤.该研究将细胞凋亡、细胞信号传导、细胞器功能损害有机联系起来,展现了一系列细胞效应过程,深入挖掘心肌缺血再灌注损伤机制,为下一步的干预研究奠定基础.
