用网络药理学和分子对接技术探索防风通圣丸治疗COVID-19的机制
2022-05-07戴子琦郭慧娟吴倩文陈红珊亓金钗陈可点王亚欣崔鹤蓉王鹏龙雷海民
高 丰,陈 莹,戴子琦,郭慧娟,吴倩文,陈红珊,亓金钗,李 桐,陈可点,王亚欣,崔鹤蓉,王鹏龙,杜 菁*,徐 冰*,雷海民*
1.北京中医药大学,北京 102488;2.北京同仁堂科技发展有限公司,北京 100062
由SARS-Co V-2病毒引起的新型冠状病毒肺炎(coronavirus disease 19,COVID-19)对人类健康及经济构成严重威胁。其临床表现为发热、干咳、乏力,继而可发展为呼吸衰竭、脓毒血症等直接危及患者生命[1]。
中医认为COVID-19 属疫病范畴,主要是由于寒湿疫毒之邪从口鼻而入,寒湿邪气侵袭肺脏所致[2],在临床治疗中清肺排毒汤、宣肺败毒方等传统方剂具有很好的疗效。防风通圣丸原方出自《黄帝素问宣明论方》,被列入国家卫生健康委员会和国家中医药管理局发布的《新型冠状病毒感染的肺炎诊疗方案》(试行第5版),由麻黄、荆芥穗、防风、薄荷、大黄、芒硝、滑石、栀子、石膏、黄芩、连翘、桔梗、当归、白芍、川芎、白术(炒)和甘草组成,具有解表通里、清热解毒的功效,临床常用于荨麻疹、哮喘、肺炎和感冒的治疗。
本研究用网络药理学及分子对接技术挖掘防风通圣丸中的有效成分、潜在作用靶点及作用机制,以期为临床治疗COVID-19提供依据。
1 材料与方法
1.1 防风通圣丸中主要成分及靶标蛋白的筛选
用中药系统药理学数据库及在线分析平台(traditional Chinese medicine system pharmacology database and online analysis platform,TCMSP,http://tcmspw.com/tcmsp.php)收集防风、荆芥穗、薄荷、麻黄、大黄、栀子、桔梗、川芎、当归、黄芩、连翘、甘草、白芍和白术的主要活性成分。以口服利用度(oral bioavailability,OB)值≥30%和类药性(drug-likeness,DL)值≥0.18为筛选条件,筛选出候选的活性成分。为避免个别认可度较高的有效成分被剔除,通过查阅《中华人民共和国药典》(以下简称《中国药典》)(2020版)得到此类成分并合并至TCMSP数据库筛选结果中,同时获取化合物对应的靶标蛋白,在TCMSP 未查询到成分的靶标蛋白应用Swisstarget(http://swisstargetprediction.ch/)进行预测。
1.2 靶标蛋白基因名的确定
在Uniprot数据库(https://www.uniprot.org/)中查找所有靶标的基因名,并将查询到的靶标蛋白名称转化为相应的基因简称。
1.3 COVID-19相关靶标的获取
在Genecards数据库(https://www.genecards.org/)中以“novel coronavirus pneumonia”为关键词进行搜索,收集得到与COVID-19相关的作用靶点。应用Venny 平台(https://bioinfogp.cnb.csic.es/tools/venny/)将防风通圣丸有效成分的靶标蛋白与COVID-19的疾病靶点进行映射,得到防风通圣丸治疗COVID-19的交集靶点。
1.4 药物-靶点-疾病交互网络的建立
将防风通圣丸药物、活性成分、交集靶点数据导入Cytoscape 3.7.2软件中,构建防风通圣丸药物-靶点-疾病交互网络,对其进行拓扑分析后以节点连接度(Degree)及介度(Betweenness)≥2 倍中位数且紧密度(Closeness)≥1倍中位数为筛选条件,得到活性成分及有效靶点。
1.5 蛋白-蛋白相互作用网络的构建
将1.4 项下得到的有效靶点导入String 平台(https://string-db.org/),限定物种为“Homo sapiens”,将筛选后的结果保存为“TSV”格式,导入Cytoscape 3.7.2软件,构建蛋白-蛋白相互作用网络。
1.6 KEGG 和GO富集分析
对得到的有效靶点利用DAVID 平台(https://david.ncifcrf.gov/)进行GO 和KEGG 富集分析,分析靶点涉及的基因功能及相应的信号通路,并利用R语言将其可视化。
1.7 分子对接
选择药物-靶点-疾病网络中筛选出的有效成分与COVID-19 关键靶点SARS-Co V-2 3CL 水解酶[3]、血管紧张素转换酶Ⅱ(ACE2)[4]进行分子对接,并将目前临床用于治疗COVID-19的化学药利巴韦林、利托那韦、洛匹那韦、磷酸氯喹和阿比多尔作为阳性对照。首先,从RCSB 蛋白结构数据库(http://www.rcsb.org/)中获得SARS-Co V-2 3CL水解酶(PDB ID:6LU7)和ACE2(PDB ID:1R42)的三维结构,导入AutoDock 4.2.6进行除水等操作,保存为“PDBQT”格式。从Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载化合物结构“sdf”文件,采用Chem3D 软件将其转化为“mol2”文件,保存为“PDBQT”格式。将经过前处理的配体和目的靶点导入AutoDock 4.2.6软件进行格点能计算后,进行分子对接。本研究以结合能≤-5.0 kJ·mol-1为分子与靶点结合性较好[5]。
2 结果
2.1 收集和筛选得到的防风通圣丸主要成分和靶点
用TCMSP数据库以OB≥30%和DL≥0.18为条件检索得到防风通圣丸化学成分224种。用TCMSP数据库收集得到224种化学成分对应靶点共696个。其中存在1种活性成分对应多个靶点及1个靶点对应多种活性成分的情况。
2.2 COVID-19疾病靶点和防风通圣丸治疗COVID-19的潜在靶点
利用GeneCards平台检索得到COVID-19疾病靶点259个,通过Venny平台将防风通圣丸主要成分所对应的靶点与COVID-19 疾病靶点取交集,得到79个防风通圣丸治疗COVID-19的潜在靶点。
2.3 药物-靶点-疾病交互网络的构建与分析
利用Cytoscape 3.7.2软件构建的药物-靶点-疾病交互网络,见图1。图中共有264个节点及1 046条边。Degree值反映了网络中节点与其他节点的连接数量,Betweenness是网络中所有最短路径中经过该节点的路径数量与最短路径总数之比,Degree与Betweenness是衡量一个节点在网络中重要性的主要拓扑参数。由图1可见,1种成分可对多个靶点起作用,同时也存在多种成分对1 个靶点起作用的情况,表明防风通圣丸具有多成分、多靶点相互协同治疗COVID-19的特点。
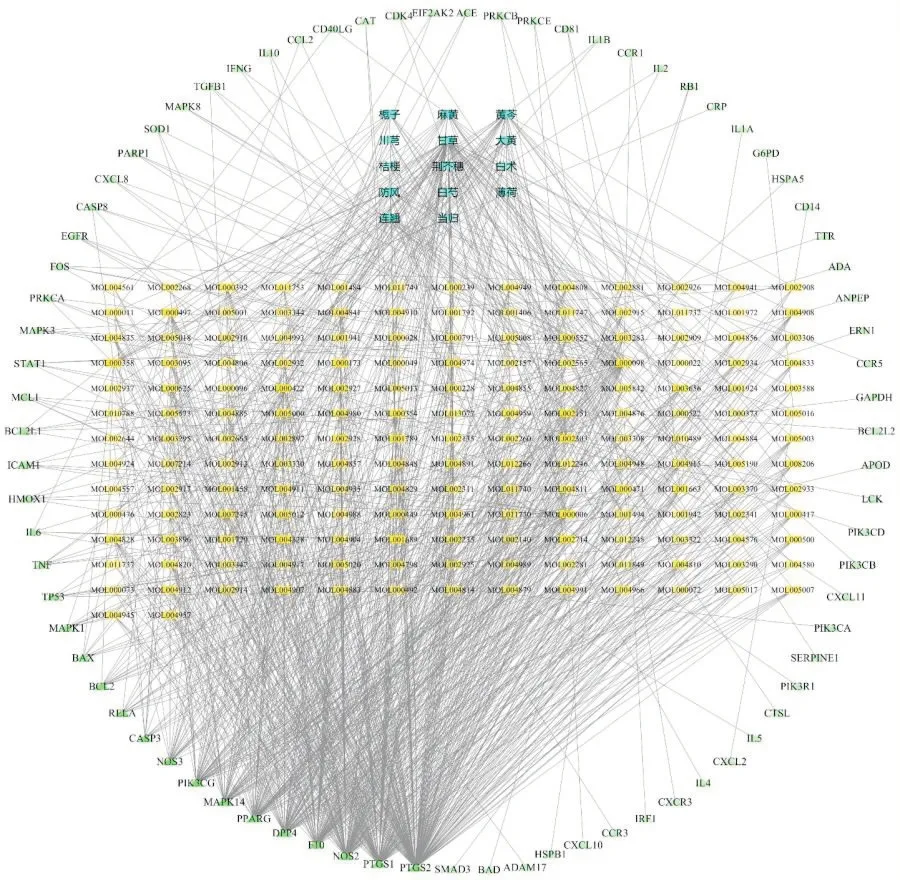
图1 药物-靶点-疾病交互网络Fig.1 Network of drug-target-disease
2.4 活性成分及有效靶点的获得
利用Cytoscape 3.7.2软件对药物-靶点-疾病交互网络进行拓扑分析,并以Degree值及Betweenness值≥2倍中位数且Closeness值≥1倍中位数为标准,筛选出活性成分10 种,以黄酮类化合物为主,排名前5的化合物分别为槲皮素、木犀草素、山柰酚、β-谷甾醇和柚皮素;有效靶点23 个,PTGS2、PTGS1、NOS2、F10 和DPP4 为排名前5的靶点。结果见表1、表2。
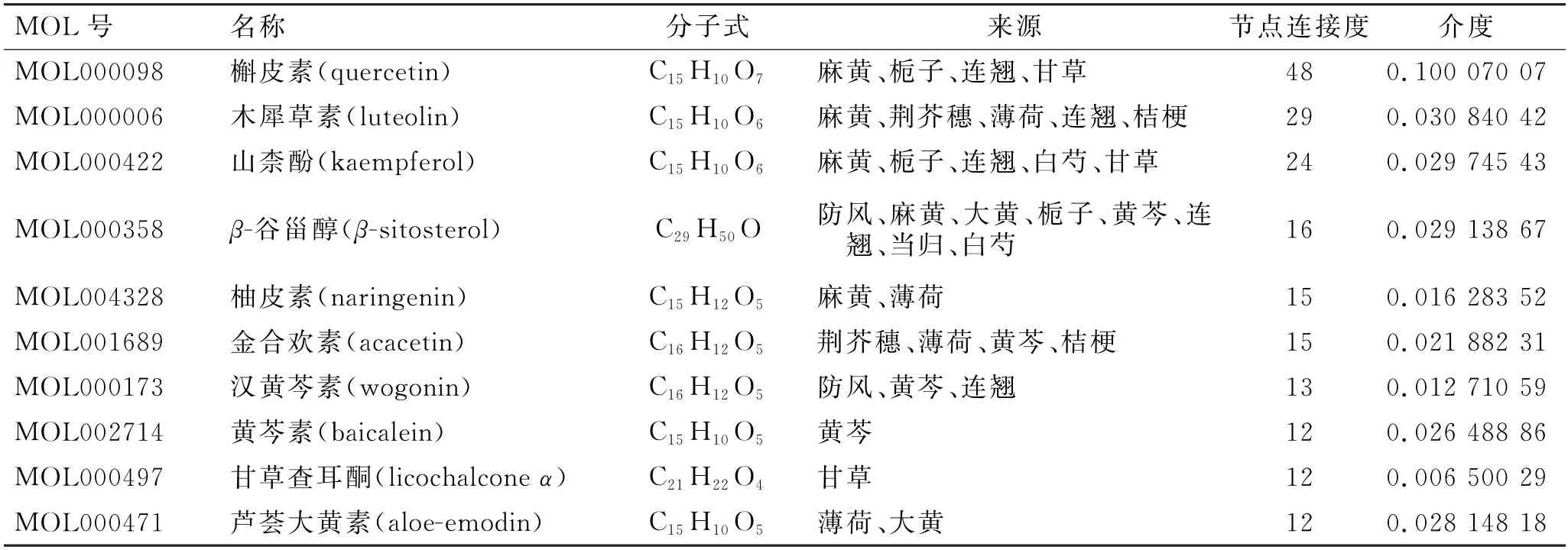
表1 防风通圣丸的主要活性成分Tab.1 Main active components of Fangfeng Tongsheng Pills
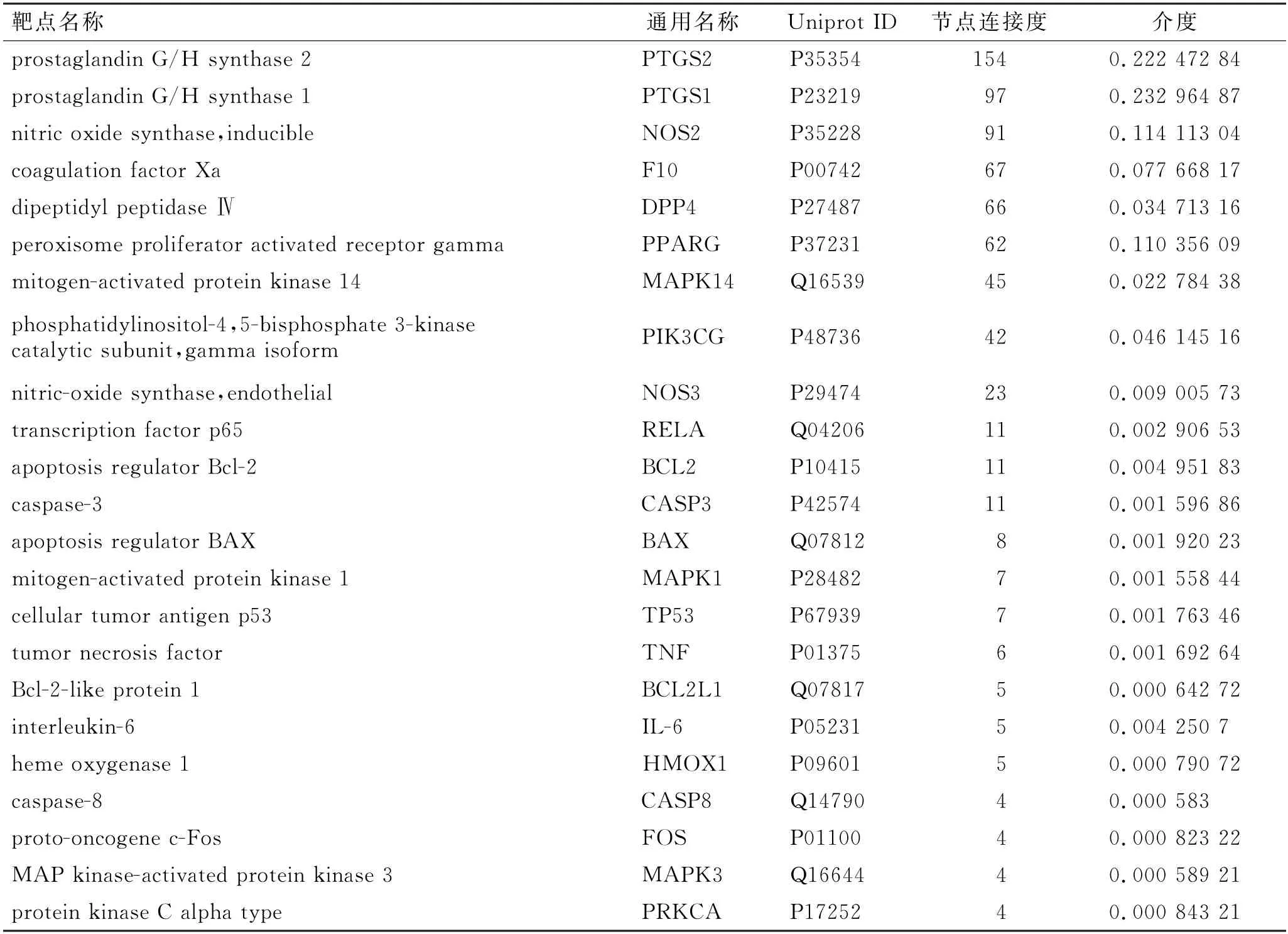
表2 防风通圣丸的主要有效靶点Tab.2 Main effective targets of Fangfeng Tongsheng Pills
2.5 蛋白-蛋白相互作用网络的构建与分析
通过String平台构建蛋白-蛋白相互作用网络,见图2。由图2可见,共有22个节点(F10为孤立靶点,未参与分析),150条边。其中节点表示蛋白,节点越大表示度值越大,连线越粗表明其评分越高,即关系越密切,颜色的深浅与度值及介值呈正相关。网络中蛋白平均节点度值为13.63,有15个节点度值超过平均值。TP53、MAPK3、CASP3、TNF 和IL-6的度值较大,为颜色最亮的5个节点,提示其可能是防风通圣丸治疗COVID-19的主要作用靶点。
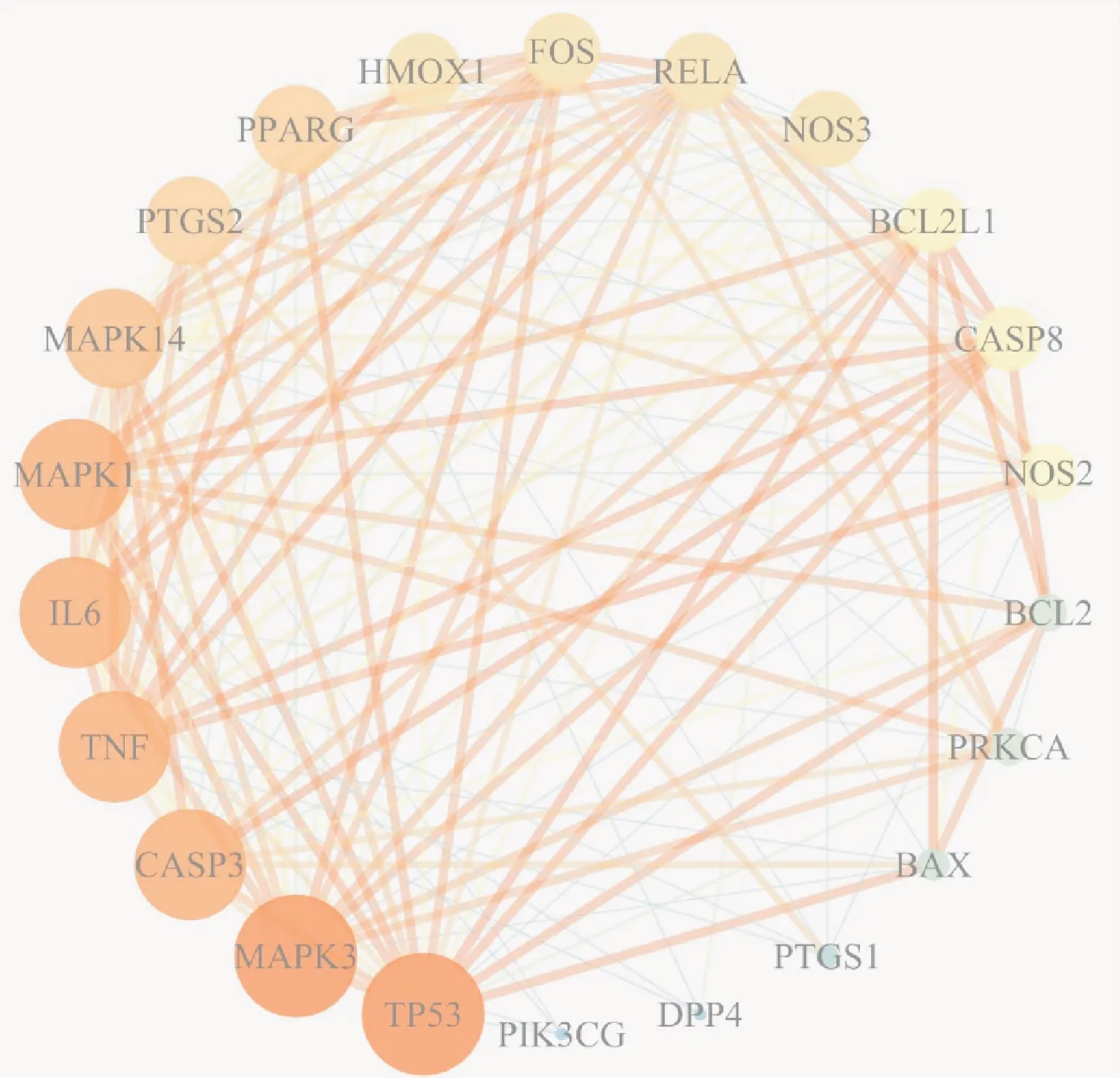
图2 蛋白-蛋白相互作用网络Fig.2 Protein-protein interaction network
2.6 GO 富集分析
经GO 富集分析,共得到65条富集结果。主要涉及炎症反应(inflammtory response)等方面。结果见图3。
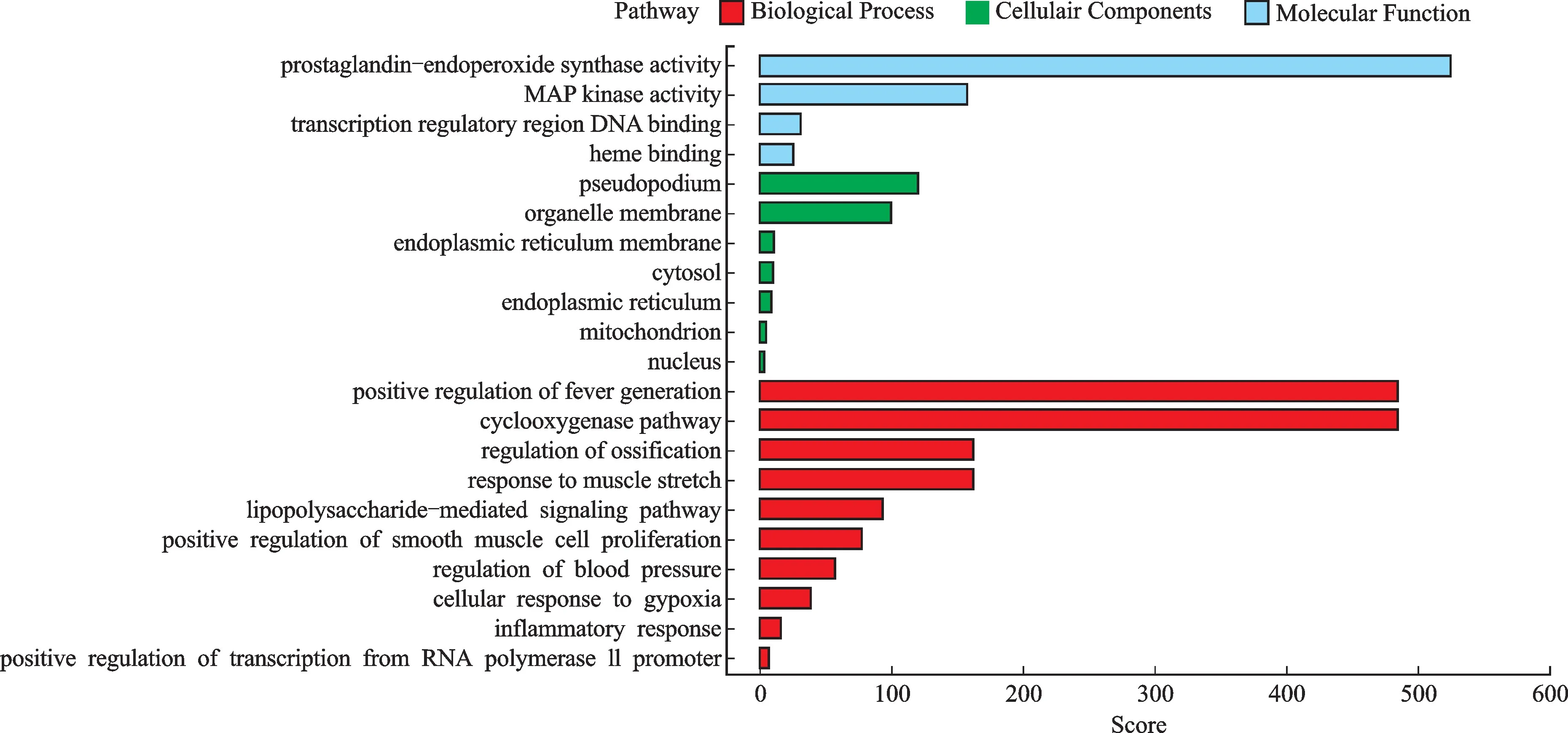
图3 防风通圣丸活性成分作用靶点的GO 基因功能富集分析Fig.3 GO enrichment analysis of effect targets of compounds from Fangfeng Tongsheng Pills
2.7 KEGG 富集分析
经KEGG 富集分析后,得到101条富集结果,包括TNF 信号通路(TNF signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、VEGF 信号通路(VEGF signaling pathway)、Toll样受体信号通路(toll-like receptor signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、MAPK 信号通路(MAPK signaling pathway)。本研究选出KEGG 富集分析中排名前25的项目,见图4。排序越靠前,提示其越可能是防风通圣丸治疗COVID-19的主要作用机制。
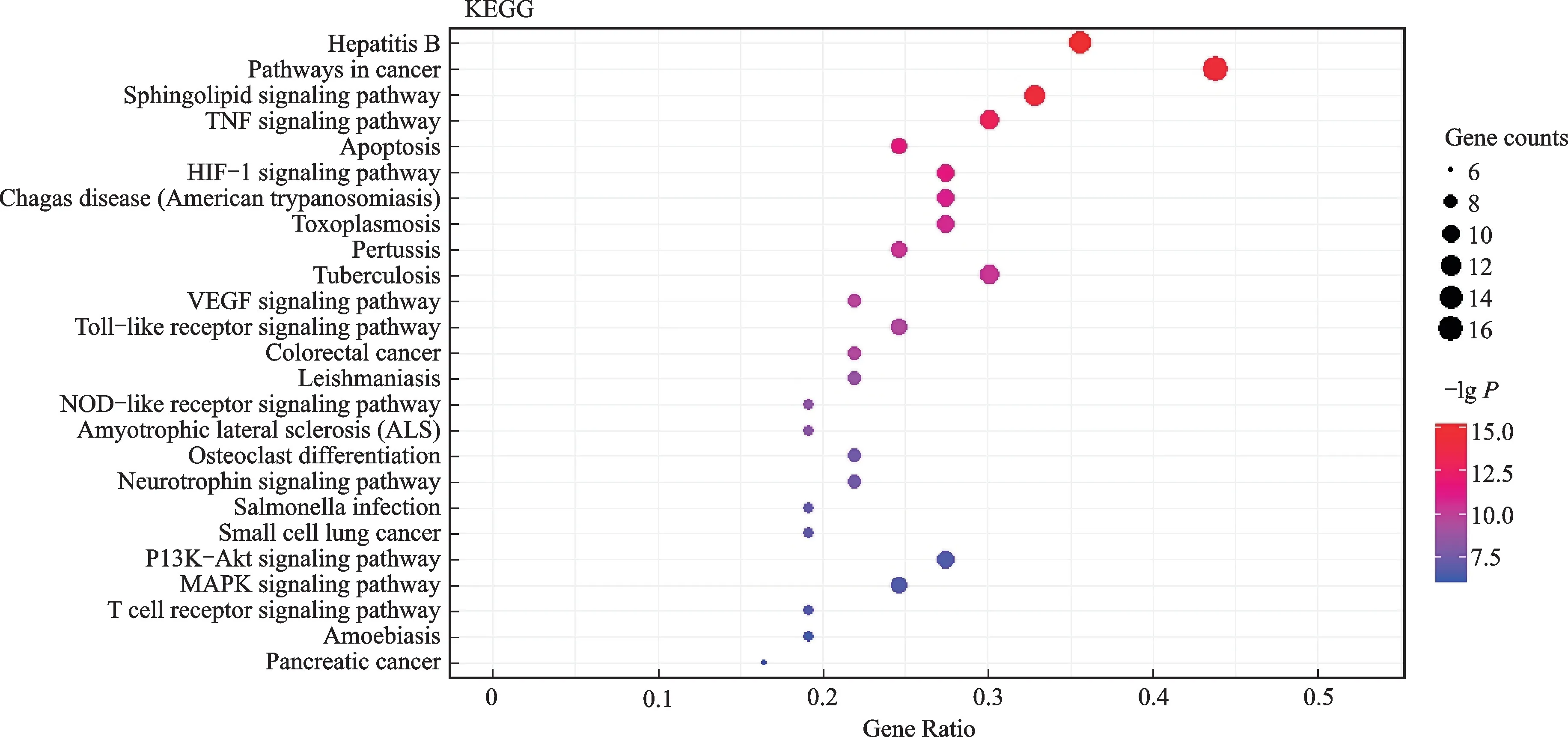
图4 防风通圣丸作用靶点KEGG 信号通路富集分析的25条通路Fig.4 KEGG enrichment analysis of 25 pathways of effect targets of Fangfeng Tongsheng Pills
2.8 分子对接
血管紧张素转换酶Ⅱ(angiotensin converting enzyme 2,ACE2)是SARS-Co V-2的宿主细胞受体,并且SARS-Co V-2是通过其棘突S蛋白与人体细胞表面的ACE2受体结合,从而导致病毒侵入机体而致病[6]。控制新型冠状病毒复制复合物活性的主水解酶Mpro在病毒生命周期中有重要作用,Mpro与小核糖核酸病毒3C 水解酶具有相似的切割位点特异性,此酶通常称为SARS-Co V-2 3CL水解酶[7]。目前,多数研究者认为,配体与受体在结合构象稳定的情况下,能量越低表明此受体与配体发生作用的可能性越大。将防风通圣丸的10 种有效成分分别与SARS-Co V-2 3CL水解酶(PDB ID:6LU7)和ACE2(PDB ID:1R42)进行分子对接,结果见表3,防风通圣丸中10 种成分与SARS-Co V-2 3CL 水解酶和ACE2的结合能均小于-5.0 kJ·mol-1。其中以β-谷甾醇、槲皮素、木犀草素和山柰酚与SARS-Co V-2 3CL水解酶和ACE2靶点结合能最低,并与阳性对照药物最接近。
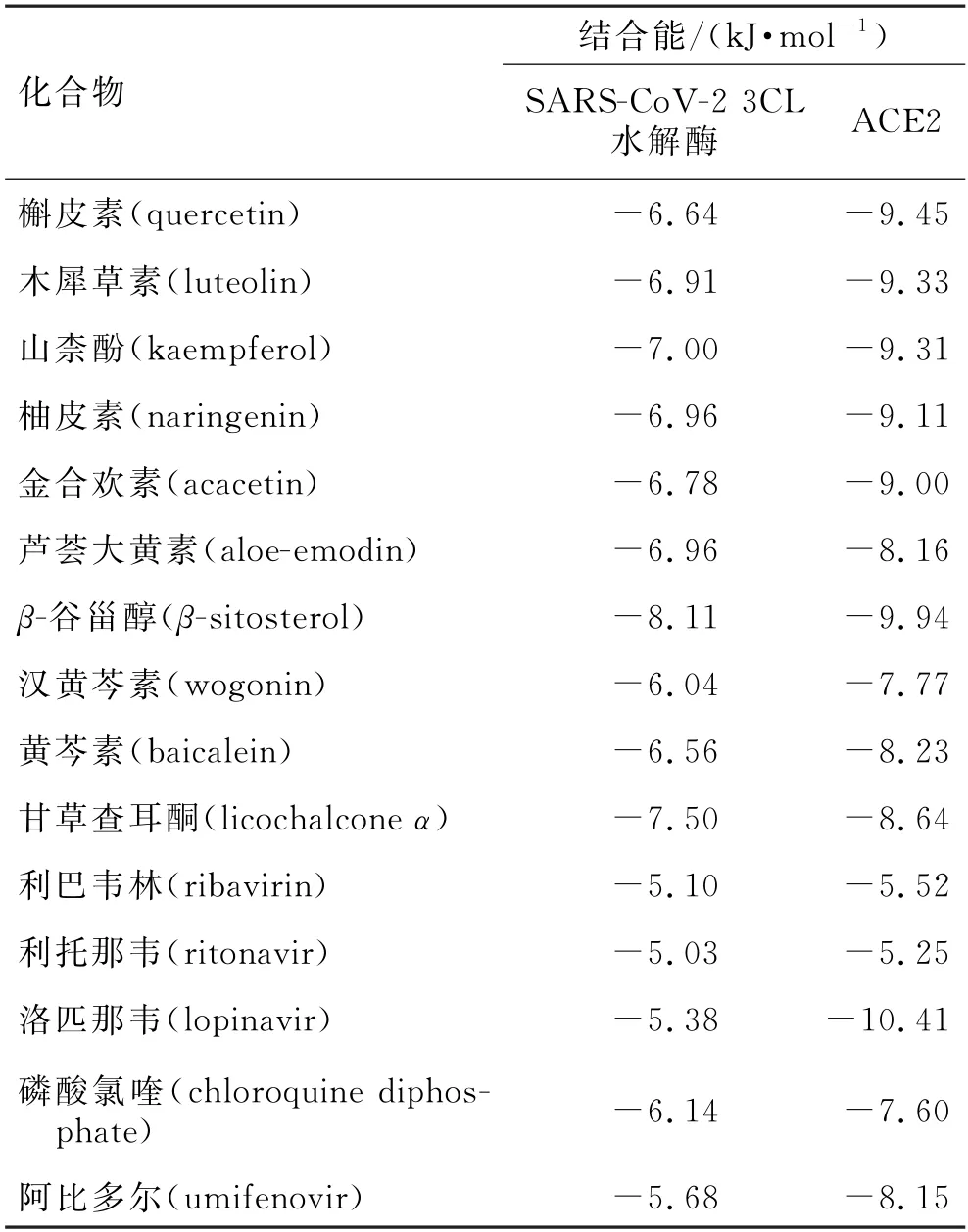
表3 防风通圣丸核心化合物及临床治疗药物与SARS-CoV-2 3CL水解酶和ACE2的结合亲合能Tab.3 Binding affinities of key compounds in Fangfeng Tongsheng Pills and clinical drugs with SARS-Co V-2 3CL hydrolase and ACE2
3 讨论
网络药理学建立在疾病-基因-靶点-药物相互作用网络的基础上,其可用于分析药物或方剂中多成分-多靶点-多途径的复杂作用网络,可体现出中医理论中多成分、多靶点协同治疗的特点。分子对接技术是利用计算机模式识别和优化技术,计算物理化学参数,从而评价配体、受体二者间的相互作用,进而达到辅助药物筛选的目的,现已广泛用于基于特定靶标的中药及复方活性成分筛选的研究[8-10]。
基于网络药理学分析结果,得出防风通圣丸中治疗COVID-19的潜在活性成分为槲皮素、木犀草素、山柰酚、β-谷甾醇和柚皮素等;作用靶点为TP53、MAPK3、CASP3、TNF和IL-6等。前期大量的研究表明,槲皮素具有抗炎、抗病毒的作用,其可通过调控Toll样受体(TLR7)通路,减少IL-6和TNF-α等炎性因子的分泌,从而减轻支气管上皮细胞的炎症并对呼吸道病毒感染起抑制作用[11]。IL-6为机体内参与信息传递及调节激活免疫细胞的一种细胞因子,IL-6的表达失调会导致多种疾病的发生。同时,IL-6 是引发炎症风暴的关键细胞因子,阻断IL-6与其受体的结合可以抑制炎症风暴[12]。木犀草素除可抑制IL-6和TNF-α等细胞因子的表达外[13],还可调节MAPK 信号转导途径中的多个靶标,通过抑制IL-1β诱导的激酶活化而对MAPK 转导途径产生影响,从而发挥抗炎作用[14]。MAPK3 与MAPK1 同属于MAPK 家族成员,其可诱导产生促炎反应,其在氧化应激和病毒感染等环境中会被激活。β-谷甾醇的作用机制与木犀草素类似,可通过减少NO 的合成,抑制巨噬细胞IL-6的活性,减少IL-1和TNF-α等炎性因子的分泌[15]。TNF 主要由巨噬细胞和T 淋巴细胞产生,TNF-α可通过活化中性粒细胞及相关炎性因子、影响肺表面活性物质以及肺内皮细胞等机制造成急性肺损伤[16]。山柰酚通过抑制新型冠状病毒3a通道蛋白从而抑制病毒的释放[17]。IL-10属细胞因子中的干扰素家族,可以激活巨噬细胞,并能在转录水平上强烈抑制IL-1β、IL-6、IL-8和TNF-α的合成。柚皮素可通过下调Toll样受体(TLR2和TLR4),显著抑制IL-10水平的上升,从而抑制由沙眼衣原体引起的炎症反应[18]。
GO 富集结果主要涉及炎症和氧化应激通路。KEGG 通路分析发现,防风通圣丸治疗COVID-19可能与TNF 信号通路、HIF-1 信号通路、VEGF 信号通路、Toll样受体信号通路、PI3K-Akt信号通路及MAPK 信号通路有关。TNF 可促进促炎因子的表达,参与全身炎症反应[19],亦有抗感染效应,可阻止病毒早期蛋白质的合成,进而抑制病毒复制和杀伤被病毒感染的细胞[20]。HIF-1由HIP-1α和HIF-1β2种亚基构成,是缺氧应激的关键因子,是氧稳态的主要调节剂。HIF-1通路与病毒性肺炎的炎症因子释放有关[21]。且HIP-1α表达的上调可导致肺部阻塞性疾病的发展[22]。VEGF 通路与炎症抑制、减轻肺损伤有关。COVID-19会导致患者严重缺氧,而缺氧对VEGF 基因的表达有重大影响[23]。Toll样受体是先天性免疫系统中的细胞跨膜受体和病原膜识别受体之一,其常介导各种炎症细胞因子的产生,参与肺纤维化的发生和发展[24]。PI3K-Akt信号通路对于呼吸道疾病及肺部炎症的治疗具有重要意义[25]。MAPK 通路与病毒性肺炎有关[26],细胞因子和生长因子等的刺激会激活MAPK 通路,促进免疫细胞成熟、活化和分化,并促进炎性细胞因子的合成、释放,参与炎症免疫反应[27]。
防风通圣丸方药中将防风、麻黄、荆芥穗和薄荷4种药材合用,可发汗解表,使外邪从汗而解,故为君药。君药中的活性成分β-谷甾醇、柚皮素、槲皮素、木犀草素、山柰酚、金合欢素、和芦荟大黄素可作用于TNF、HIF-1、NOS、PI3K-Akt、MAPK、VEGF 及Toll样受体通路中的TNF、RELA、MAPK1、MAPK3、F10、NOS2、PGTF2、IL-6和PGTS2等靶点发挥抗炎、调节免疫、抗病毒、抑制病毒释放和抗缺氧的作用。大黄、芒硝、滑石、栀子、石膏、黄芩、连翘和桔梗8味药共为臣药,可清热泻火、解毒散结。臣药中的活性成分大黄素、汉黄芩素、黄芩素、金合欢素、槲皮素、木犀草素和β-谷甾醇可调节TNF、HIF-1、VEGF、MAPK、PI3K-Akt和Toll样受体通路中的TNF、IL-6、CXCL8、MAPK14、NOS2、RELA、PTGS2和PIK3CG 等靶点起到抗炎、抗病毒、调节免疫和抗缺氧的作用。
为了进一步确定防风通圣丸抗COVID-19的药效物质基础,本研究采用分子对接技术对防风通圣丸活性成分进行对接验证。由分子对接结果可知,防风通圣丸中的10 种有效成分与SARS-CoV-2 3CL 水解酶和ACE2蛋白的结合能均小于-5.0 kJ·mol-1。其中β-谷甾醇、甘草查耳酮、山柰酚与SARS-Co V-2 3CL 水解酶的结合能甚至低于临床推荐使用的3CLpro抑制剂洛匹那韦,即该类化合物可能与3CLpro 直接结合,阻断病毒的增殖。槲皮素、木犀草素、山柰酚和柚皮素与ACE2的结合能较低,可能直接作用于人体细胞,阻断病毒的侵入。上述结论在一定程度上证实了网络药理学成分筛选的结果,表明防风通圣丸中的β-谷甾醇、槲皮素、木犀草素、山柰酚和柚皮素等可能为潜在的抗COVID-19的活性成分。
综上所述,本文用网络药理学及分子对接技术分析防风通圣丸治疗COVID-19 的作用机制,结果表明防风通圣丸中的β-谷甾醇、槲皮素、木犀草素、山柰酚、柚皮素等活性成分可与SARS-Co V-2 3CL 水解酶、ACE2 结合,通过多靶点的方式调节TNF、HIM-1和VEGF等多条通路,发挥抗炎、抗病毒和抗缺氧等作用,从而获得治疗COVID-19的效果,这为其临床应用提供了理论基础。
