一株拮抗芋头干腐病的贝莱斯芽孢杆菌的筛选与鉴定
2022-05-07张晓阳熊桂红彭文文周庆红黄英金蒋军喜
叶 莹,霍 达,2,张晓阳,3,刘 冰,熊桂红,彭文文,周庆红,黄英金,蒋军喜*
(1.江西农业大学 农学院/江西省薯芋生物学重点实验室,江西 南昌 330045;2.武夷学院 茶与食品学院,福建 武夷山 354300;3.江西省九江市植保植检局,江西 九江332000)
【研究意义】芋头是天南星科(Araceae)芋属(Colocasia)多年生块茎植物[1],因其营养丰富,口感粉糯,质地细腻而广受消费者青睐。由镰刀菌(Fusariumspp.)引起的芋头干腐病是国内外芋头贮藏期重要的真菌病害[2-4],罹病块茎发生皱缩、腐烂,直至空腔,失去食用价值。化学防治仍是目前有效防治芋头干腐病的主要措施,但由此引发的环境污染、病菌抗药性和农药残留等问题越来越引起人们的担忧[5]。生物防治作为一种安全有效无污染的植物病害防治方法,成为当今植物病害防控的研究热点[6]。因此,筛选鉴定出对芋头干腐病菌具有显著拮抗作用的生防菌株,对芋头干腐病的生物防治具有重要意义。【前人研究进展】目前已报道对镰刀菌干腐病具有良好防效的生防菌有木霉菌(Trichoderma)、链霉菌(Streptomyces)、假单胞菌(Pseudomonas)和芽孢杆菌(Bacillus)等。张茹等[7]从马铃薯根际土壤分离得到的长枝木霉(T.longibrachiatum)和深绿木霉(T.atroviride)对接骨木镰刀菌的抑菌率均高于80%;张紊玮等[8]研究发现假单胞菌属菌株YL11的无菌发酵液对硫色镰刀菌的菌丝生长、孢子萌发和毒素活性均有显著抑制作用;牛世全等[9]从河西走廊盐碱土壤中分离得到的球孢链霉菌(S.globisporus)发酵液对马铃薯干腐病的防效达65.46%;暹罗芽孢杆菌(B.siamensis)、枯草芽孢杆菌(B.subtilis)、死谷芽孢杆菌(B.vallismortis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、甲基营养型芽孢杆菌(B.methylotrophicus)等对马铃薯干腐病菌表现出良好的抑制效果[10-12]。【本研究切入点】芽孢杆菌是植物根际最为丰富的细菌类群,具有抗菌谱广、繁殖快、抗逆性强和生物安全性高等优点[13-14],它们通过拮抗作用、竞争作用及诱导植物获得系统抗性等机制在植物病害生物防治中发挥重要作用[15-16]。目前关于镰刀菌干腐病的生物防治仅在马铃薯上开展了较多研究,国内外尚无关于芋头干腐病生防芽孢杆菌筛选鉴定的报道。【拟解决的关键问题】本研究拟从植物根际土壤中分离筛选对芋头干腐病具有显著拮抗作用的芽孢杆菌,对该菌株进行种类鉴定及抑菌谱测定,以期为芋头干腐病及其他病害的生物防治提供新的生防菌株,为生防菌剂的研发应用奠定前期工作基础。
1 材料与方法
1.1 试验材料
1.1.1 供试土样 福建省南平市武夷山茶苗合作社基地的茶树根际土壤。
1.1.2 供试病原菌 芋头干腐病菌(尖孢镰刀菌(Fusarium oxysporum)、层出镰刀菌(F.proliferatum)和茄镰刀菌(F.solani))、猕猴桃果实熟腐病菌(Botryosphaeria dothidea)、猕猴桃黑斑病菌(Alternaria alterna-ta)、猕猴桃白纹羽病菌(Rosellinia necatrix)、猕猴桃棒孢叶斑病菌(Corynespora cassiicola)、茶轮斑病菌(Pseudopestalotiopsis camelliae-sinensis)、茶炭疽病菌(Colletotrichum fructicola)和茶双毛壳孢叶斑病菌(Discosia rubi)共10 种病原真菌;水稻白叶枯病菌(Xanthomonas oryzaepv.oryzae)、柑橘溃疡病菌(X.citrisubsp.citri)、辣椒细菌性斑点病菌(X.campestrispv.vesicatoria)、辣椒青枯病菌(Ralstonia solanacearum)和猕猴桃溃疡病菌(Pseudomonas syringaepv.actinidiae)等5种植物病原细菌。供试菌株均由本实验室前期分离鉴定保藏,经活化后备用。对照菌株为贝莱斯芽孢杆菌(Bacillus velezensis)FJ17-4,由福建省农业科学院植物保护研究所提供。
1.1.3 供试培养基 牛肉膏蛋白胨培养基(NA):蛋白胨10 g,氯化钠5 g,牛肉膏5 g,琼脂20 g,蒸馏水1 000 mL;牛肉膏蛋白胨培养液(NB):蛋白胨10 g,氯化钠5 g,牛肉膏5 g,蒸馏水1 000 mL;马铃薯琼脂培养基(PDA):马铃薯200 g,琼脂20 g,葡萄糖20 g,蒸馏水1 000 mL。
1.2 生防芽孢杆菌的分离筛选及抑菌活性测定
1.2.1 土壤中芽孢杆菌的分离 采用稀释平板分离法[17]对供试土样中的芽孢杆菌进行分离。取灭菌风干后的供试土壤10.0 g 放入含90 mL 无菌水的三角瓶中,混合均匀后将稀释液在85 ℃的水浴锅中水浴30 min。用无菌水稀释成10-3、10-4、10-5、10-6等不同浓度的土壤稀释液,吸取100µL 各稀释液均匀涂布NA平板,置于30 ℃恒温培养箱中黑暗培养24 h,挑取菌落形态差异明显的单菌落划线纯化,纯化后的菌株保存于4 ℃冰箱备用。
1.2.2 芽孢杆菌的筛选及病原真菌菌丝形态观察 采用平板对峙法[18],以芋头干腐病的优势病原菌茄镰刀菌作为指示菌进行拮抗菌筛选。实验前将纯化得到的芽孢杆菌分别接种于NA 液体培养基中,28 ℃、180 r/min震荡培养12 h,得到OD600为2.0的生防菌液。用直径为5 mm的无菌打孔器沿菌落边缘打取菌饼,将菌饼接种到PDA平板中央,在距平板中央3 cm处点接1µL生防菌液,以点接1µL无菌水作为对照,每处理重复3 次。接种后置于30 ℃恒温培养箱中培养6 d。选取有明显抑菌作用的菌株进行复筛,方法同上。用十字交叉法测量对照菌落直径和处理菌落直径,按下述公式计算抑菌率。在菌饼周围插上盖玻片碎片,待菌丝长上去后取下碎片观察菌丝的形态变化。选取抑菌效果最好的1株芽孢杆菌进行后续研究。抑菌率计算公式:
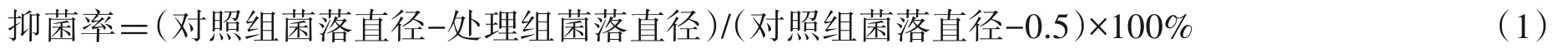
1.3 生防芽孢杆菌的形态观察及生理生化指标测定
1.3.1 菌体形态和培养特征观察 将获得的抑菌效果最好的芽孢杆菌菌株于NA固体培养基上纯化,置于30°C 恒温培养箱中培养48 h,肉眼观察菌落的形状、颜色及菌落边缘特征。通过革兰氏染色及芽孢染色,观察菌株形态。
1.3.2 生理生化测定 参照《常见细菌系统鉴定手册》[19]和《植病研究方法》[20],对待鉴定菌株D-1和对照菌株FJ17-4进行生理生化指标测定。
1.4 生防芽孢杆菌的分子生物学鉴定
1.4.1 基因组DNA 的提取 挑取纯化后的单菌落至NB 液体培养基中,28 ℃、180 r/min 震荡培养24 h。使用生工生物工程(上海)有限公司的Ezup柱式细菌基因组DNA抽提试剂盒提取菌株总DNA,用超微量核酸蛋白测定仪测定总DNA的浓度和纯度。
1.4.2 16SrDNA、gyrA和rpoB基因扩增及序列测定 以提取的基因组DNA 为模板,用引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′ )/1492R(5′-GGTTACCTTGTTACGACTT-3′ )、42F(5′-CAGTCAGGAAATGCGTACGTCCTT-3′)/1066R(5′-CAAGGTAATGCTCCAGGCATTGCT-3′)和2292F(5′-AGGTCAACTAGTTCAGTATGGAC-3′)/3354R(5′-AAGAACCGTAACCGGCAACTT-3′)[21-23]分别对16SrDNA、gyrA和rpoB基因进行PCR 扩增。PCR 反应总体积25 µL,包含ddH2O 8.5 µL、2×TaqPCR Master Mix 12.5 µL、正反向引物各1µL 和模板DNA 2µL。PCR 反应程序:94 ℃5 min;94 ℃30 s,50 ℃1 min,72 ℃2 min,35 个循环;72 ℃延伸10 min。PCR 产物经10 g/L 琼脂糖凝胶电泳检测后,委托生工生物工程(上海)有限公司进行序列测定。
1.4.3 序列比对与系统发育树构建 将所得的16SrDNA、gyrA和rpoB基因原始序列用DNAStar 分析软件进行序列拼接和核准后,提交到GenBank 中获取序列登录号,在NCBI(http://www.ncbi.nlm.nih.gov)中运行Blast 程序进行序列同源性搜索。下载相关菌株的对应基因序列,采用MEGA 7.0 软件邻接(Neighbour-joining)法分别构建基于16SrDNA、gyrA、rpoB基因序列的系统发育树,根据序列同源性大小和系统发育关系,确定该菌株的种类归属。
1.5 生防芽孢杆菌的抑菌谱测定
1.5.1 对9种植物病原真菌的抑菌效果 除目标菌茄镰刀菌外,对供试病原菌中的其他9种真菌进行抑菌效果测定,以明确其对植物病原真菌的抑菌范围大小,测定方法同1.2.2。
1.5.2 对5 种植物病原细菌的抑菌效果 采用牛津杯法[24],将纯化后的5 种植物病原细菌和生防芽孢杆菌分别接种于NA 液体培养基中,28 ℃、180 r/min 震荡培养24 h,得到OD600为2.0 的生防菌液和病原菌液。分别吸取200µL相应病原菌液与NA固体培养基充分混匀后倒板,在NA平板中心放上直径为5 mm的牛津杯,每个牛津杯内接70µL 生防菌液,每处理3 个重复,28 ℃培养24 h 后观察有无抑菌圈产生,测量并记录抑菌圈直径。
1.6 数据处理
使用Excel 2016、SPSS 21.0对所得数据进行统计处理,采用新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 芽孢杆菌的分离筛选及抑菌效果
从福建省南平市武夷山茶苗专业合作社基地的茶树根际土壤中共分离得到89 株芽孢杆菌,用茄镰刀菌筛选得到4 株有明显拮抗作用的芽孢杆菌,其中菌株D-1 对茄镰刀菌抑菌效果最好,抑菌率达74.5%(图1-A)。通过镜检,发现被抑制的菌丝出现扭曲和节状膨大等畸形现象(图1-D)。
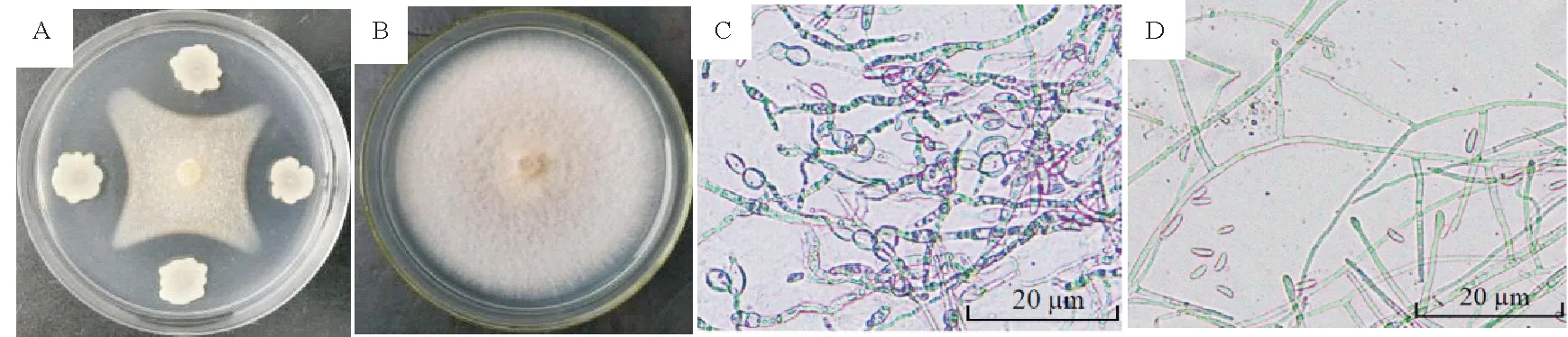
图1 拮抗菌株D-1对茄镰刀菌菌落和菌丝生长的抑制作用Fig.1 Inhibition effect of antagonistic strain D-1 on colony and hyphal growth of Fusarium solani
2.2 菌株D-1的形态观察及生理生化指标测定
D-1 菌株在NA 培养基上28 ℃培养36 h 后,菌落圆形,乳白色,不透明,表面干燥有皱褶,边缘不整齐,中央凹陷(图2-A)。菌体呈杆状,大小1.5~4.0 µm×0.4~0.6 µm,单个或成对排列,革兰氏染色呈阳性,4 d后有大量椭圆形芽孢产生(图2-B)。对D-1菌株进行生理生化特性测定,结果与对照菌株贝莱斯芽孢杆菌FJ17-4的生理生化测定结果一致(表1)。根据菌株D-1的形态特征和生理生化特性,参照《常见细菌系统鉴定手册》,初步将菌株D-1鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
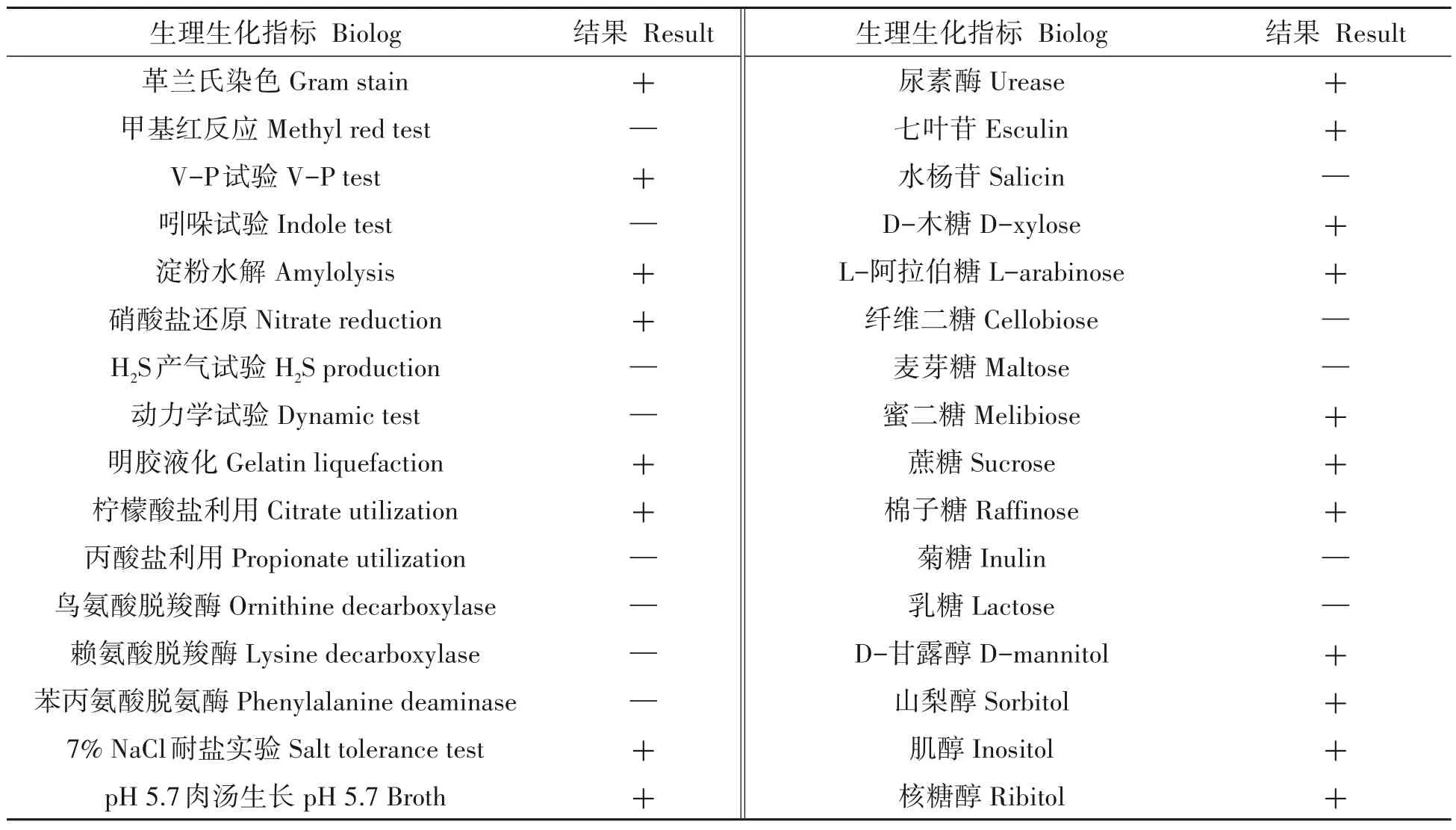
表1 拮抗菌株D-1的生理生化特性测定Tab.1 Physiological and biochemical characteristics of the antagonistic strain D-1

图2 拮抗菌株D-1的菌落及菌体形态特征Fig.2 Morphological features of colony and bacterium of antagonistic strain D-1
2.3 菌株D-1的16S rDNA、gyrA和rpoB序列分析及系统发育树构建
以供试菌株D-1的基因组DNA 为模板,分别扩增其16SrDNA、gyrA和rpoB基因片段,经电泳检测后均获得明亮单一的目的条带(图3),经测序得到长度分别为1 420,1 010,580 bp 的序列。将序列提交至GenBank数据库,获得的基因登录号分别为MZ749456、MZ771302和MZ771303。通过对菌株D-1基因序列的BLAST 比对发现,这3 个序列与GenBank 中贝莱斯芽孢杆菌(Bacillus velezensis)对应序列同源性均为100%。采用MEGA 7.0 软件,分别构建基于16SrDNA、gyrA和rpoB基因序列的系统发育树,结果显示菌株D-1 的16SrDNA、gyrA和rpoB序列均与贝莱斯芽孢杆菌聚为一支(图4A-C)。结合形态学特征、生理生化特性及序列分析结果,将拮抗菌株D-1鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。

图3 拮抗菌株D-1的不同基因PCR扩增产物电泳结果Fig.3 Electrophoresis of PCR products amplified from different genes of antagonistic strain D-1

图4 基于16S rDNA(A)、gyrA(B)和rpoB(C)基因序列构建的芽孢杆菌系统发育树Fig.4 Phylogenetic tree of Bacillus based on 16S rDNA(A),gyrA(B)and rpoB(C)gene sequences
2.4 菌株D-1对植物病原真菌的抑制作用
菌株D-1 对9 种供试病原真菌菌丝生长均有较强的抑制作用(图5),抑菌率为77.07%~60.80%(表2),其中对猕猴桃白纹羽病菌的抑制作用最强,对猕猴桃果实熟腐病菌的抑制作用最弱。

图5 拮抗菌株D-1对9种植物病原真菌的抑菌作用Fig.5 Antagonistic effect of antagonistic strain D-1 on 9 plant pathogenic fungi

表2 拮抗菌株D-1 对9种植物病原真菌的抑制作用Tab.2 Antagonistic effect of strain D-1 on 9 plant pathogenic fungi
2.5 菌株D-1对植物病原细菌的抑制作用
菌株D-1对5种供试植物病原细菌均具有拮抗作用(图6),抑菌圈直径介于33.75~14.00 mm(表3),其中对猕猴桃溃疡病菌和辣椒细菌性斑点病菌拮抗效果显著,对其他3种植物病原细菌抑菌效果较弱。

表3 拮抗菌株D-1对5种植物病原细菌的抑制作用Tab.3 Antagonistic effect of strain D-1 on 5 plant pathogenic bacteria

图6 拮抗菌株D-1对5种病原细菌的抑菌作用Fig.6 Antagonistic effect of antagonistic strain D-1 on 5 pathogenic bacteria
3 结论与讨论
本研究从福建省南平市的茶树根际土壤中分离筛选到1 株对芋头干腐病菌具有明显拮抗作用的生防芽孢杆菌菌株D-1,并对其进行了形态观察、生理生化特性测定和分子生物学鉴定。其菌落形态特征和生理生化特性符合对贝莱斯芽孢杆菌(B.velezensis)的描述,测定的16SrDNA、gyrA和rpoB3 个基因序列与贝莱斯芽孢杆菌对应序列具有最高的同源性,在构建的系统发育上与贝莱斯芽孢杆菌也聚于一个分支,基于以上结果,将该菌株的种类鉴定为贝莱斯芽孢杆菌。该菌不仅对芋头干腐病菌(Fusariumspp.)具有显著的抑菌效果,而且对多种其他植物病原真菌和病原细菌也有良好的拮抗作用,表现出广谱抑菌活性,具有潜在的生防利用价值。
干腐病是薯芋类作物贮藏期发生的一种重要的真菌病害,国内外对马铃薯[25]、甘薯[26]和薯蓣[27]上的干腐病均有一定的研究,但对芋头干腐病的研究很少,特别是对其生物防治研究尚未开展。周洁等[28]研究发现,南方镰刀菌(F.meridionale)和变红镰刀菌(F.incarnatum)可引起湖北恩施魔芋干腐病,30%苯甲丙环唑乳油对2种病原菌的菌丝生长抑制率均达85%以上;赵璐藐等[29]研究表明,茄镰刀菌(F.solani)可引起奉化地区芋艿的采后腐烂,桧木醇处理后可明显抑制病原菌菌丝生长和孢子萌发,在控制芋艿采后病害方面具有较好的应用前景。本文从茶树根际土壤中分离筛选到对芋头干腐病菌(Fusariumspp.)具有明显拮抗作用的生防贝莱斯芽孢杆菌D-1,为该病的生物防治提供了新的微生物资源。
致谢:江西省科技计划项目(2018ACF60017)和江西省薯类产业技术体系建设项目(JXARS-19-01)同时对本研究给予了资助,谨致谢意!
