黄瓜果实CsMYB62克隆及其对CsGR-RBP3表达的调控
2022-05-06武春爽汤冰琳何金明曲姗姗朱世江
王 斌 武春爽 汤冰琳 王 光 何金明 曲姗姗 朱世江,*
(1 韶关学院英东生物与农业学院, 广东 韶关 512005;2 华南农业大学园艺学院, 广东 广州 510642)
MYB(v-myb avian myeloblastosis viral oncogene homolog)转录因子存在于所有真核生物中,因序列中含有MYB保守结构域而得名[1]。MYB转录因子氨基酸序列中含有1~4个串联的MYB保守域,每个保守域大约含有52个氨基酸残基[2]。根据保守域数量,MYB转录因子可分为四种类型,即4R-MYB(含有4个MYB保守域),3R-MYB(R1R2R3-MYB),2R-MYB(R2R3-MYB)和1R-MYB(MYB like),每个MYB保守域都由1个螺旋-转角-螺旋结构构成[3]。四种类型的MYB在植物中均有发现,而R2R3-MYB的数量最多。例如,在水稻(OryzasativaL.)和拟南芥(ArabidopsisthalianaL.)基因组中,分别有56.77%和70.05%的MYB转录因子是R2R3-MYB[4];玉米(ZeamaysL.)基因组中的R2R3-MYB转录因子超过200个[5]。
在玉米中最先克隆出MYB基因,目前的研究表明,植物基因组中均含有MYB基因。近几年的研究表明,MYB转录因子是植物最大的转录因子家族之一[6]。比如,水稻、拟南芥[4]和番茄(SolanumlycopersicumL.)[7]基因组中分别含有155、197和121个MYB基因。作为植物最大的转录因子家族之一,MYB转录因子的生物学功能十分丰富,其功能主要涉及调控次生代谢产物合成[8-9]、形态建成[10]、细胞周期[11-12]、生长发育[13]和信号转导[14]等。同时,MYB还广泛参与对多种生物和非生物胁迫的响应以及对胁迫作出抗性反应[15-16]。
采后果蔬由于脱离母体,失去养分供应来源,只能依靠自身的呼吸代谢来维持正常的生命活动[17]。各种生理代谢活动会不断消耗自身养分,加速采后果蔬的衰老进程,缩短贮藏寿命。而通过降低采后果蔬自身和贮藏环境的温度,可降低采后果蔬呼吸强度,抑制病原微生物的生长速度,减少乙烯释放,从而抑制自身代谢活力、延长贮藏期[18]。但原产于热带或亚热带的果蔬在低温贮藏条件下易产生冷害[19-20]。黄瓜(CucumissativusL.)原产于热带亚热带地区,对低温十分敏感,在10℃及以下温度贮藏时即会发生冷害[21]。冷害使得果皮细胞受损,导致抗病性降低,在贮藏期很容易被致病菌侵染,发生严重的次生病害,导致严重的经济损失[22]。因此,通过分子育种培育耐冷性强的黄瓜品种,是提高采后黄瓜耐冷性的根本手段。因此,挖掘低温响应MYB基因并初步探究其生物学功能,能为黄瓜的品种改良提供重要候选基因资源。目前,在拟南芥、水稻和番茄等模式植物中关于MYB转录因子的研究较多,而对于果菜类蔬菜耐冷相关MYB转录因子的分离及其调控机制仍有待深入研究。
植物富甘氨酸蛋白(glycine-rich proteins, GRPs)。该蛋白是一类具有丰富甘氨酸重复序列的蛋白质,根据结构特征,将其分为4个亚家族[23]。其中,第四亚家族的GRP氨基酸序列的N端含有RNA识别域(RNA recognition motifs, RRM)、冷休克结构域(cold-shock domain)或锌指结构(zinc fingers)等保守结构域[24]。富甘氨酸RNA结合蛋白(glycine-rich RNA-binding protein, GR-RBP)属于GRP的第四亚族,其结构中至少含有1个RRM结构域[25]。本试验前期的研究结果证实,低温诱导的CsGR-RBP3表达上调是黄瓜果实耐冷性增强的重要原因[25-26]。前期分析启动子序列发现,该基因的启动子序列中含有丰富的MYB结合元件,表明MYB可能调控CsGR-RBP3表达。但目前MYB转录因子通过CsGR-RBP3调控采后黄瓜耐冷性的分子机理仍不清楚。因此,本研究通过生物信息学的方法,鉴定与CsGR-RBP3表达模式一致的MYB基因,以采后黄瓜为材料克隆CsMYB62基因全长序列,并采用分子生物学的方法,初步探究CsMYB62调控CsGR-RBP3表达的潜在机制。克隆并鉴定调控CsGR-RBP3表达的MYB转录因子,对于丰富MYB调控网络以及解析植物诱导耐冷性的分子机理具有重要意义。
1 材料与方法
1.1 试验材料与菌株
供试黄瓜品种为翠夏,采自广东省台山市当地农场(22°03′37.63″N,112°56′35.83″E)。黄瓜果实在园艺成熟度时进行采收,采收后立即运回广东省果蔬保鲜重点实验室。
大肠杆菌DH 5α、BL21(DE3)和农杆菌GV3101感受态细胞购于上海唯地生物技术有限公司。
1.2 采后黄瓜低温处理和转录组测序
挑选大小、成熟度基本一致,无病虫害的黄瓜果实作为供试材料,分成3组,每组代表1个重复,每重复包含20根黄瓜果实。每个重复单独用聚乙烯薄膜塑料袋包裹后,放置在5℃恒温培养箱中处理72 h。取样时间点为处理期间的0、6、12、24、48和72 h,取果皮作为分析样品,液氮速冻并保存在-80℃冰箱备用。
选取处理0、12和72 h 3个时间点,进行转录组测序。转录组测序试验委托百迈客生物科技有限公司(北京)完成,具体方法和步骤见文献[27]。用差异倍数(fold change, FC)和显著水平两个参数筛选差异表达基因,阈值设定为:log2(FC)>2,且Q<0.05。基因的表达量用每千个碱基的转录每百万映射读取的片段数(fragments per Kilobase per Million, FPKM)值表示,在百迈客公司的云平台(http://www.biocloud.net/siyouyun?utm_source=triggermail)分析差异表达基因的共表达趋势。共表达趋势分析采用K均值聚类法,将相同表达趋势的mRNA划分为一个数据集,并对该数据集作表达模式图,所用距离测度为欧氏距离。
1.3 试验方法
1.3.1 黄瓜CsMYB62基因的克隆 使用北京天根生化科技有限公司的植物总RNA提取试剂盒(产品编号:DP441)提取黄瓜果皮总RNA。用1%的琼脂糖凝胶电泳检测总RNA完整性,用NanoOne超微量紫外分光光度计(杭州佑宁仪器有限公司)测定浓度。之后使用上海翊圣生物科技有限公司的反转录试剂盒(产品编号:11141ES60)合成第一链cDNA。总RNA提取和cDNA合成按照试剂盒说明进行。
根据转录组测序预测的开放阅读框(open reading frame, ORF),设计特异性全长引物,引物序列见表1。以黄瓜果皮cDNA为模板,使用南京诺唯赞生物科技股份有限公司的高保真DNA聚合酶(产品编号:P502)扩增CsMYB62全长序列。扩增完后在产物的3′端加A尾,使用1.5%的琼脂糖凝胶电泳分离PCR产物。
将目的条带切胶回收,并连接到pMD 18-T载体上,转化DH 5α感受态细胞。将转化重组质粒后的DH 5α大肠杆菌涂布在含有氨苄霉素的LB固体平板上,37℃过夜培养。挑取阳性单克隆菌落,加至PCR反应液中,进行PCR扩增反应。PCR反应体系为20 μL:正反向引物各1 μL,2×Taq PCR Star Mix 10 μL和无菌水 7 μL,单菌落1 μL。反应条件为:95℃预变性2 min,95℃变性15 s,60℃退火20 s,72℃延伸26 s,35个循环。2×Taq PCR StarMix(产品编号:A012)购自北京康润诚业生物科技有限公司。
将成功转化重组载体的单菌落送至生工生物工程有限公司(广州分公司)测序。使用DNAMAN软件比对测序序列与基因组中公布的序列。
1.3.2 生物信息学分析 使用NCBI数据库的CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)预测保守结构域,利用在线工具WebLogo(http://weblogo.berkeley.edu/logo.cgi)分析保守结构域氨基酸保守性,通过Nine Amino Acids Transactivation Domain 9aa TAD Prediction Tool(https://www.med.muni.cz/9aaTAD/index.php)在线工具预测CsMYB62的转录激活域。
运用ExPASy ProtScale(https://web.expasy.org/protscale/)分析理化性质,利用DNAMAN软件进行氨基酸序列多重比对,并以MEGA 7.0中的邻接法构建系统发育进化树。
1.3.3 CsMYB62蛋白亚细胞定位观察 将CsMYB62全长(不含终止密码子)连接在pCAMBIA 2300-GFP载体的KpnⅠ酶切位点处,构建亚细胞定位重组质粒。用于构建重组载体的引物信息见表1。重组载体转化DH 5α感受态细胞,并经PCR扩增和测序验证后,采用冷冻法转化GV3101农杆菌感受态细胞,操作方法见感受态使用说明书。
使用真空渗透法将含有重组质粒的GV3101农杆菌注射入烟草叶片的背面细胞。农杆菌与烟草叶片共培养72 h后,使用德国ZEISS公司的正置荧光显微镜检测GFP荧光在烟草叶片细胞中的分布。
1.3.4 qRT-PCR检测 使用上海翊圣生物科技有限公司的qRT-PCR检测试剂盒(产品编号:11201ES03)和美国Bio-Rad公司的qRT-PCR仪检测基因表达。具体反应体系为20 μL:cDNA模板1 μL,正反向引物各1 μL,PCR Mix 10 μL和RNase free water 7 μL。反应条件为:95℃预变性2 min,95℃变性15 s,60℃退火20 s,72℃延伸26 s,40个循环。所用引物见表1。
1.3.5 pGEX-4T-1-CsMYB62融合载体构建、融合蛋白表达和纯化 将pGEX-4T-1载体在EcoRⅠ酶切位点处单酶切,使用上海生工生物工程有限公司的即用型无缝克隆试剂盒(产品编号:B632219),将CsMYB62全长序列插入线性化载体中,构建pGEX-4T-1-CsMYB62融合表达载体。重组载体转化DH 5α,之后进行菌液PCR和测序验证,以保证序列的准确性。构建重组载体所用引物见表1。
之后将重组载体转化表达菌株BL21(DE3),诱导CsMYB62-GST融合蛋白表达。使用上海生工生物工程有限公司的GST重组蛋白纯化试剂盒[GST-Sefinose(TM)kit](产品编号:C600327)纯化融合蛋白,具体步骤按照试剂盒说明书进行。
1.3.6 EMSA分析 在探针的3′端使用biotin生物素标记探针,探针由生工(上海)生物工程有限公司合成并标记,探针信息见表2。将纯化后的CsMYB62蛋白与探针在室温条件下孵育20 min后,按照上海碧云天生物技术有限公司的EMSA/Gel-Shift试剂盒(产品编号:GS009)操作说明进行。

表2 探针信息
1.3.7 双荧光素酶报道基因试验 将CsGR-RBP3启动子片段(ATG上游-235 bp~-464 bp)构建到pGreenⅡ 0800-LUC 载体上,作为报告基因[28],将CsMYB62的基因全长重组到pGreenⅡ 62 SK 载体上作为效应基因,以空载体作为对照,载体构建引物信息见表1。
采用真空渗透法将含有效应基因和报告基因的农杆菌GV3101共转化烟草叶片背面细胞,共培养72 h,使用上海翊圣公司的双荧光素酶检测试剂盒(产品编号:11402ES60)和美国Thermo公司的多功能化学发光仪,同时检测转基因烟草叶片的萤火虫荧光素酶(luciferase, LUC)和海肾荧光素酶(renilla luciferase, REN)的发光值,通过计算LUC/REN的比值来反映CsMYB62对CsGR-RBP3启动子的转录激活活性。
1.4 数据分析
使用Excel 2016软件记录、整理和分析数据,并进行绘图制表等工作。使用SPSS 22.0统计分析软件采用单因素方差分析法检验样品间以及处理时间点间的差异显著性,使用不同的小写字母标注数据间的差异显著性。
2 结果与分析
2.1 低温处理对黄瓜果实CsMYB62和CsGR-RBP3表达的影响
CsGR-RBP3启动子中含有5个潜在的MYB转录因子结合位点,表明MYB转录因子可能调控CsGR-RBP3表达。为鉴定可能调控CsGR-RBP3表达的MYB转录因子,利用转录组数据进行了差异表达基因的共表达网络趋势分析。结果显示,共有282个差异表达基因的表达趋势与CsGR-RBP3一致(图1-A)。其中,鉴定到7个MYB基因在低温处理72 h后,表达量增加。进一步采用qRT-PCR法分析这7个MYB基因在整个低温处理期间的表达模式,发现在整个低温处理期间,仅有CsMYB62与CsGR-RBP3的表达模式一致,其表达量均随处理时间增加(图1-B、C)。由此推测CsMYB62可能是调控CsGR-RBP3表达的候选转录因子。

注: 不同小写字母表示在P<0.05水平上差异显著。
2.2 CsMYB62基因克隆与生物信息学分析
为进一步分析CsMYB62的功能,从黄瓜果皮中克隆了该基因的cDNA全长序列。从PCR产物的电泳图中可以看出,目的产物片段长度小于1 000 bp。而黄瓜CsMYB62的cDNA全长为834 bp,说明可能克隆到黄瓜CsMYB62基因(图2-A)。之后将该PCR产物回收,连接到pMD 18-T载体上,构建克隆载体。测序结果显示,目的PCR产物序列与基因组[Cucumber(Chinese Long)v3 Genome, http://www.cucurbitgenomics.org/organism/20]中公布的CsMYB62(基因组中的登录号:CsaV3_1G003920)序列一致(图3),表明成功克隆到CsMYB62全长。CsMYB62基因定位在基因组的1号染色体上,基因结构中含有3个外显子(图2-B)。

注:M:DNA分子量标准(DL2000);1:CsMYB62基因的PCR产物;椭圆形长条表示外显子,横线表示内含子。
如图3所示,黄瓜果实CsMYB62基因编码序列由834 bp核苷酸组成,编码277个氨基酸残基。使用ExPASy-ProtParam在线工具分析了黄瓜CsMYB62蛋白的基本特性,CsMYB62蛋白的理论分子量和等电点分别为31.19 kDa和5.9。在277个氨基酸残基中,带负电荷和正电荷的氨基酸残基总数分别为33和28个,其中,丝氨酸比例最高,达15.2%。

图3 黄瓜CsMYB62基因核苷酸和氨基酸序列
CsMYB62蛋白与甜瓜(Cucnmismelo)CmMYB24蛋白(XP_008453409.1)的氨基酸序列同源性最高,为90.97%。与拟南芥AtMYB62(NP_176999.1)、水稻OsJAMYB(XP_015618000.1)和番茄SlMYB62(XP_004239413.2)的序列同源性介于48.45%~71.53%之间。这5种MYB蛋白的氨基酸序列中均包含1个SANT保守域和1个MYB DNA结合域(图4-A),表明其均是典型的R2R3-MYB转录因子。
借助WebLogo在线工具分析了黄瓜CsMYB62蛋白与4种其他植物MYB蛋白(甜瓜CmMYB24、拟南芥AtMYB62、水稻OsJAMYB和番茄SlMYB62)的SANT和MYB保守域的氨基酸序列保守性。结果显示,这5个MYB蛋白的SANT结构域中有33个氨基酸完全一致(图4-B),MYB结构域中有36个氨基酸完全一致(图4-C),表明不同植物间的SANT和MYB结构域在进化过程中高度保守。
在NCBI数据库中通过同源比对,找到了28个与黄瓜CsMYB62蛋白同源性较高的MYB转录因子,利用MEGA软件构建这29个MYB蛋白的系统发育树。可知,黄瓜CsMYB62蛋白与其他植物MYB蛋白的进化关系较近(图5)。其中,黄瓜CsMYB62蛋白与甜瓜CmMYB24蛋白(XP_008453409.1)的亲缘关系最近。

注: CsMYB62蛋白及登录号用黑色方框标出。
2.3 CsMYB62蛋白的亚细胞定位
将CsMYB62全长序列(不含终止密码子)构建到pCAMBIA 2300-GFP载体上,并导入烟草叶片背面细胞。通过观察GFP蛋白在烟草细胞中的定位发现,在烟草叶表皮细胞的细胞质和细胞核中,均观察到空载的GFP荧光信号,而CsMYB62只在烟草叶片细胞的细胞核中观察到了荧光信号(图6),表明CsMYB62定位在细胞核,是核定位蛋白,符合转录因子的定位特性。
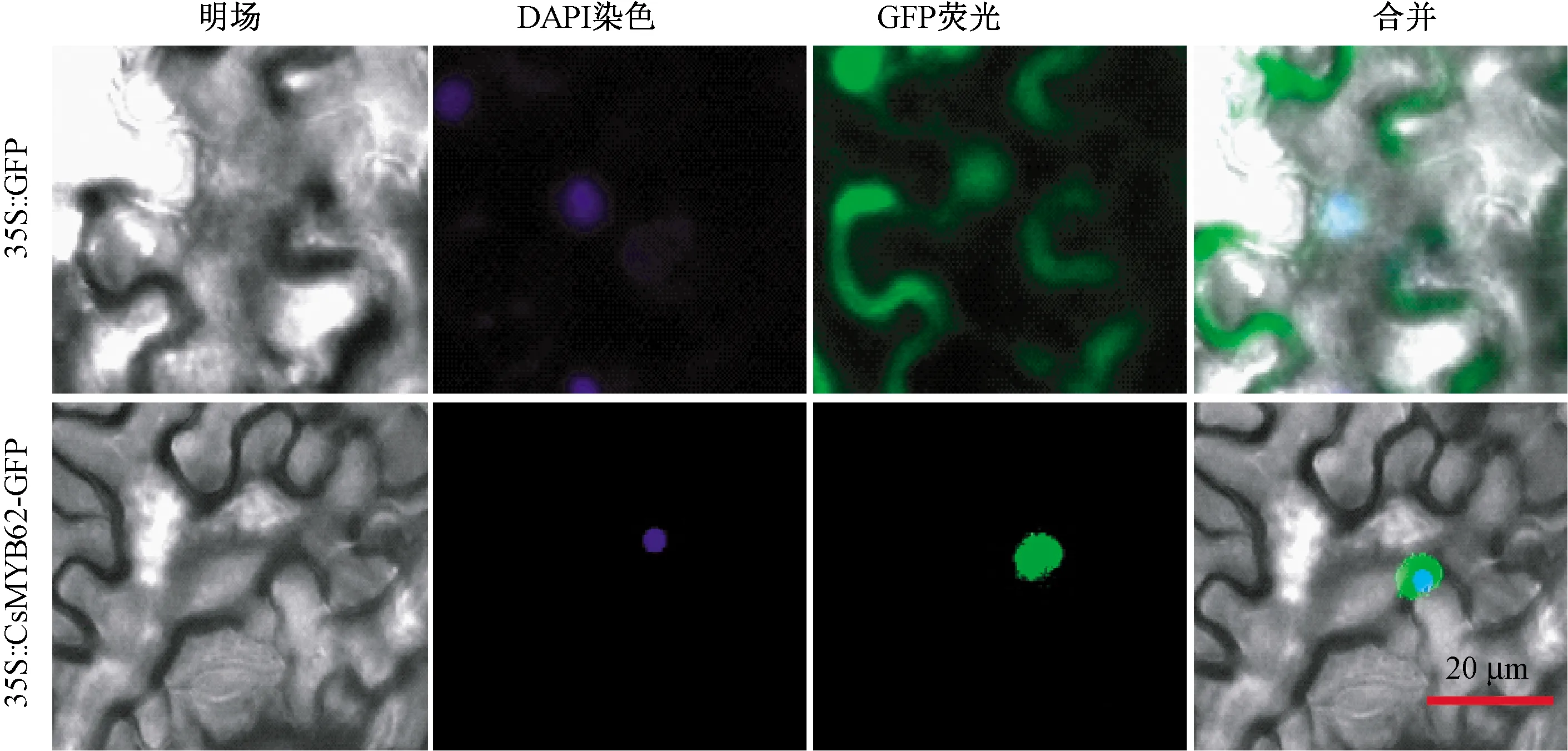
图6 黄瓜CsMYB62蛋白的亚细胞定位
2.4 CsMYB62转录因子与CsGR-RBP3启动子的结合
在CsGR-RBP3开放阅读框ATG上游启动子序列的-347~-307 bp之间,含有2个串联的MYB结合元件(图7-A)。为验证CsMYB62转录因子是否能与这2个MYB结合位点结合,开展了凝胶阻滞迁移试验。结果(图7-B)显示,当CsMYB62蛋白与用生物素标记的CsGR-RBP3启动子探针共同孵育时,检测到转录因子与启动子的复合物,且竞争性探针影响CsMYB62蛋白与CsGR-RBP3启动子的结合能力(图7-B)。表明CsMYB62蛋白能直接与CsGR-RBP3启动子相结合,从而调控其表达。

注:A:MYB结合位点在CsGR-RBP3启动子中的位置;B:CsMYB62蛋白与CsGR-RBP3启动子结合的电泳迁移分析。
2.5 CsMYB62转录因子对CsGR-RBP3启动子的激活活性
使用双荧光素酶报道基因试验验证CsMYB62是否能激活CsGR-RBP3启动子活性。载体构建示意图如图8-A所示,将CsGR-RBP3启动子序列构建到pGreenⅡ 0800-LUC载体上,作为报告基因。将CsMYB62全长片段构建到pGreenII 62-SK载体上,作为效应基因。双荧光素酶报道基因试验的结果(图8-B)显示,与对照(SK+pro-LUC)相比,CsMYB62与CsGR-RBP3启动子共表达(SK-MYB62+ pro-LUC)能够显著增强LUC活性,而与pGreenII 0800 LUC空载共表达(SK-MYB62+LUC)不会显著增加LUC活性。上述结果表明,CsMYB62转录因子能在体内与CsGR-RBP3启动子结合,并增强启动子活性。
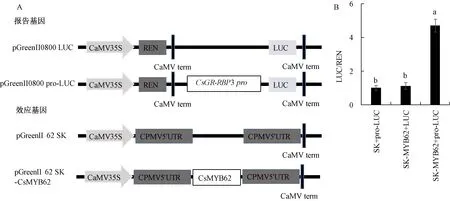
注:A:载体构建示意图;B:CsMYB62对CsGR-RBP3启动子的转录激活活性;不同小写字母表示在P<0.05水平上差异显著。
3 讨论
植物GR-RBP的表达受低温胁迫等多种非生物胁迫因子诱导,在增强植物抗逆性中起重要作用[29]。本研究前期发现,黄瓜果实CsGR-RBP3表达在低温处理后上调,该基因的表达与采后黄瓜耐冷性正相关[25-26],但该基因表达的转录调控机理尚不清楚。对启动子序列的生物信息分析结果发现,启动子区域含有丰富的MYB转录因子结合位点,表明MYB转录因子可能参与CsGR-RBP3表达的调控。植物R2R3-MYB转录因子响应低温并与耐冷性密切相关,且能直接调控下游基因的表达[30-31]。为鉴定调控CsGR-RBP3表达的转录因子,本试验利用转录组测序数据进行了共表达趋势分析,结果显示,CsMYB62的表达模式与CsGR-RBP3相似。由此推测CsMYB62转录因子可能调控CsGR-RBP3的表达。
本研究的基因表达分析结果证实,CsMYB62能被5℃低温处理所诱导,且表达量随处理时间的延长而增加。在玉米、水稻和拟南芥等植物中也报道了相似的结果[32-34]。4℃低温能迅速诱导玉米ZmMYB31基因的表达,在拟南芥中过表达该基因,能够显著提高转基因植株的超氧化物歧化酶和抗坏血酸过氧化物酶活性,从而增强耐冷性[32]。盐、低温和干旱胁迫均能显著上调水稻OsMYB2基因的表达。在水稻中过表达该基因,增强了植物对盐、低温和干旱胁迫的耐受性[33]。水稻OsMYB2蛋白定位在细胞核,超表达OsMYB2显著上调与脯氨酸合成和转运有关基因的表达,从而增强水稻耐冷性[34]。上述结果表明,CsMYB62是一个低温响应转录因子基因,同时推测其可能在黄瓜果实的低温应答和耐冷性调控中发挥重要作用。
克隆是研究目标基因功能的前提和基础[35]。为进一步分析CsMYB62基因的功能,本研究从黄瓜果皮中克隆到了CsMYB62基因全长序列。黄瓜CsMYB62基因开放阅读框长度为834 bp,共编码277个氨基酸残基。黄瓜CsMYB62蛋白含有SANT和MYB保守结构域,表明CsMYB62是典型的R2R3-MYB转录因子。不同植物MYB转录因子的SANT和MYB保守域保守性很高、进化关系较近,表明植物R2R3-MYB转录因子在进化中高度保守,这可能是植物适应环境胁迫的重要原因之一。
R2R3-MYB转录因子通过直接调控下游基因的表达而发挥作用[2]。拟南芥AtMYB96蛋白是一个核定位蛋白,且低温能诱导AtMYB96表达,AtMYB96蛋白通过直接与AtHHP基因的启动子结合,调控AtHHP表达[36]。苹果(Malusdomestica)MdMYB88和MYB124能迅速响应低温处理,增强拟南芥和苹果愈伤组织抗冻性,且能与MdCSP3和MdCCA1启动子结合,直接调控MdCSP3和MdCCA1基因的表达[37]。同样,低温胁迫能诱导苹果MdMYB23基因的表达,MdMYB23蛋白通过直接与MdCBF1与MdCBF2启动子结合,激活MdCBF1与MdCBF2基因的表达[38]。本研究中,CsMYB62定位在细胞核,且能直接绑定到CsGR-RBP3启动子上,证实了CsMYB62直接调控CsGR-RBP3表达。同时,CsMYB62与CsGR-RBP3在低温处理期间的表达模式一致,表达量均随低温处理时间的延长而增加,CsMYB62蛋白能增强CsGR-RBP3启动子活性,表明CsMYB62通过激活CsGR-RBP3表达,调控采后黄瓜耐冷性。CsMYB62是否与其他转录因子(如NAC、MYB、MYC、bHLH等)相互作用,从而调控CsGR-RBP3表达,以及CsMYB62和CsGR-RBP3是否同时受其他转录因子的调控,尚需进一步研究。
4 结论
本试验从黄瓜果皮中分离了1个R2R3-MYB转录因子CsMYB62。CsMYB62蛋白定位在细胞核,并能与CsGR-RBP3启动子结合,激活CsGR-RBP3启动子活性。以上结果表明,CsMYB62通过直接调控CsGR-RBP3的表达,从而调控采后黄瓜的耐冷性。本研究结果丰富了MYB转录因子的调控网络,加深了对黄瓜果实诱导耐冷性的转录调控机制的认识。
