基于网络药理学探讨黄芪治疗子宫内膜癌的机制
2022-05-06姜丕雨李康康周静祎王雪莲程明阳陈雪红
姜丕雨 李康康 周静祎 王雪莲 程明阳 陈雪红






[摘要]目的采用网络药理学方法探讨黄芪治疗子宫内膜癌的作用机制。方法应用中药系统药理学数据库和分析平台(TCMSP)筛选出黄芪潜在活性成分,在线人类孟德尔遗传数据库(OMIM)和Genecards等数据库搜索子宫内膜癌的靶点信息。基于Cytoscape 3.7.0软件构建“活性成分-靶点”网络,使用插件Biogenet和Merge功能获得黄芪治疗子宫内膜癌的关键靶点,应用Metascape软件对关键靶点进行GO和KEGG富集分析。结果获得黄芪有效成分17个,药物靶点198个,子宫内膜癌靶点1 845个,关键靶点238个,KEGG通路151条,关键生物学通路有细胞周期、DNA修复、细胞凋亡和癌症通路等。结论黄芪通过多成分-多靶点-多通路的方式来干预子宫内膜癌的发生和发展。
[关键词]网络药理学;黄芪;子宫内膜肿瘤
[中图分类号]R282.71[文献标志码]A[文章编号]2096-5532(2022)02-0242-05
doi:10.11712/jms.2096-5532.2022.58.045[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220311.1333.002.html;2022-03-1414:19:13
MECHANISM OF ACTION OF ASTRAGALI RADIX IN TREATMENT OF ENDOMETRIAL NEOPLASMS: A STUDY BASED ON NETWORK PHARMACOLOGY JIANG Piyu, LI Kangkang, ZHOU Jingyi, WANG Xuelian, CHENG Mingyang, CHEN Xuehong (Department of Special Medicine, School of Basic Medicine, Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo explore the mechanism of action of Astragali Radix in the treatment of endometrial neoplasms (EN) based on network pharmacology. MethodsThe active ingredients of Astragali Radix were identified using the Traditional Chinese Medicine Systems Pharmacology (TCMSP) database. The targets of EN were searched for in Online Mendelian Inheritance in Man (OMIM) and Genecards. Cytoscape 3.7.0 was used to construct an “active ingredient-target” network. Biogenet and Merge were used to obtain the key targets involved in EN treatment with Astragali Radix. Metascape was used to perform GO and KEGG enrichment analyses of the key targets. ResultsThere were 17 active ingredients in Astragali Radix, 198 drug targets, 1 845 EN targets, 238 key targets, and 151 KEGG pathways. The key biological pathways included cell cycle, DNA repair, apoptosis, and cancer pathway. ConclusionAstragali Radix interferes with the development and progression of EN with multiple components, targets, and pathways.
[KEY WORDS]network pharmacology; astragalus propinquus; endometrial neoplasms
子宮内膜癌(EN)是发生在子宫内膜的一组上皮性恶性肿瘤,是女性生殖系统常见恶性肿瘤之一,且近几年EN的发病率逐渐上升[1]。EN发病与多种因素有关,目前针对EN治疗以手术为主,辅以放疗和化疗[2]。但化疗药物具有较强的毒副作用,而中药抗肿瘤具有多靶点、多方位以及不易产生耐药性等优点,在临床上已成为肿瘤治疗的重要研究方向[3]。近年来临床上将黄芪应用于多种肿瘤的治疗,效果显著,且有体外细胞实验证明黄芪对EN细胞有较强的抑制作用[4]。本研究应用网络药理学的方法,系统地探究黄芪的有效活性成分、潜在作用靶点以及调控的通路信息,为黄芪治疗EN提供理论依据。现将结果报告如下。
1材料和方法
1.1黄芪成分筛选
以“黄芪”为关键词,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为活性成分筛选条件,检索中药系统药理学数据库和分析平台(TCMSP)[5]数据,获得黄芪的有效活性成分。
1.2活性成分-靶点网络构建
使用Uniprot数据库校正与转化功能,将查询到的黄芪活性成分转换成靶蛋白的规范名称。将活性成分-靶点关联信息导入到Cytoscape 3.7.0软件,处理黄芪的活性成分和靶点的相关信息,从而构建出黄芪活性成分-靶点网络图。
1.3EN相关靶点检索
以“endometrial carcinoma”为关键词,检索Genecards数据库[6]、在线人类孟德尔遗传数据库(OMIM数据库)[7]等疾病基因数据库,汇总疾病靶点并去除重复值,得到EN相关作用靶点。
1.4蛋白质互作(PPI)网络的构建及关键靶点筛选
选用Cytoscape 3.7.0软件中的Biogenet插件构建PPI网络。分别将黄芪有效活性成分的靶点与EN的相关靶点导入Biogenet中,生成两个独立的PPI网络,使用Cytoscape软件中Merge功能对这两个PPI网络取交集,使用CytoNCA插件分析PPI交集网络中各个节点的属性值。
1.5生物通路富集分析
应用Metascape在线分析平台[8]对靶点进行通路富集分析,解析黄芪中抗EN活性成分显著影响的生物通路,并探讨其发挥抗EN作用的可能机制。
2结果
2.1黄芪活性成分及靶点获取
从TCMSP数据库获取到87个黄芪成分,根据OB≥30%和DL≥0.18筛选得到17个成分。其具体信息见表1。
2.2黄芪活性成分-靶点网络构建与分析
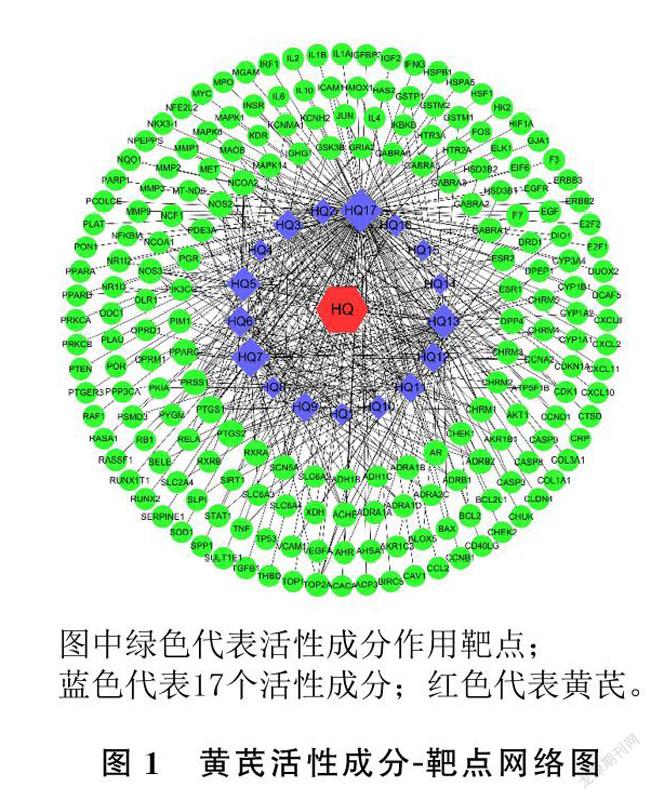
将TCMSP查询到的黄芪活性成分与相关靶点的关联数据导入Cytoscape 3.7.0软件,得到黄芪活性成分-靶点网络图(图1)。共获得216个节点(包含198个靶点、17个活性成分和1个代表黄芪的节点)与427条关系,图中节点面积大小代表相应的Degree值,面积越大代表Degree值越大,表示与此点连接的边越多,其重要性越高。
2.3EN疾病靶点
检索Genecards和OMIM数据库分别得到靶点个数为1 651个和196个。汇总靶点并去除重复靶点,最终收集到1 845个疾病靶点。
2.4黄芪治疗EN的PPI网络与关键靶点
2.4.1黄芪治疗EN的PPI网络运用Cytoscape 3.7.0构建黄芪PPI网络,结果显示,可以与黄芪产生直接或间接作用的靶点为6 304个,6 304个靶点之间可产生的相互关系多达153 949种。同样对EN的相关靶点绘制PPI网络,结果显示有13 172个靶点与EN可产生直接或者间接的关系,其间的相互关系高达243 806种。用Cytoscape 3.7.0中的Merge功能对二者取交集,交集网络见图2。
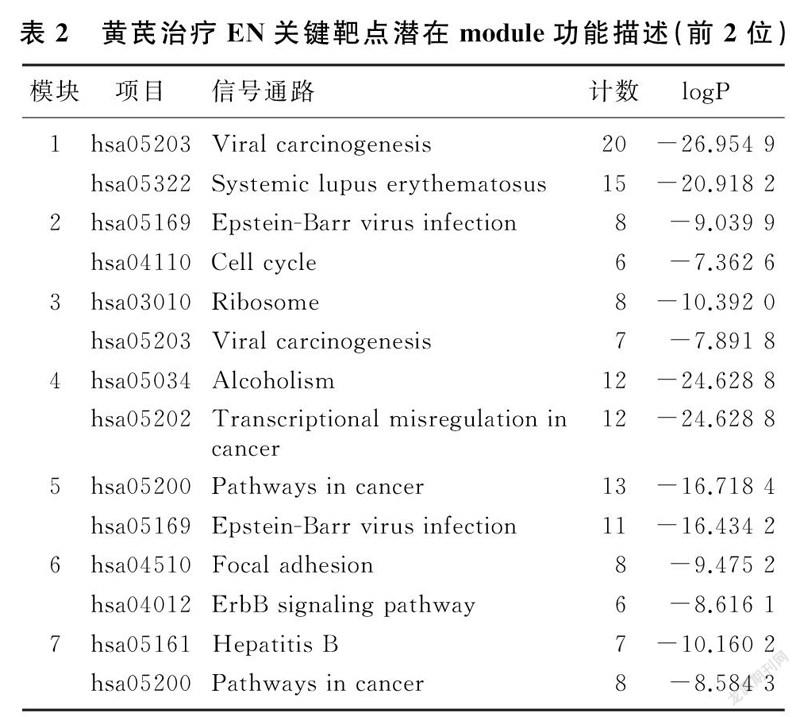
2.4.2黄芪治疗EN的关键靶点对黄芪治疗EN的PPI交集网络进行拓扑属性分析,筛选出在网络中发挥重要作用的靶点。黄芪治疗EN关键靶点见图3。经过2次筛选后,共获得关键靶点238个,关键靶点的筛选策略见图4。在得到核心PPI网络后,应用 MCODE插件对PPI模块进行分析,得到了MCODE1~7共7个模块,见图5。根据P值,分别保留每个模块中2个评分最佳的生物学进程以及描述功能,见表2。
2.5黄芪治疗EN的通路富集分析
应用Metascape平台对上述238个关键靶点进行了基因富集分析, 包括GO的Biological Process(BP)、Cellular Component (CC)、Molecular Function(MF)以及KEGG通路。分析结果显示,黄芪治疗EN主要涉及的生物学过程包括端粒结构(Telomere organization)、DNA修复(DNA repair)、DNA复制依赖性核小体装配(DNA replication-dependent nucleosome assembly)、DNA复制依赖性核小体结构(DNA replication-dependent nucleosome organization)、蛋白质-DNA复合物组装(Protein-DNA complex assembly)、rDNA染色质沉默(chro-matin silencing at rDNA)和基因沉默调控(regula-tion of gene silencing)等。这些过程直接作用于细胞损伤的修复和凋亡环节,表明黄芪对于EN细胞的修复和凋亡具有直接的调控作用。KEGG通路富集结果涉及病毒性癌症(Viral carcinogenesis)、EB病毒感染(Epstein-Barr virus infection)、细胞周期(Cell cycle)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、癌症转录失调(Transcriptional misregulation in cancer)、信号通路(Pathways in cancer)、MicroRNA(MicroRNAs in cancer)、HIF-1通路(HIF-1 signaling pathway)、Jak-STAT信号通路(Jak-STAT signaling pathway)、ErbB信號通路(ErbB signaling pathway)和蛋白聚糖(Proteoglycans in cancer)等。见图6。
3讨论
本研究应用网络药理学方法,初步探究了黄芪治疗EN的活性成分、作用靶点及相关联的生物学通路。根据OB≥30%和DL≥0.18,共筛选出黄芪活性成分17个,绘制上述活性成分-靶点网络关系图共获得198个靶点和427条相互关系。由此可知,黄芪的有效成分之间存在协同作用,而协同调控的靶点也在EN发生发展中发挥重要作用,具有用于治疗EN的潜力。
本文结果显示,黄芪治疗EN的主要成分可能为槲皮素、山奈酚、黄芪异黄烷苷等。其中,槲皮素可诱导肿瘤细胞过表达胱硫氨酸γ-裂解酶(CTH)从而诱导细胞凋亡[9];山奈酚可激活Caspase 9和诱导细胞凋亡[10],同时也可以上调p38、p53、p21、p-BRCA1和p-ATM等抑癌基因的表达,抑制肿瘤细胞增殖[11]。
3.1关键靶点结果分析
本文研究按照筛选策略共得到238个潜在关键靶点。根据Degree值排序,其中较为重要的靶点有NTRK1、TP53和CUL3等。有研究表明,NTRK1基因可编码原肌球蛋白受体激酶(TRK)家族中的TRKA蛋白,TRKA蛋白与神经营养素结合后,通过PI3K、Ras/MAPK/ERK和PLC-γ诱导受体二聚化、磷酸化和下游信号级联激活。由于基因融合或核苷酸突变所导致的TRK通路异常,是许多癌症发生发展的重要原因[12]。抑癌基因TP53可以转录诱导编码FAS基因以及其他可能编码相关死亡受体的基因,还可通过PUMA和NOXA介导细胞凋亡从而发挥显著的肿瘤抑制功能[13]。CUL3属于Cullin蛋白家族,可参与多种细胞过程,包括细胞分裂、分化、细胞骨架重塑、应激反应和神经细胞功能等,也与肿瘤的发生发展密切相关[14]。提示黄芪可通过多靶点来影响EN发生和发展过程。
3.2通路与生物进程分析
本文生物进程富集分析结果显示,黄芪治疗EN涉及的生物学进程包括端粒结构、DNA修复、DNA复制依赖性核小体装配、DNA复制依赖性核小体组织、蛋白质-DNA复合物组装、rDNA染色质沉默、细胞凋亡信号通路、基因沉默调控等。这些进程与细胞修复和凋亡直接相关。这表明黄芪可能通过干扰EN细胞的修复和促进其凋亡来发挥作用。
本文通路富集分析结果显示,黄芪可干预病毒致癌、细胞周期、PI3K-Akt通路、MicroRNA、HIF-1通路、Jak-STAT信号通路、蛋白聚糖、ErbB通路等,调控EN病理过程中的不同环节。
综上所述,黄芪治疗EN的主要成分可能是槲皮素、山奈酚和黄芪异黄烷苷等,关键作用靶点有NTRK1、TP53、CUL3等和涉及细胞周期、DNA修复、细胞凋亡、癌症通路等多个生物学过程和信号通路。黄芪通过多成分-多靶点-多通路的方式来干预EN的发生和发展,体现了中药治疗疾病的整体性与系统性。
[参考文献]
[1]XUE J, LI L, LI N, et al. Metformin suppresses cancer cell growth in endometrial carcinoma by inhibiting PD-L1[J]. European Journal of Pharmacology, 2019,859:172541.
[2]佘远萍,黄玉梅. 子宫内膜癌治疗的研究进展[J]. 中外医学研究, 2020,18(16):172-174.
[3]王金环,杨思琦,孙伟正,等. 中西医干预恶性肿瘤化疗后骨髓抑制研究进展[J]. 河北中医, 2019,41(11):1755-1760.
[4]王佳薇,殷一红,刘红丹,等. 黄芪注射液辅助治疗子宫内膜癌效果及其机制初探[J]. 中华中医药学刊, 2020,38(1):1-11.
[5]RU J, LI P, WANG J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014,6:13.
[6]SAFRAN M, DALAH I, ALEXANDER J, et al. GeneCards Version 3: the human gene integrator[J]. Database, 2010,2010: baq020.
[7]AMBERGER J S, BOCCHINI C A, SCHIETTECATTE F, et al. OMIM.org: Online Mendelian Inheritance in Man (OMIM), an online catalog of human genes and genetic di-sorders[J]. Nucleic Acids Research, 2015,43(Database issue):D789-D798.
[8]ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nature Communications, 2019,10(1):1523.
[9]BRISDELLI F, DI FRANCESCO L, GIORGI A, et al. Proteomic analysis of quercetin-treated K562 cells[J]. Internatio-nal Journal of Molecular Sciences, 2019,21(1):E32.
[10]ZHU L, XUE L J. Kaempferol suppresses proliferation and induces cell cycle arrest, apoptosis, and DNA damage in breast cancer cells[J]. Oncology Research, 2019,27(6):629-634.
[11]IMRAN M, SALEHI B, SHARIFI-RAD J, et al. Kaempfe-rol: a key emphasis to its anticancer potential[J]. Molecules, 2019,24(12): 2277.
[12]KHOTSKAYA Y B, HOLLA V R, FARAGO A F, et al. Targeting TRK family proteins in cancer[J]. Pharmacology & Therapeutics, 2017,173:58-66.
[13]AUBREY B J, KELLY G L, JANIC A, et al. How does p53 induce apoptosis and how does this relate to p53-mediated tumour suppression[J]? Cell Death and Differentiation, 2018,25(1):104-113.
[14]CHEN R H. Cullin 3 and its role in tumorigenesis[J]. Advances in Experimental Medicine and Biology, 2020,1217:187-210.
(本文編辑黄建乡)
