丹参多酚酸盐对心肌细胞氧化损伤模型大鼠的作用
2022-05-06高洪瑞闫慧潘洋郝岩李健
高洪瑞 闫慧 潘洋 郝岩 李健

[摘要]目的探讨丹参多酚酸盐对黄曲霉素B1(AFB1)诱导下大鼠心肌细胞(H9C2细胞)氧化应激损伤的影响。方法用不同浓度的AFB1处理H9C2细胞,通过CCK-8法检测细胞活力以确定最佳氧化损伤模型AFB1浓度(128 μmol/L)。实验分为正常对照组(用DMEM培养液培养H9C2细胞)、AFB1诱导模型组(在正常对照组基础上加入128 μmol/L AFB1)和低、中、高浓度丹参多酚酸盐干预组(128 μmol/L AFB1+丹参多酚酸盐浓度分别为5、20、40 mg/L)。采用CCK-8法测定各组细胞的存活率,倒置相差显微镜观察细胞形态学变化,DCFH-DA染色检测细胞内活性氧(ROS)水平,Western blot方法检测氧化应激相关蛋白过氧化物歧化酶2(SOD2)和过氧化氢酶(CAT)蛋白的表达。结果与正常对照组比较,AFB1诱导模型组的细胞形态发生明显改变,细胞相对存活率降低,细胞内ROS升高,细胞内SOD2、CAT蛋白表达降低;与AFB1诱导模型组相比较,高浓度丹参多酚酸盐干预组的细胞形态有所改善,细胞相对存活率增加,细胞内ROS明显降低,SOD2、CAT蛋白表达有所上调,差异均有统计学意义(F=8.023~226.937,P<0.05)。结论丹参多酚酸盐可通过改善抗氧化酶活力、减少ROS的产生、减少氧化应激损伤,改善AFB1诱导的H9C2心肌细胞损伤。
[关键词]丹参多酚酸盐;黄曲霉素B1;肌细胞,心脏;氧化性应激;活性氧
[中图分类号]R542.2;R282.71[文献标志码]A[文章编号]2096-5532(2022)02-0189-04
doi:10.11712/jms.2096-5532.2022.58.040[開放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220311.1334.009.html;2022-03-1413:57:22
EFFECT OF SALVIANOLATE ON MODEL RATS WITH OXIDATIVE DAMAGE OF CARDIOMYOCYTES GAO Hongrui, YAN Hui, PAN Yang, HAO Yan, LI Jian(Medical Colleage of Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo study the effect of salvianolate on oxidative damage of rat cardiomyocytes (H9C2) induced by aflatoxin B1 (AFB1). MethodsH9C2 cells were treated with different concentrations of AFB1, and the optimal concentration of AFB1 (128 μmol/L) for the oxidative damage model was determined by CCK-8 assay. H9C2 cells were divided into normal group (cultured in DMEM medium), AFB1-induced model group (cultured in DMEM medium with 128 μmol/L AFB1), and intervention groups with low, medium, and high concentrations of salvianolate (128 μmol/L AFB1 + 5, 20, and 40 mg/L salvianolate). Cell survival rate was determined by CCK-8 assay. Morphological changes of cells were observed under an inverted phase contrast microscope. Intracellular reactive oxygen species (ROS) was detected by DCFH-DA staining. Western blot was used to measure the expression levels of stress-related superoxide dismutase 2 (SOD2) and catalase (CAT). ResultsCompared with the normal group, the AFB1-induced model group showed significantly changed cell morphology, reduced cell survival rate, increased ROS production, and decreased protein expression of SOD2 and CAT. Compared with the AFB1-induced model group, the high-concentration salvianolate intervention group showed improved cell morphology, increased cell survival rate, significantly decreased ROS production, and up-regulated SOD2 and CAT (F=8.023-226.937,P<0.05). ConclusionSalvianolate can ameliorate AFB1-induced H9C2 damage by increasing the activity of antioxidant enzymes and reducing ROS production and related oxidative stress.
[KEY WORDS]salvianolate; aflatoxin B1; myocytes, cardiac; oxidative stress; reactive oxygen species
黄曲霉毒素主要是由黄曲霉和寄生曲霉代谢产生的一类毒素,其中黄曲霉素B1(AFB1)毒性最大、危害最严重[1],可对机体造成严重损害,包括致癌、致突变和肝脏损伤等[2]。AFB1的主要靶器官是肝脏[3],但一些研究表明,AFB1也会导致严重的心脏损伤,其机制涉及线粒体损伤、活性氧(ROS)生成和细胞凋亡等[4-5]。丹参是一种传统的中药,具有活血化瘀之功效[6],丹参多酚酸盐是丹参的水溶性有效活性部分,有很强的抗氧化、抗凋亡、内皮保护和舒张血管等作用[7],临床上主要应用于冠心病的治疗[8]。有研究表明,急性心肌梗死病人经皮冠状动脉介入治疗围术期静脉输注丹参多酚酸盐可有效改善氧化应激反应,促进心功能恢复,增加心肌灌注量[9]。但丹参多酚酸盐对AFB1诱导心肌细胞氧化损伤的影响鲜有报道。本文研究通过AFB1诱导大鼠心肌细胞(H9C2细胞)制备氧化损伤模型,评估丹参多酚酸盐对H9C2细胞氧化应激损伤的保护作用,为丹参多酚酸盐的临床应用提供依据。
1材料和方法
1.1细胞及试剂
H9C2细胞株购自武汉普诺赛生命科技有限公司;AFB1(百灵威科技有限公司,纯度98%);丹参多酚酸盐(上海绿谷制药有限公司,每瓶100 mg);DMEM高糖培养液(美国HyClone公司);胎牛血清(FBS,BI);二甲基亚砜(DMSO)、5XTris-甘氨酸电泳缓冲液、10×电转液均购自北京索莱宝公司;CCK-8细胞活力检测试剂盒、ROS检测试剂盒、10×TBST均购自大连美仑生物技术有限公司;过氧化物歧化酶2(SOD2)抗体、过氧化氢酶(CAT)抗体(Anti-Catalase)均购自abcam公司;GAPDH(博奥森生物技术有限公司);Anti-Rabbit IgG(H+L,Elabscience生物技术有限公司)。
1.2实验方法
1.2.1H9C2细胞培养H9C2细胞置于含体积分数0.10的FBS和体积分数0.01青链霉素双抗的高糖DMEM培养液中培养,于含体积分数0.05 CO2、37 ℃培养箱中培养,待细胞生长至80%~90%融合时,用2.5 g/L胰蛋白酶消化后收集细胞,以1∶3比例传代培养。实验分为正常对照组(用DMEM培养液培养H9C2细胞)、AFB1诱导模型组(在DMEM培养液中加入浓度128 μmol/L的AFB1)及低、中、高浓度丹参多酚酸盐干预组(在培养液中加入浓度128 μmol/L的AFB1+浓度分别为5、20、40 mg/L丹参多酚酸盐)。
1.2.2CCK-8法检测细胞相对存活率取对数生长期的H9C2细胞,消化、重悬、计数后,将细胞密度调整为5×10/L,接种于96孔板,每孔100 μL,置于恒温培养箱孵育过夜(15~18 h),分组加药。①设置正常对照组(H9C2细胞加入DMEM培养液)、DMSO组(DMEM培养液中加浓度2 g/L的DMSO)和AFB1组(AFB1终浓度分别为32、64、96、128、160、192 μmol/L), 以细胞存活率接近50%为最佳的药物造模浓度;②设置正常对照组(用DMEM培养液培养H9C2细胞)、不同浓度的丹参多酚酸盐组(丹参多酚酸盐浓度分别为5、10、20、40、50、60 mg/L),确定丹参多酚酸盐的安全使用浓度;③设置正常对照组(用DMEM培养液培养H9C2细胞)和最佳浓度(128 μmol/L)AFB1+丹参多酚酸盐组(丹参多酚酸盐浓度分别为0、5、20、40 mg/L)。每组设置6个复孔。培养36 h后,吸除原培养液,然后每孔加入100 μL(含有CCK-8试剂10 μL)的无血清培养液,培养箱孵育1.5 h后,酶标仪检测450 nm波长处吸光度值,计算细胞相对存活率。细胞相对存活率(%)=(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%。
1.2.3细胞形态学观察取对数生长期的H9C2细胞,消化、重悬、计数后,将细胞密度调整为1.5×108/L,接种于6孔板,每孔2 mL。培养24 h后待细胞长到70%~80%融合,吸去细胞上清液,按照“1.2.1”方法分组及处理36 h后,倒置相差显微镜下观察各组细胞形态学变化。
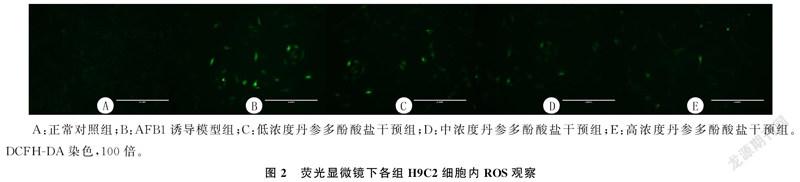
1.2.4DCFH-DA染色检测细胞内ROS水平取对数期生长的H9C2细胞制成细胞悬液,接种至96孔板,每孔5×10个细胞。孵育24 h后,吸除原培养液,按照 “1.2.1”方法分组并处理,每组设置6个复孔。药物作用36 h后,吸除原培养液,每孔加入100 μL含有DCFH-DA(10 μmol/L)探针的无血清培养液,37 ℃细胞培养箱内避光孵育30 min。用无血清培养液洗涤细胞3次后,倒置荧光显微镜下观察绿色荧光强度(激发波长为502 nm,发射波长为530 nm),并应用Image J软件分析各组荧光强度。
1.2.5Western blot方法检测抗氧化应激相关蛋白表达水平各组细胞干预36 h后,采用RIPA细胞裂解液提取细胞蛋白,BCA法测定蛋白浓度。取30 μg蛋白上样,分别应用体积分数0.10和0.15的SDS-PAGE对蛋白进行分离,之后电转至PVDF膜上。应用50 g/L脱脂牛奶室温封闭2 h,分别加入1∶2 000的GAPDH、SOD2和CAT一抗,4 ℃孵育过夜,加入相应二抗(抗兔抗体,1∶5 000)37 ℃摇床上孵育1.5 h,通过化学发光成像系统显影,并用Image J软件对条带灰度值进行分析。目标蛋白的相对表达以目标蛋白条带的灰度值/GAPDH条带的灰度值表示。
1.3統计学分析
应用SPSS 22软件进行统计分析。计量资料数据以x±s表示,多组数据比较采用单因素方差分析,两两比较采用LSD法。以P<0.05 为差异有统计学意义。
2结果
2.1最佳药物造模浓度及丹参多酚酸盐安全浓度
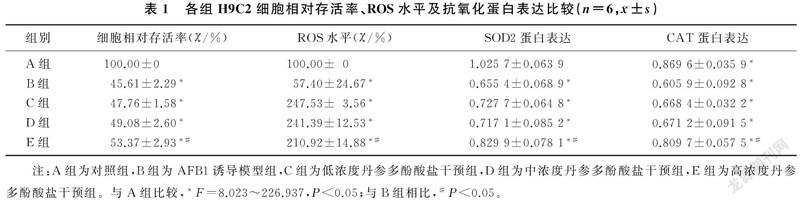
随着AFB1浓度的升高,细胞相对存活率呈剂量依赖性下降,差异具有统计学意义(F=293.056,P<0.05);当AFB1的浓度达到128 μmol/L时,H9C2细胞相对存活率为56.83%,符合造模条件。故选择AFB1浓度128 μmol/L作为造模浓度。与空白对照组相比,0~50 mg/L浓度丹参多酚酸盐作用于H9C2细胞,细胞相对存活率无明显变化(P>0.05);60 mg/L浓度丹参多酚酸盐作用于H9C2细胞,细胞相对存活率下降(F=2.387,P<0.05)。0~50 mg/L浓度的丹参多酚酸盐为安全使用浓度。
2.2各组 H9C2细胞形态比较
空白对照组H9C2细胞生长状态良好,细胞呈梭形,紧密连接,边界清晰可见,贴壁牢固;AFB1诱导模型组H9C2细胞生长密度较低,细胞间空隙增加,可见大片细胞脱落,部分细胞收缩变圆、形状不规则,可见细胞碎片;不同剂量丹参多酚酸盐干预组H9C2细胞生长形态及状态得到一定改善。见图1。
2.3丹参多酚酸盐对H9C2细胞损伤的影响
与空白对照组比较,AFB1诱导模型组细胞相对存活率降低;与AFB1诱导模型组相比较,高浓度的丹参多酚酸盐干预组细胞相对存活率升高,差异有显著性(F=226.937,P<0.05)。见表1。
2.4丹参多酚酸盐对心肌细胞ROS水平影响
荧光显微镜下各组H9C2细胞内ROS观察结果见图2。与正常对照组相比,AFB1诱导模型组细胞内ROS水平升高;与AFB1诱导模型组相比,高浓度丹参多酚酸盐干预组ROS水平显著降低,差异有显著性(F=62.751,P<0.05)。见表1。
2.5各组抗氧化蛋白SOD2和CAT表达比较
与正常对照组比较,AFB1诱导模型组心肌细胞SOD2、CAT蛋白表达降低;与AFB1诱导模型组相比,高浓度丹参多酚酸盐干预组SOD2、CAT蛋白表达增加,差异有显著意义(F=12.090、8.023,P<0.05)。见表1。
3讨论
AFB1是毒性最强、最常见的黄曲霉毒素,被归类为第一类致癌物。既往研究表明,AFB1诱导毒性的原因之一是氧化应激,氧化应激导致抗氧化酶活力降低及ROS过量生成,从而诱导心肌细胞的损伤[10]。也有研究表明,AFB1诱导心肌细胞线粒体损伤从而促进心肌细胞凋亡[4-5]。丹参多酚酸盐具有较强的抗氧化活性,体内外研究结果显示,其可通过降低ROS水平,稳定细胞线粒体膜电位,改善与恢复细胞功能活性[11]。有研究表明,丹参多酚酸盐可抑制HO处理的大鼠心肌细胞ROS的过量生成[11],可通过抑制氧化损伤来防治HO所致的大鼠心肌细胞重构[12]。本研究以128 μmol/L浓度的AFB1作用大鼠H9C2细胞制备心肌细胞损伤模型,结果显示,与正常对照组相比,AFB1诱导模型组心肌细胞形态发生明显改变,细胞相对存活率显著降低,提示AFB1对心肌细胞有明显的毒性作用;与AFB1诱导模型组相比,应用高浓度丹参多酚酸盐(40 mg/L)干预H9C2细胞36 h,细胞形态及数量有所改善,细胞相对存活率增加,说明高浓度的丹参多酚酸盐对心肌细胞有保护作用。
ROS是一种氧化能力较强的自由基,包括超氧离子(O)、羟基自由基(-OH)、过氧化氢(HO)和单线态氧(O)等。正常情况下,细胞内的各种抗氧化剂和抗氧化酶如谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GPX)、SOD、CAT等可使体内ROS的生成和消除处于平衡状态;在病理条件下,ROS产生过多会打破氧化系统/抗氧化系统的平衡,进而导致机体处于氧化应激状态。其中SOD是人体内天然的抗氧化酶,可催化超氧化物自由基生成氧或HO,然后通过GPX和CAT催化反应将HO分解为水和氧,有效清除多余ROS,维持体内自由基的动态平衡,其活性高低间接反映机体清除氧自由基的能力。本文实验结果显示,与正常对照组相比,AFB1诱导模型组ROS升高,SOD2、CAT蛋白表達降低,提示AFB1处理心肌细胞后,破坏了氧化/抗氧化的平衡机制,导致细胞内自由基的异常累积;与AFB1诱导模型组比较,高浓度的丹参多酚酸盐干预组心肌细胞ROS降低,SOD2、CAT蛋白表达增加,表明丹参多酚酸盐可能通过减少过量的ROS产生、改善抗氧化酶活力、降低氧化应激损伤来抑制AFB1诱导的心肌细胞损伤。
综上所述,丹参多酚酸盐对AFB1损伤的心肌细胞有一定的保护作用,其作用机制可能与改善SOD2、CAT等抗氧化酶活力,进而促进过量ROS的清除,减轻氧化应激损伤有关。本研究可为临床防治心脏损伤相关疾病提供新思路。
[参考文献]
[1]黄丰,肖德强,高伟,等. 表没食子儿茶素没食子酸酯对黄曲霉毒素B1致肝细胞氧化损伤的保护作用[J]. 广西医科大学学报, 2019,36(5):696-700.
[2]师文文,吕攀,徐庆强,等. 油酸在黄曲霉毒素诱导肝细胞损伤中的保护作用[J]. 中国油料作物学报, 2019,41(2):267-274.
[3]LI Y, MA Q G, ZHAO L H, et al. Protective efficacy of alpha-lipoic acid against Aflatoxin B1-induced oxidative damage in the liver[J]. Asian-Australasian Journal of Animal Sciences, 2014,27(6): 907-915.
[4]WANG W J, XU Z L, YU C, et al. Effects of aflatoxin B1 on mitochondrial respiration, ROS generation and apoptosis in broiler cardiomyocytes[J]. Nihon Chikusan Gakkaiho, 2017,88(10):1561-1568.
[5]GE J H, YU H C, LI J, et al. Assessment of aflatoxin B1 myocardial toxicity in rats: mitochondrial damage and cellular apoptosis in cardiomyocytes induced by aflatoxin B1[J]. The Journal of International Medical Research, 2017,45(3):1015-1023.
[6]周斌,趙芳,陈明,等.丹参多酚酸盐对高糖诱导的大鼠心肌细胞凋亡的抑制作用[J]. 广东医学, 2013,34(20):3105-3108.
[7]REN J, FU L, NILE S H, et al. Salvia miltiorrhiza in treating cardiovascular diseases: a review on its pharmacological and clinical applications[J]. Frontiers in Pharmacology, 2019,10:753.
[8]QI J Y, YU J, HUANG D H, et al. Salvianolate reduces murine myocardial ischemia and reperfusion injury via ERK1/2 signaling pathways in vivo[J]. Chinese Journal of Integrative Medicine, 2017,23(1):40-47.
[9]ZHANG Q, JIAO F J, HUA C J. Perioperative application of salvianolate on oxidative stress and plasma IMD/ADM2 in patients with acute myocardial infarction undergoing PCI[J]. Experimental and Therapeutic Medicine, 2017,13(4):1475-1479.
[10]MANNAA F A, ABDEL-WAHHAB K G, ABDEL-WAHHAB M A. Prevention of cardiotoxicity of aflatoxin B1 via die-tary supplementation of Papaya fruit extracts in rats[J]. Cytotechnology, 2014,66(2): 327-334.
[11]吕林林,安姿旖,梁家健,等. 丹参多酚酸盐对过氧化氢诱导人内皮细胞EA.hy926氧化应激损伤的保护作用及机制[J]. 中国病理生理杂志, 2019,35(5):865-872.
[12]费爱华,陈淼,潘曙明. 丹参多酚酸盐对心肌细胞TGF-β信号通路的影响[J]. 现代中西医结合杂志, 2014,23(19):2053-2055,2058.
(本文编辑黄建乡)
