非布司他对痛风病人三酰甘油水平的影响
2022-05-06吴欣孙文艳季爱昌薛晓梅李长贵
吴欣 孙文艳 季爱昌 薛晓梅 李长贵
[摘要]目的观察非布司他对原发性痛风病人三酰甘油(TG)水平的影响。方法选取2016年9月—2020年9月在青岛大学附属医院痛风专病门诊就诊的病人298例,分析非布司他治疗期间TG水平变化。结果治疗2~4周、6~8周时的TG水平均较治疗前明显升高(t=4.294、7.760,P<0.01),治疗10~12周时的TG水平与治疗前比较变化不明显。根据治疗前TG水平分组,TG<1.7 mmol/L组治疗2~4周、6~8周时的TG水平均较治疗前明显升高(Z=4.099、6.814,P<0.01),治疗10~12周时的TG水平与治疗前比较变化不明显;1.7 mmol/L≤TG<2.3 mmol/L组治疗2~4周时的TG水平较治疗前明显升高(Z=3.794,P<0.01),治疗6~8周、10~12周时的TG水平与治疗前比较变化不明显。结论非布司他治疗早期会引起痛风病人TG水平升高。
[关键词]痛风;非布索坦;甘油三酯类
[中图分类号]R589.7[文献标志码]A[文章编号]2096-5532(2022)02-0178-05
doi:10.11712/jms.2096-5532.2022.58.067[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220320.1550.006.html;2022-03-2210:13:19
EFFECT OF FEBUXOSTAT ON TRIGLYCERIDE LEVEL IN PATIENTS WITH GOUT WU Xin, SUN Wenyan, JI Aichang, XUE Xiaomei, LI Changgui (Department of Endocrinology and Metabolic, The Affiliated Hospital of Qingdao University, Qingdao 26003, China)
[ABSTRACT]ObjectiveTo investigate the effect of febuxostat on triglyceride (TG) level in patients with primary gout. MethodsA total of 298 patients with gout who attended the outpatient service of gout in The Affiliated Hospital of Qingdao University from September 2016 to September 2020 were enrolled, and the change in TG level was observed during febuxostat treatment.ResultsThere was a significant increase in TG level at weeks 2-4 and 6-8 of treatment (t=4.294,7.760;P<0.01), and TG level at weeks 10-12 of treatment was similar to that before treatment. The patients were divided into TG <1.7 mmol/L group and 1.7 mmol/L ≤TG <2.3 mmol/L group according to TG level before treatment. The TG <1.7 mmol/L group had a significant increase in TG level at weeks 2-4 and 6-8 of treatment (Z=4.099,6.814;P<0.01), while TG level at weeks 10-12 of treatment was similar to that before treatment; the 1.7 mmol/L ≤TG <2.3 mmol/L group had a significant increase in TG level at weeks 2-4 of treatment (Z=3.794,P<0.01), while TG level at weeks 6-8 and 10-12 of treatment was similar to that before treatment. ConclusionThere is an increase in TG level in patients with gout in the early stage of febuxostat treatment.
[KEY WORDS]gout; febuxostat; triglycerides
近年來,高尿酸血症与痛风已成为继糖尿病之后我国又一常见的代谢性疾病,患病率高达13.3%和1.1%,患病人数超过1.2亿和1 700万[1]。高尿酸血症与痛风病人中近60%合并高三酰甘油血症(HTG)[2-3]。HTG不但可以促进动脉粥样硬化的发生、发展,诱发急性胰腺炎,而且也是痛风发生的危险因素,可以降低痛风病人尿酸达标率[4-7]。因此,关注三酰甘油(TG)影响因素,将TG长期控制在正常范围内是痛风长期良好控制的基础。《中国高尿酸血症与痛风诊疗指南(2019)》推荐,非布司他为中国痛风病人降尿酸治疗的一线用药[8],但非布司他对TG水平的影响报道不一[9-11]。故本研究选取298例痛风病人,观察非布司他治疗期间TG水平的动态变化,以明确非布司他治疗对TG水平的影响。现将结果报告如下。
1对象和方法
1.1研究对象选择
本研究为回顾性队列分析,收集2016年9月—2020年9月就诊于青岛大学附属医院痛风专病门诊且符合纳入要求的298例原发性痛风病人的资料。纳入标准:①已确诊为痛风且未服用降尿酸药物或降尿酸药物至少停服2周的病人;②单用非布司他降尿酸的病人;③降尿酸治疗2~4周、6~8周、
10~12周,各复诊1次及以上的病人。排除标准:①降尿酸药物治疗前,TG≥2.3 mmol/L的病人;②合并糖尿病、甲状腺功能亢进、肾衰竭、恶性肿瘤等影响TG水平疾病者;③治疗前或在治疗过程中使用影响TG水平药物者,如贝特类及他汀类降脂药、降糖药物、噻嗪类及ACEI/ARB类降压药、阿司匹林、糖皮质激素等。本研究获青岛大学附属医院伦理委员会批准(QYFYWZLL26265)。
1.2研究方法
收集所有研究对象的年龄、体质量指数(BMI)、痛风石情况、既往病史、家族痛风病史以及肝肾功能、血糖、血脂、尿酸等生化指标。将所有病人降尿酸治疗2~4周、6~8周、10~12周的血清TG水平与治疗前比较,明确病人TG水平的变化情况。为了消除治疗前TG水平对降尿酸药物治疗后TG水平动态变化的影响,根据2017年中国胆固醇教育计划委员会制订的《高甘油三酯血症及其心血管风险管理专家共识》[12],按照治疗前TG水平将病人分为TG<1.7 mmol/L组(A组)以及1.7 mmol/L≤TG<2.3 mmol/L组(B组),分别将两组病人降尿酸治疗2~4周、6~8周、10~12周时的TG水平与治疗前比较。将所有病人降尿酸治疗14~16 d时的肝肾功能、血糖、血脂、尿酸等生化指标与治疗前比较,明确降尿酸治疗后病人是否还伴有除TG外其他生化指标的变化。
1.3统计学方法
采用SPSS 24.0软件进行数据的统计分析。符合正态分布的计量数据以x±s表示,两组间比较采用独立样本t检验,组内不同时间的比较采用配对样本t检验。不符合正态分布的计量数据以中位数(四分位数间距)表示,两组间比较采用Kruskal-Walis H非参数检验,组内不同时间的比较采用配对样本的Wilcoxon符号秩和检验。计数资料以例数和百分数表示,两组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2结果
2.1基线资料比较
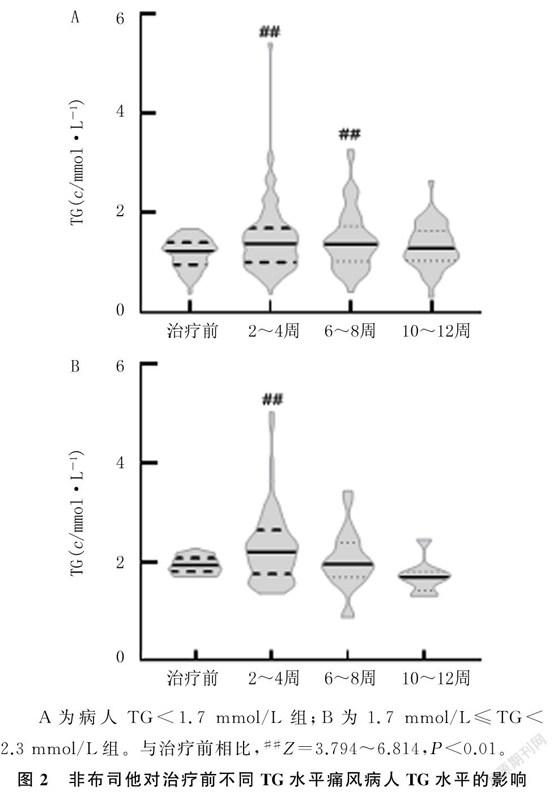
入选的298例痛风病人,TG<1.7 mmol/L组225例,1.7 mmol/L≤TG<2.3 mmol/L组73例。两组间比较,年龄、肌酐(CREA)、血清尿酸(sUA)、肾小球滤过率(eGFR)、痛风家族史、痛风石、冠心病(CHD)差异无显著意义(P>0.05);1.7 mmol/L≤TG<2.3 mmol/L组的BMI、谷丙转氨酶(ALT)、谷草转氨酶(AST)、TG、胆固醇(CH)、血糖及脂肪肝、HTG发生率明显高于TG<1.7 mmol/L组(t=2.135、3.542,Z=2.796~12.838,χ2=6.625、8.813,P<0.05)。见表1。
2.2非布司他治疗12周内TG水平的动态变化
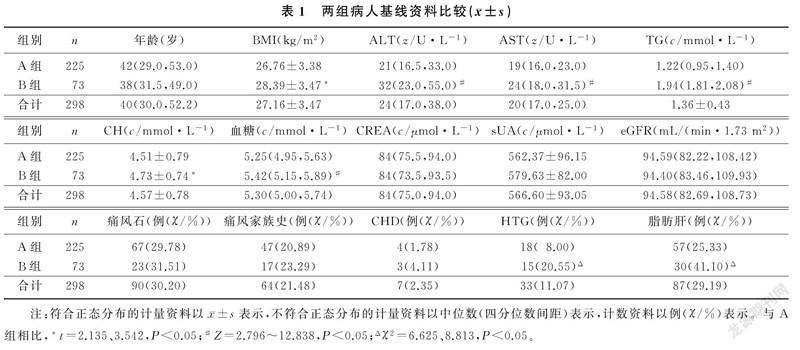
痛风病人治疗2~4周、6~8周时的TG水平分别为(1.68±0.78)、(1.57±0.64)mmol/L,均显著高于治疗前的(1.36±0.43)mmol/L(t=4.294、7.760,P<0.01);治疗10~12周时的TG水平为(1.39±0.45)mmol/L,与治疗前比较差异无显著性(P>0.05)。见图1。
2.3不同TG水平组病人非布司他治疗12周内TG水平的动态变化
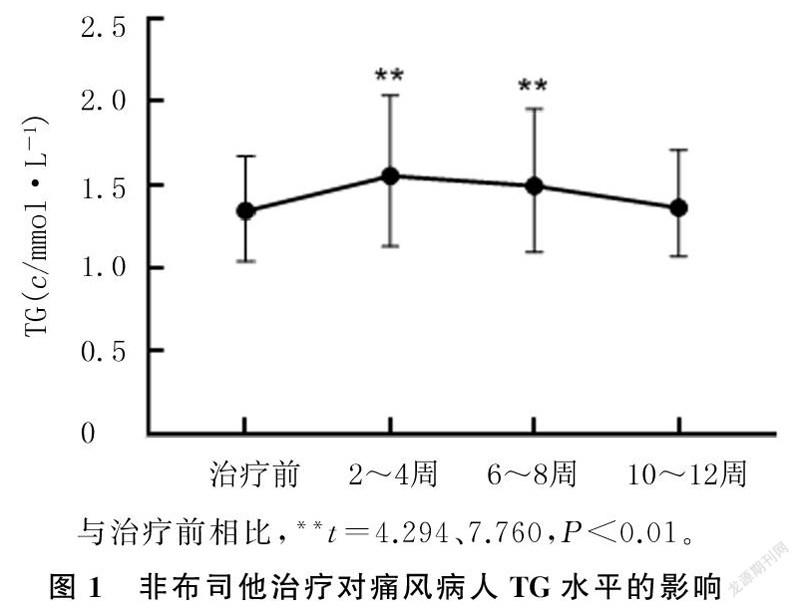
对TG<1.7 mmol/L组225例病人进行统计分析,结果显示,治疗2~4周、6~8周时的TG水平分别为1.37(1.00,1.69)、1.37(1.02,1.73) mmol/L,均显著高于治疗前的1.22(0.95,1.40)mmol/L(Z=4.099、6.814,P<0.01);治疗10~12周时的TG水平为1.28(1.02,1.63)mmol/L,与治疗前比较差异无统计学意义(P>0.05)。对1.7 mmol/L≤TG<2.3 mmol/L组73例痛风病人进行统计分析,结果显示,病人治疗2~4周时的TG水平为2.19(1.76,2.64)mmol/L,要明显高于治疗前的1.94(1.81,2.08)mmol/L(Z=3.794,P<0.01);治疗6~8周、10~12周时的TG水平则分别为1.96(1.69,2.38)、1.70(1.42,1.80)mmol/L,与治疗前比较差异无显著性(P>0.05)。见图2。
2.4第14~16天复诊病人肝肾功能、血糖、血脂及尿酸的变化
第14~16天复诊病人共151例。与治疗前比较,非布司他治疗14~16 d时,病人的sUA水平显著降低(Z=10.587,P<0.01),TG水平顯著升高(Z=4.988,P<0.01),ALT、AST水平也显著升高(Z=5.004、5.856,P<0.01),CH、CREA、eGFR显著改善(t=2.430,Z=3.330、3.932,P<0.05),而血糖变化不明显(P>0.05)。见表2。
3讨论
痛风是关节损伤和慢性肾脏疾病的常见病因,也是心脑血管疾病的独立危险因素[13]。有研究证实,痛风病人TG水平显著高于非痛风病人,并且痛风病人较单纯高尿酸血症病人更易伴发HTG,高尿酸血症与痛风病人中近60%合并HTG[2-3,14-15]。此外,TG水平升高也会明显增加sUA的水平,抑制肾脏尿酸排泄,增加痛风发病风险[16]。有研究表明,尿酸与TG水平呈正相关[17]。非布司他能显著降低痛风病人sUA水平,但对于使用非布司他降尿酸治疗早期TG水平的变化仍未明确[9-11,18]。故本研究对此进行了探讨。
本研究结果显示,在痛风病人中,非布司他治疗2~4周、6~8周时的TG水平均较治疗前明显升高,而治疗10~12周时的TG水平则变化不明显。与本研究结果不同,ZIGA-SMAJIC等[11]对25例使用非布司他治疗3~6个月病人进行的回顾性分析结果显示,与治疗前相比,降尿酸治疗3个月时,TG水平明显降低,但持续治疗6个月后差异无显著性。
分析研究结果不一致的原因可能是,ZIGA-SMAJIC等[11]的研究观测时间窗为非布司他治疗3个月和6个月,而本研究观测时间窗为非布司他治疗2~4周、6~8周和10~12周。提示需要进行更长时间的前瞻性或回顾性研究,以明确长时间服用非布司他对TG水平的影响。本课题组近期完成的一项前瞻性随机对照研究亚组分析结果显示,在痛风人群中,非布司他治疗第4、8周时的TG水平明显高于治疗前[10]。本文结果与之一致。这提示临床医生应关注非布司他治疗早期病人TG水平的变化。
WU等[9]的回顾性研究结果显示,接受3~5周和8~10周非布司他治疗的54例痛风合并HTG病人出现TG水平下降。为消除治疗前TG水平不同对降尿酸过程中TG水平变化的影响,本研究参照《高甘油三酯血症及其心血管风险管理专家共识》[12],按照治疗前的TG水平将病人分为TG<1.7 mmol/L组(TG水平正常)和1.7 mmol/L≤TG<2.3 mmol/L组(TG水平边缘升高)。结果显示,TG<1.7 mmol/L组病人治疗2~4周、4~6周、10~12周时的TG水平较治疗前明显升高;而1.7 mmol/L≤TG<2.3 mmol/L组病人只在治疗2~4周时TG水平明显升高,治疗6~8周、10~12周时与治疗前比较差异无显著性。这与WU等[9]的研究结果不完全一致。分析研究结果不一致的原因可能为,WU等[9]研究选用的人群在治疗前TG水平为(2.99±1.38)mmol/L,且不排除正在服用降脂药物者,观察期间也允许继续服用降脂药物;而本研究为消除治疗前TG水平不同以及降脂药物对降尿酸过程中TG水平变化的影响,对病人进行分组分析,且排除服用影响血脂药物者。由于在此前的复诊中,许多病人因TG水平升高,开始服用非诺贝特或其他影响血脂的药物,而在非布司他治疗10~12周时被排除,导致观察病人数过少,故需要进一步的大样本多中心研究来明确痛风病人长期服用非布司他对TG水平的影响。
本研究结果还显示,在非布司他治疗14~16 d时,sUA明显降低,这与既往研究非布司他能有效降低尿酸的结果一致[18]。同时,eGFR、CREA也得到明显改善,与既往研究非布司他能改善肾功能的结果也相一致[19]。此外,非布司他治疗还可以导致AST和ALT水平的升高,这也与既往研究结果相一致[20]。非布司他治疗总体上具有良好的耐受性,最常见不良反应为轻度、短暂的肝功能异常,肝毒性并不常见[20]。多项研究表明,非布司他能抑制非乙醇性脂肪性肝病(NAFLD)的发展[21-22]。高尿酸血症能显著增加NAFLD的发病风险,黄嘌呤氧化酶(XO)活性升高是引发高尿酸血症促进NAFLD发生、发展的关键分子机制,抑制该酶活性能有效逆转高脂饮食诱导的小鼠肝脏脂变性[23]。非布司他是一种非嘌呤类XO选择性抑制剂,主要在肝脏代谢。NISHIKAWA等[22]研究表明,非布司他可通过降低XO活性和肝脏尿酸水平,改善与高尿酸血症相关的NAFLD/脂肪性肝炎(NASH),但血液中的TG和游离脂肪酸(FFA)水平并未明显降低。有研究结果表明,使用肝定向乙酰辅酶A羧化酶抑制剂可明显改善NAFLD,但却引起HTG的出现,可能与极低密度脂蛋白(VLDL)分泌增加有关[24]。肝细胞是人体内TG合成的主要部位,VLDL是TG运输的主要载体,也主要在肝细胞内合成,肝细胞内合成的TG通过VLDL运出肝细胞进入周围血液循环,这是TG的重要来源[25]。众多的研究结果表明,VLDL水平的增加与NAFLD的改善有关[26-27],并且会导致TG水平升高[28]。据此我们推测,非布司他治疗早期引起TG水平升高可能与VLDL合成增加导致肝臟TG输出增加有关,这需要更多基础研究来证实。
本研究存在一定的局限性:首先,本研究为回顾性队列研究,研究结论有待大样本多中心前瞻性研究证实;其次,本研究为观察性研究,未对非布司他引起TG水平升高的机制做深入探讨,以进一步明确非布司他与TG水平升高是否存在因果关系。
综上所述,非布司他治疗早期会引起痛风病人TG水平升高,故痛风人群在非布司他治疗期间应密切关注TG水平变化。
[参考文献]
[1]LIU R, HAN C, WU D, et al. Prevalence of hyperuricemia and gout in mainland China from 2000 to 2014: a systematic review and meta-analysis[J]. BioMed Research International, 2015,2015:762820.
[2]LEE S J, HIRSCH J D, TERKELTAUB R, et al. Perceptions of disease and health-related quality of life among patients with gout[J]. Rheumatology (Oxford, England), 2009,48(5):582-586.
[3]GAO Q H, CHENG X Y, MERRIMAN T R, et al. Trends in the manifestations of 9754 gout patients in a Chinese clinical center: a 10-year observational study[J]. Joint Bone Spine, 2020:105078. doi:10.1016/j.jbspin.2020.09.010.
[4]Triglyceride Coronary Disease Genetics Consortium And Emerging Risk Factors Collaboration, SARWAR N, SAND-HU M S, et al. Triglyceride-mediated pathways and coronary disease: collaborative analysis of 101 studies[J]. Lancet (London, England), 2010,375(9726):1634-1639.
[5]YANG A L, MCNABB-BALTAR J. Hypertriglyceridemia and acute pancreatitis[J]. Pancreatology, 2020,20(5):795-800.
[6]SINGH J A, REDDY S G, KUNDUKULAM J. Risk factors for gout and prevention: a systematic review of the literature[J]. Current Opinion in Rheumatology, 2011,23(2):192-202.
[7]MU Z P, WANG W, WANG J, et al. Predictors of poor response to urate-lowering therapy in patients with gout and hyperuricemia: a post-hoc analysis of a multicenter randomized trial[J]. Clinical Rheumatology, 2019,38(12):3511-3519.
[8]中華医学会内分泌学分会. 中国高尿酸血症与痛风诊疗指南(2019)[J]. 中华内分泌代谢杂志, 2020,36(1):1-13.
[9]WU J, ZHANG Y P, QU Y, et al. Efficacy of uric acid-lowe-ring therapy on hypercholesterolemia and hypertriglyceridemia in gouty patients[J]. International Journal of Rheumatic Diseases, 2019,22(8):1445-1451.
[10]LIANG N, SUN M S, SUN R X, et al. Baseline urate level and renal function predict outcomes of urate-lowering therapy using low doses of febuxostat and benzbromarone: a prospective, randomized controlled study in a Chinese primary gout cohort[J]. Arthritis Research & Therapy, 2019,21(1):200.
[11]ZIGA-SMAJIC N, SKRBO S, MURATOVIC S, et al. Comparison of the effects of allopurinol and febuxostat on the va-lues of triglycerides in hyperuricemic patients[J]. Medical Archives, 2020,74(3):172-176.
[12]中国胆固醇教育计划委员会. 高甘油三酯血症及其心血管风险管理专家共识[J]. 中华心血管病杂志, 2017,45(2):108-115.
[13]BORGHI C, ROSEI E A, BARDIN T, et al. Serum uric acid and the risk of cardiovascular and renal disease[J]. Journal of Hypertension, 2015,33(9):1729-1741.
[14]JIAO S, KAMEDA K, MATSUZAWA Y, et al. Hyperlipoproteinaemia in primary gout: hyperlipoproteinaemic phenotype and influence of alcohol intake and obesity in Japan[J]. Annals of the Rheumatic Diseases, 1986,45(4):308-313.
[15]LIANG J, JIANG Y T, HUANG Y F, et al. The comparison of dyslipidemia and serum uric acid in patients with gout and asymptomatic hyperuricemia: a cross-sectional study[J]. Li-pids in Health and Disease, 2020,19(1):31.
[16]HOU Y L, YANG X L, WANG C X, et al. Hypertriglyceridemia and hyperuricemia: a retrospective study of urban residents[J]. Lipids in Health and Disease, 2019,18(1):81.
[17]MUKHOPADHYAY P, GHOSH S, PANDIT K, et al. Uric acid and its correlation with various metabolic parameters: a population-based study[J]. Indian Journal of Endocrinology and Metabolism, 2019,23(1):134-139.
[18]HUANG Y Y, YE Z, GU S W, et al. The efficacy and tolerability of febuxostat treatment in a cohort of Chinese Han population with history of gout[J]. The Journal of International Medical Research, 2020,48(5):300060520902950.
[19]CHOU H W, CHIU H T, TSAI C W, et al. Comparative effectiveness of allopurinol, febuxostat and benzbromarone on renal function in chronic kidney disease patients with hyperuricemia: a 13-year inception cohort study[J]. Nephrology Dialysis Transplantation, 2018,33(9):1620-1627.
[20]STRILCHUK L, FOGACCI F, CICERO A F. Safety and to-lerability of available urate-lowering drugs: a critical review[J]. Expert Opinion on Drug Safety, 2019,18(4):261-271.
[21]NAKATSU Y, SENO Y, KUSHIYAMA A, et al. The xanthine oxidase inhibitor febuxostat suppresses development of nonalcoholic steatohepatitis in a rodent model[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2015,309(1):G42-G51.
[22]NISHIKAWA T, NAGATA N, SHIMAKAMI T, et al. Xanthine oxidase inhibition attenuates insulin resistance and diet-induced steatohepatitis in mice[J]. Scientific Reports, 2020,10(1):815.
[23]XU C F, WAN X Y, XU L, et al. Xanthine oxidase in non-alcoholic fatty liver disease and hyperuricemia: one stone hits two birds[J]. Journal of Hepatology, 2015,62(6):1412-1419.
[24]GOEDEKE L, BATES J, VATNER D F, et al. Acetyl-CoA carboxylase inhibition reverses NAFLD and hepatic insulin resistance but promotes hypertriglyceridemia in rodents[J]. Hepatology (Baltimore, Md), 2018,68(6):2197-2211.
[25]HAVEL R J, KANE J P, BALASSE E O, et al. Splanchnic metabolism of free fatty acids and production of triglycerides of very low density lipoproteins in normotriglyceridemic and hypertriglyceridemic humans[J]. The Journal of Clinical Investigation, 1970,49(11):2017-2035.
[26]ZAREI M, BARROSO E, PALOMER X, et al. Hepatic regulation of VLDL receptor by PPARβ/δ and FGF21 modulates non-alcoholic fatty liver disease[J]. Molecular Metabolism, 2018,8:117-131.
[27]ZHU X H, XIONG T, LIU P Y, et al. Quercetin ameliorates HFD-induced NAFLD by promoting hepatic VLDL assembly and lipophagy via the IRE1a/XBP1s pathway[J]. Food and Chemical Toxicology, 2018,114:52-60.
[28]DE VRIES-VAN DER WEIJ J, DE HAAN W, HU L H, et al. Bexarotene induces dyslipidemia by increased very low-density lipoprotein production and cholesteryl ester transfer protein-mediated reduction of high-density lipoprotein[J]. Endocrinology, 2009,150(5):2368-2375.
(本文編辑马伟平)
