姜黄素对高糖诱导的人视网膜血管内皮细胞增殖及VEGF和NF-κB p65表达的抑制作用
2022-05-05潘颖喆谢安琪
项 彪,潘颖喆,谢安琪,程 希,邓 玲
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的慢性微血管并发症之一。DR导致视力下降甚至失明最主要的阶段是增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)。流行病学调查表明,DR诊断25a后,PDR的患病率接近50%,且大多数1型糖尿病(T1DM)患者将在大约10a后发展为PDR[1],其病理学特征主要为晚期组织缺血缺氧,诱导多种促血管生成因子和炎症因子的释放增加,导致新生血管的形成,从而继发玻璃体积血和视网膜脱离引起患者视力丧失[2]。在DR的发生发展进程中,VEGF和NF-κB起着非常关键的作用。其中,血管内皮生长因子(vascular endothelial growth factor,VEGF)被认为是促进血管生成的最主要因子,也是抗血管生成的重要靶点[3]。研究发现,PDR患者玻璃体和纤维血管组织中的VEGF水平显著高于正常眼[4]。核因子-κB(nuclear factor-κB,NF-κB)是一种多向性核转录因子,广泛参与机体的免疫、炎症等生理病理过程[5]。研究发现,DR高血糖状态可引起活性氧(reactive oxygen species,ROS)生成增加,从而介导大量的炎症因子释放,而炎症因子和ROS水平上调又可进一步激活NF-κB,导致视网膜低度炎症[6]。姜黄素(curcumin,Cur)是一种从姜科植物姜黄中提取的主要的多酚类活性成分,具有抗氧化、抗炎、抗肿瘤等多种药理作用,尤其在抗肿瘤方面具有较强的功效,能通过下调VEGF的表达抑制肿瘤新生血管的形成[7-8]。研究还发现,姜黄素显著降低脂质过氧化,增加细胞内抗氧化剂含量,调节抗氧化酶,并清除高血糖诱导的ROS产生[9]。但其对于高糖诱导的人视网膜血管内皮细胞(human retinal capillary endothelial cells,HRCECs)是否也能通过降低VEGF、NF-κB的表达而发挥治疗作用尚不明确。因此,本研究通过CCK-8细胞增殖实验、Western-blot及免疫细胞化学法,探讨姜黄素对于高糖诱导的HRCECs作用的潜在机制。
1材料和方法
1.1材料HRCECs(上海中科院细胞库);低糖/高糖DMEM培养基(美国Gibco公司);姜黄素、胰酶(美国Sigma公司);CCK-8细胞增殖试剂盒(上海碧云天生物公司);兔抗人VEGF多克隆抗体,兔抗人NF-κB多克隆抗体,兔抗人血管内皮生长因子IgG,蛋白预染Marker,BCA蛋白浓度测定试剂盒(武汉博士德生物公司);倒置相差显微镜(日本Olympus公司);全自动酶标仪(美国Bio-Rad公司)。本研究经襄阳市第一人民医院医学伦理委员会审核通过。
1.2方法
1.2.1姜黄素溶液的配置姜黄素,纯度>95%,称取14.2mg姜黄素粉末溶解于1mL 100%的二甲基亚砜(DMSO)溶剂中,根据C=m/M.V,配制成浓度为40mmol/L的姜黄素母液,除菌分装后保存在-20℃冰箱中。临用前,用DMEM高糖培养基稀释至实验所需浓度,DMSO终浓度<0.1%。
1.2.2细胞处理及分组将HRCECs置于含有青/链双抗、胎牛血清的DMEM培养基中,放入培养箱中培养。取处于对数生长期的细胞进行实验分组:空白组(G0组,只含高糖DMEM培养基的调零组),正常对照组(NG组,低糖DMEM培养基+细胞),高糖对照组(HG组,高糖DMEM培养基+细胞),G1组(高糖DMEM培养基+细胞+20μmol/L姜黄素),G2组(高糖DMEM培养基+细胞+40μmol/L姜黄素),G3组(高糖DMEM培养基+细胞+80μmol/L姜黄素)。正常糖浓度的DMEM培养基葡萄糖浓度为5.5mmol/L,统称为低糖培养基;高糖DMEM培养基中葡萄糖浓度为25mmol/L;G0组仅设于CCK-8实验。
1.2.3CCK-8法检测HRCECs增殖取对数生长期且长势良好的HRCECs用于实验,将细胞经PBS洗涤、胰酶消化、离心后,用DMEM培养基制成浓度为5×104cell/mL的单细胞悬液,以每孔200μL将悬液接种于96孔板内,每组设5个复孔,培养至细胞贴壁。按照上述分组分别培养12、24、48h,向每孔加入CCK-8溶液10μL,37℃孵育4h后,用酶标仪在450nm波长下测定各孔吸光度值(A值),计算每组浓度复孔平均值及细胞增殖抑制率,上述实验重复3次。细胞抑制率(%)=[(对照组平均A值-加药组平均A值)/(对照组平均A值-空白组平均A值)]×100%。
1.2.4Western-blot法检测HRCECs中蛋白的表达收集各组处理24h后的HRCECs用PBS洗涤,加入适量的RIPA裂解液4℃下反应20min以提取细胞总蛋白。加入1/5体积的5×蛋白上样缓冲液,置于100℃沸水中10min。BCA法检测蛋白浓度。按照每孔50μg上样量进行SDS-PAGE电泳。恒流300mA电转90min后,用5%的脱脂牛奶室温下封闭60min。然后分别加入经TBST液稀释的VEGF、NF-κB和β-actin一抗4℃孵育过夜,洗膜后加入辣根过氧化物酶标记的二抗室温下孵育1h。采用Image J软件测定灰度值,计算A值,以β-actin为内参计算蛋白相对表达量。
1.2.5免疫细胞化学法检测HRCECs中蛋白的表达将预先消毒灭菌的盖玻片放入6孔板内,制备浓度为5.0×104cell/mL的单细胞悬液,每孔内滴入2mL悬液,培养48h后弃液,按照分组加入不同的条件培养液,共5组:NG组、HG组、G1~G3组,每组设2个复孔,继续培养24h后取出盖玻片,用PBS洗涤、4%多聚甲醛室温固定15min。再经PBS洗涤,0.1%Triton-X100室温通透化处理15min作染色前处理。然后在3%过氧化氢-甲醇溶液中浸泡30min,以灭活内源性过氧化物酶,用PBS液洗涤后,再将其置于二抗来源的非免疫兔血清湿盒中封闭30min,去除血清后甩干;加入一抗(兔抗人VEGF 1∶200),同时用PBS代替一抗设为阴性对照组,4℃湿盒中过夜,室温下复温30min,PBS液洗涤,加入生物素标记的二抗37℃孵育1h。最后,经SABC法染色、DAB显色、苏木素复染、乙醇梯度脱水、二甲苯透明、中性树胶封片,干燥后显微镜下观察。上述实验重复3次。计算各组标本灰度值:阳性灰度值与背景灰度值之差。
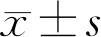
2结果
2.1CCK-8法检测姜黄素对高糖诱导的HRCECs增殖能力的影响干预不同时间各组A450比较,差异有统计学意义(F组间=687.00,F时间=179.50,F交互=26.74,均P<0.001)。与NG组相比,HG组中HRCECs增殖能力显著增强(P<0.01),随着干预时间的延长而增强。增殖抑制率随着药物的浓度增加而上升,具有浓度依赖性。在相同药物浓度作用下,随着干预时间的延长,细胞增殖能力减弱(P<0.01),细胞增殖抑制率逐渐上升,具有时间依赖性。结果表明,高糖环境下的HRCECs增殖能力显著增强,而姜黄素对高糖诱导的HRCECs增殖有明显抑制作用,且随着浓度的增加、干预时间的延长抑制作用增强,见表1,图1。

表1 不同浓度姜黄素作用不同时间后对高糖诱导的HRCECs增殖的影响
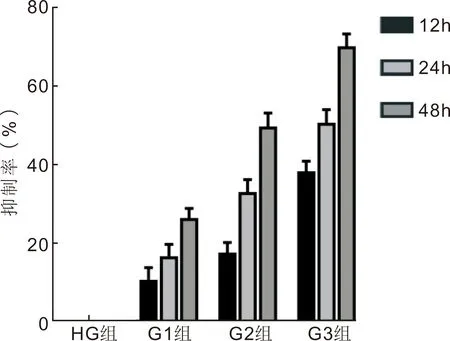
图1 不同浓度姜黄素作用不同时间后对高糖诱导的HRCECs增殖抑制率的影响。
2.2Western-blot法检测姜黄素对高糖诱导的HRCECs中VEGF-A和NF-κBp65表达的影响实验结果显示:与NG组比较,HG组中VEGF-A、NF-κB p65的表达显著升高(P<0.01);与HG组比较,G1~G3组中VEGF-A、NF-κB p65的表达均显著下降(P<0.01);在相同药物浓度作用下,随着干预时间延长,HRCECs中VEGF-A、NF-κB p65的表达呈下降趋势(P<0.01);在相同干预时间下,HG组与G1~G3组之间两两比较,随着姜黄素浓度增加,HRCECs中VEGF-A、NF-κB p65的表达呈下降趋势(P<0.01)。结果表明,姜黄素对高糖诱导的HRCECs中VEGF-A、NF-κB p65的表达具有下调作用,且在药物浓度范围内呈剂量-时间依赖性,见表2、3,图2~4。

表2 高糖诱导的HRCECs经不同浓度姜黄素干预12、24、48h后VEGF-A的表达

图2 姜黄素作用12h后对高糖诱导的HRCECs中VEGF-A和NF-κB p65表达的影响。

图3 姜黄素作用24h后对高糖诱导的HRCECs中VEGF-A和NF-κB p65表达的影响。

图4 姜黄素作用48h后对高糖诱导的HRCECs中VEGF-A和NF-κB p65表达的影响。
2.3免疫细胞化学法检测姜黄素对高糖诱导的HRCECs中VEGF表达的影响VEGF的表达主要存在于HRCECs的细胞膜及细胞浆中,阳性表现为棕褐色颗粒着染。灰度值结果示,与NG组比较,HG组HRCECs中VEGF的表达明显增多(P<0.01)。不同浓度姜黄素干预24h后与HG组比较,HRCECs中VEGF表达明显减少(P<0.01),随着药物浓度增加,细胞膜及细胞浆中的棕褐色阳性着染逐渐减少,颜色变淡,不同浓度加药组之间两两比较,差异均有统计学意义(P<0.01)。表明姜黄素能有效抑制HRCECs中VEGF的表达,且随着药物浓度增加抑制作用增强,上述结果与Western-blot结果相符,见表4、图5。

图5 免疫细胞化学法检测姜黄素对高糖诱导的HRCECs中VEGF表达的影响。
3讨论
视网膜新生血管(retinal neovascularization ,RNV)是DR患者病情恶化、视力丧失的主要原因,其发生发展与HRCECs的增殖、VEGF及NF-κB表达上调之间关系密切。

表3 高糖诱导的HRCECs经不同浓度姜黄素干预12、24、48h后NF-κB p65的表达

表4 姜黄素作用24h后各组HRCECs中VEGF的表达
新生血管的形成过程十分复杂,主要包括血管基底膜降解、内皮细胞增殖、迁移、成管四个阶段。研究发现,长期高糖环境对不同组织的血管内皮细胞影响不同,对大血管内皮细胞主要表现为抑制其生长,而对微血管内皮细胞反而表现为促进其增殖[10]。本实验结果也提示,高糖环境下,HRCECs的增殖能力显著增强,与既往文献报道相符[11];在给予不用浓度姜黄素干预后,可明显降低HRCECs的增殖能力,且抑制作用随着药物浓度增加、干预时间延长而增强。表明高糖诱导的HRCECs增殖能力增强,而姜黄素对其可有效抑制。
参与调控RNV形成的细胞因子众多,血管生成因子(如VEGF)起刺激作用,血管抑素和色素上皮衍生因子(PEDF)起抑制作用[12]。正常环境下,各种因子保持动态平衡。但在高血糖、氧化应激及非感染性炎症反应等病理状态时,平衡状态会被破坏,促使血管生成的主要因子VEGF表达上调[13]。VEGF与其受体结合后,可激活下游的PI3K/Akt、p38及Raf等通路,来调控内皮细胞的增殖。本实验中Western-blot和免疫细胞化学法结果均显示,HG组细胞中VEGF的表达量较NG组显著增加,表明一定浓度范围内高糖环境可上调VEGF的表达,与既往文献报道相符[11]。姜黄素在抗新生血管形成方面的作用已经得到了证实。研究发现,姜黄素能通过调控VEGF信号通路诱导氧化应激和抑制血管生成,在结直肠癌的治疗上发挥作用[8]。李勇等[7]研究发现,姜黄素可通过降低VEGF的表达水平,抑制肝癌组织缺氧诱导的血管形成和肝癌细胞生长转移。本实验采用不同浓度姜黄素处理高糖诱导的HRCECs后发现,加药组细胞VEGF的表达显著下降,且呈浓度与时间依赖性。结合CCK-8结果,表明姜黄素抑制体外高糖诱导的HRCECs增殖可能与VEGF表达下调有关。
NF-κB是一种关键的促炎转录因子,其信号通路的激活是DR炎症反应发生发展过程中的关键一步。在PDR患者中,高血糖介导的ROS生成增加、NF-κB激活与VEGF上调之间关系显著[14]。研究发现,高糖环境下氧化应激诱导的ROS上调和非酶糖基化产物与其受体的结合,均能引起NF-κB的持续激活[6,15]。正常情况下,NF-κB在胞浆中与抑制蛋白(I-κB)结合处于失活状态。当受到刺激时,I-κB激酶发生磷酸化,导致游离的NF-κB易位到细胞核,与特定的基因序列结合,诱导多种促炎因子、黏附因子、炎性酶、趋化因子等表达,从而促进炎症发生、细胞增殖和血管生成[5],表明NF-κB的激活是始动事件,随后其他炎症通路的激活逐步导致了DR微血管损伤。研究还发现NF-κB通路的激活能诱导VEGF的表达[16]。姜黄素对NF-κB通路的抑制作用已在多种细胞中被报道。研究发现,姜黄素能通过抑制I-κB激酶和NF-κB活性诱导慢性粒细胞白血病细胞的KCL-22细胞凋亡[17],其机制可能是由姜黄素自身的抗炎、抗氧化等药理特性改变了细胞的微环境和对ROS水平的调控。本研究中Western-blot结果示HG组细胞中NF-κB p65的表达量较NG组显著增加,表明NF-κB通路在DR进展过程发挥着重要作用,与既往文献报道相符[11]。在给予不用浓度姜黄素干预后,加药组细胞NF-κB p65的表达显著下降,且呈浓度与时间依赖性。结合CCK-8结果,表明姜黄素抑制体外高糖诱导的HRCECs增殖可能与NF-κB p65表达下调有关。
综上所述,本实验证实姜黄素能抑制高糖诱导的HRCECs增殖,其机制可能与其下调HRCECs中VEGF-A、NF-κB p65的表达有关。但本实验仅是体外实验,而且关于RNV的生成因素只考虑了VEGF和NF-κB,实际上DR的发病机制复杂,参与的细胞因子众多,是多种因素相互作用的结果。本实验尚未明确姜黄素抑制VEGF、NF-κB表达的具体机制,及它们间的相互作用关系。姜黄素对高糖诱导的HRCECs增殖及VEGF、NF-κB p65表达的抑制作用的具体机制等问题有待进一步实验进行深入研究。
