雷珠单抗治疗慢性中心性浆液性脉络膜视网膜病变合并CNV的疗效及其影响因素
2022-05-05杨婷婷
赵 玥,杨婷婷,蒋 沁,姚 进
0引言
慢性中心性浆液性脉络膜视网膜病变(chronic central serous chorioretinopathy,CCSC)是视网膜色素上皮(retina pigment epithelium,RPE)屏障功能受损导致的黄斑区或后极部局限性浆液性视网膜神经上皮层脱离,多伴有局灶性RPE隆起[1-3]。CCSC病程长期迁延不愈可引起弥漫性RPE损害以及继发脉络膜新生血管(choroidal neovascularization,CNV)形成,造成视力不可逆损害[4-5]。CCSC可采用传统局灶性激光、半量光动力疗法(photodynamic therapy,PDT)、微脉冲激光(subthreshold micropulse laser,SML)以及靶向导航激光(navilas precise navigation laser)等方式治疗,当继发活动性CNV时则需要及时的抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗[6-7]。为了解CCSC合并CNV对抗VEGF的应答效果并分析可能影响应答的因素,我们使用多模式成像进行诊断并综合评估,现将结果报告如下。
1对象和方法
1.1对象选取2018-11/2020-05于南京医科大学附属眼科医院就诊并经眼底荧光血管造影(fundus fluoresceine angiography,FFA)及光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)确诊为CCSC合并CNV的患者30例30眼,本研究已通过南京医科大学附属眼科医院伦理委员会批准,符合《赫尔辛基宣言》,所有患者均签署知情同意书。
1.1.1纳入标准将同时符合以下5项标准的患眼纳入本次研究:(1)频域相干光断层扫描(spectral domain optical coherence tomography,SD-OCT)可见黄斑区视网膜下积液(subretinal fluid,SRF),黄斑中心凹下脉络膜厚度(subfovealchoroidthickness,SFCT)增厚;(2)OCTA可见黄斑区局限性神经上皮层或合并RPE层脱离;脉络膜毛细血管层CNV形成,位于RPE层下并伴血流信号;(3)FFA可见黄斑区色素上皮损害形成的点片状透见荧光灶及渗漏点;(4)吲哚菁绿血管造影(indocyanine green angiography,ICGA)可见病变区脉络膜血管扩张,黄斑区异常新生血管形成;(5)患眼病程均大于4mo。
1.1.2排除标准将符合以下任意1项标准的患眼排除:(1)合并糖尿病视网膜病变、视网膜静脉阻塞、葡萄膜炎、年龄相关性黄斑变性、息肉状脉络膜病变等视网膜及脉络膜疾病者;(2)合并全身疾病、肝肾功能不全和严重过敏病史,不能进行ICGA检查的患者;(3)既往接受过其他方式(黄斑微脉冲激光、精准导航激光或玻璃体腔抗VEGF注射)治疗者;(4)影响眼底清晰度的屈光介质混浊;(5)不同意治疗,拒绝签署手术同意书及不能严格随访观察及相关资料不全者。
1.2方法
1.2.1最佳矫正视力最佳矫正视力(BCVA)采用Snellen视力表进行,并将结果转换为最小分辨角对数(LogMAR)视力。
1.2.2OCT 采用共焦激光同步血管造影系统(Heidelberg Spectralis,HRA+OCT)检查,对患眼黄斑区视网膜脉络膜进行增强深度成像相干光断层扫描成像(enhanced depth imaging optical coherence tomography,EDI-OCT)扫描。黄斑中心凹厚度(central macular thickness,CMT)是指黄斑中心凹内界膜至RPE层的距离;SFCT是指黄斑中心凹RPE层到脉络膜/巩膜交界处之间的厚度(图1);使用机器自带软件进行测量,为进一步确保测量的准确性,每只患眼均由同一位医生测量2次,获取平均值。

图1 OCT检查 CMT测量,黄斑中心凹内界膜至RPE层的距离(红箭头);SFCT测量,黄斑中心凹RPE层到脉络膜/巩膜交界处之间的厚度(黄箭头)。
1.2.3OCTA 采用AngioVue OCTA系统(Avanti RTVue XR,Optovue)进行检查。扫描区域为3mm×3mm和6mm×6mm范围黄斑区视网膜,扫描质量系数≥6/10,图像分辨率为304像素×304像素。系统自动处理图像后默认分为视网膜浅层毛细血管层、视网膜深层毛细血管层、外层视网膜及脉络膜毛细血管层;血流图观察脉络膜毛细血管层有无异常新生血管形态确定是否有隐匿性CNV形成,结合断层B-scan图及结构En-face图观察积液范围。在AngioVue系统的新生血管面积测量模式下,标出需要测定的CNV病变区域后,算法自动提取范围内的血流信号并标记为黄色,CNV血流面积值经自动统计后以平方毫米(mm2)为单位进行表达(图2)。

图2 OCTA检查 选中区域面积(蓝框),CNV面积(红框)。
1.2.4FFA联合ICGA 采用共焦激光同步血管造影系统(heidelberg spectralis,HRA)进行检查。检查前确认所有患者无哮喘及青霉素等过敏史,血压、血糖、肝肾功能及心电图检查结果无异常,经皮试结果为阴性后,将吲哚菁绿25mg溶于5mL注射用水,与20%荧光素3mL混合,拍摄双眼自发荧光后,在6s内将溶液从肘静脉快速注入,对眼底情况进行动态拍摄,在造影早期观察有无渗漏点及异常新生血管形态,晚期观察渗漏变化。
1.2.5玻璃体腔抗VEGF注射所有患眼均行玻璃体腔雷珠单抗(intravitreal ranibizumab,IVR)注射治疗,均在无菌层流手术室按无菌操作规程完成。1mL注射器抽取10mg/mL雷珠单抗0.05mL(含雷珠单抗0.5mg),自球结膜距角巩膜缘3.5~4.0mm睫状体平坦部穿刺注射。
1.2.6随访观察随访时间为治疗后1wk,1mo,末次注药治疗后3mo,根据BCVA、SFCT、CMT以及CNV面积变化来评估抗VEGF治疗效果。
1.2.7再次治疗及停止治疗指标每次眼内注药治疗后1mo时复查OCT,仍存在SRF则再次进行IVR注射治疗;若连续3次治疗后SRF始终无明显变化,则暂停眼内注药治疗,进行定期随访观察。
统计学分析:采用统计软件SPSS 20.0进行分析。计量资料均符合正态分布,采用均数±标准差形式描述;各观察指标的比较采用重复测量方差分析,组内两两比较采用LSD-t检验,采用Pearson相关分析检验数据之间的相关性。P<0.05为差异有统计学意义。
2结果
2.1一般临床特征所有患者均单眼发病,年龄24~59(平均49.53±5.78)岁。男19例19眼,女11例11眼,平均病程11.72±1.3mo。其中,患者17眼接受1次眼内注药治疗,患者9眼接受2次眼内注药治疗,患者4眼接受3次眼内注药治疗。
2.2眼底检查治疗前,所有患眼眼底检查可见黄斑区水肿并伴有弥漫性视网膜色素上皮紊乱改变(图3A、4A);EDI-OCT表现为局限性浆液性神经上皮层脱离,RPE扁平抬高,Bruch膜可见,脉络膜不同程度增厚(图3B、4B);FFA显示黄斑区或后极部均有不同程度及范围的不规则透见荧光夹杂遮蔽荧光,提示广泛的色素上皮损害存在(图3C、4C),其中有16例16眼黄斑区周围呈一个或多个墨渍样强荧光渗漏点;14例14眼表现为病灶区域内弥漫的隐匿性渗漏,无明确渗漏点。ICGA显示所有患眼早期可见黄斑区脉络膜中大血管扩张,CNV呈高荧光(图3D、4D),晚期时14例14眼CNV可见染料渗漏,其余患眼可见与FFA一致的墨渍样渗漏点,CNV无明显渗漏;OCTA显示脉络膜毛细血管层可见异常新生血管形态,位于REP层下方,对应B-scan可见RPE扁平抬高,呈“双层征”改变,内部血流信号丰富(图3E、4E)。
2.3BCVA 各时间点BCVA比较,差异有统计学意义(F=87.21,P<0.01),见表1。进一步两两比较,治疗后各时间点BCVA分别与治疗前比较,差异均有统计学意义(t=6.52、4.71、6.01,P=0.03、<0.01、<0.01)。Pearson相关性分析显示,BCVA变化量与基线BCVA及CMT呈显著正相关(r=0.89、0.43,P<0.01、0.02),与基线CNV血流面积及SFCT无明显相关性(r=0.08、0.04,P=0.69、0.82),见图5。
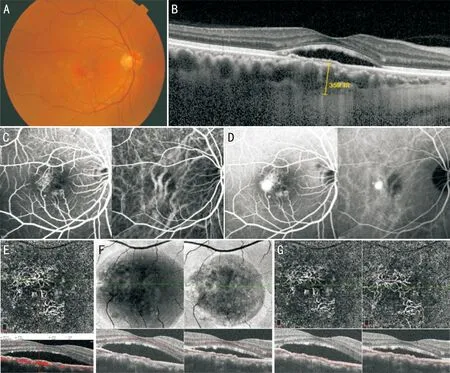
图3 CCSC伴隐匿性CNV A:右眼眼底彩照示黄斑区视网膜水肿,周围色素紊乱;B:EDI-OCT示黄斑区局限性浆液性神经上皮层脱离,RPE层呈双层征改变,脉络膜增厚;C:FFA示黄斑区可见片状高荧光,晚期颞侧处呈典型中心性浆液性脉络膜视网膜病变的“墨渍样”渗漏;D:ICGA示黄斑区脉络膜中大血管扩张,晚期可见与FFA一致的高荧光渗漏;E:OCTA血流图示脉络膜毛细血管层可见团状CNV形成,对应B-scan可见RPE层扁平抬高并伴血流信号,周围局限性浆液性神经上皮层脱离;F:En-face OCT随访图,自左往右可见在第4次IVR注射治疗后3mo时黄斑区神经上皮层下积液较治疗前明显吸收,但仍残余少量积液;G:脉络膜毛细血管层OCTA随访图,自左往右可见CNV形态无明显改变。

图4 CCSC伴隐匿性CNV A:右眼眼底彩照示黄斑区水肿及色素紊乱;B:SD-OCT示黄斑区局限性浆液性神经上皮层脱离,RPE扁平隆起,脉络膜增厚;C:FFA示早期黄斑区片状弱高荧光,晚期呈隐匿性渗漏;D:ICGA示黄斑区脉络膜中大血管扩张,CNV形成并于晚期渗漏,边界不清;E:OCTA血流图示脉络膜毛细血管层CNV形成,对应B-scan可见RPE层扁平样抬高并血流信号丰富,周围伴局限性浆液性神经上皮层脱离;F:En-face OCT随访图,自左往右可见可见第3次IVR注射治疗后3mo时黄斑区神经上皮层下积液已完全吸收;G:脉络膜毛细血管层OCTA随访图,自左往右可见CNV形态无明显改变。

图5 BCVA变化量与基线BCVA、CMT、CNV血流面积、SFCT的相关性分析散点图 A:BCVA;B:CMT;C:CNV血流面积;D:SFCT。
2.4CMT 末次治疗后3mo时,有47%患眼SRF完全吸收,7%患眼SRF较基线时稍增多(图3F、4F)。各时间点CMT比较,差异有统计学意义(F=62.06,P<0.01),见表1。进一步两两比较,治疗后各时间点CMT分别与治疗前比较,差异均有统计学意义(t=3.08、6.57、4.90,P=0.01、0.02、<0.01)。Pearson相关性分析显示,CMT变化量与基线BCVA、CMT、CNV血流面积均呈显著正相关(r=0.43、0.41、0.41,P=0.02、0.03、0.03);与基线SFCT无明显相关性(r=0.08,P=0.67),见图6。

图6 CMT变化量与基线BCVA、CMT、CNV血流面积、SFCT的相关性分析散点图 A:BCVA;B:CMT;C:CNV血流面积;D:SFCT。
2.5SFCT 各时间点SFCT比较,差异有统计学意义(F=57.98,P<0.01),见表1。进一步两两比较,治疗后各时间点SFCT分别与治疗前比较,差异均有统计学意义(t=5.11、9.03、4.27,P=0.03、<0.01、<0.01)。
2.6CNV血流面积各时间点CNV血流面积比较,差异有统计学意义(F=70.78,P<0.01),见表1。进一步两两比较,治疗后1wk,1mo时CNV血流面积分别与治疗前比较,差异均无统计学意义(t=7.01、6.54,P=0.07、0.05,图3G、4G),末次注药治疗后3mo时CNV血流面积与治疗前比较,差异具有统计学意义(t=4.51,P=0.02)。

表1 慢性CSC伴CNV眼内注药前后各指标比较
2.7并发症治疗后1例出现球结膜下出血,未进行特殊处理,于治疗后1wk自行吸收。随访期间未出现玻璃体积血、眼内炎等治疗相关严重并发症,未见过敏等全身不良反应发生。
3讨论
关于CCSC继发CNV的发病机制,有研究认为可能是由于脉络膜血管通透性增加、脉络膜循环障碍,导致脉络膜毛细血管萎缩及缺血改变,从而诱导了VEGF的上调,影响内皮细胞紧密连接,导致渗出、脉络膜血管扩张及增厚,最终形成CNV[8-10]。玻璃体腔抗VEGF因子注射治疗的方法可用于CCSC继发CNV或伴有黄斑区视网膜下纤维蛋白积聚[11],可以从一定程度上降低脉络膜毛细血管通透性,改善脉络膜循环,减轻脉络膜组织流体静力压,从而有效阻断视网膜下液的来源以及消退CNV[12-13]。
在本研究中,我们对30例CCSC合并CNV的患眼进行了IVR注射治疗,所有患眼BCVA在治疗后1wk时即有提高;末次治疗3mo后SFCT较基线时略降低,但仍较正常偏厚;CMT均较基线时降低,以上均与既往文献报道一致[14-15]。但在本次研究中我们也发现,末次治疗3mo时,只有47%(14/30)患眼的黄斑区SRF可完全吸收,7%(2/30)较基线时增多,46%(14/30)仍存在少量积液。我们推测引起这种治疗应答差异性的原因可能与患眼中VEGF的参与有关。部分患眼的SRF可能由活动性CNV引起,眼内高VEGF水平对于抗VEGF药物治疗应答敏感;而部分由于RPE屏障功能破坏而引发CCSC的患眼,虽然已有隐匿性CNV形成,但此时CNV可能仍是静止性的,眼内VEGF水平不高,因此对抗VEGF药物治疗不敏感,故而这类患眼往往对PDT或微脉冲激光等治疗效果较好。末次治疗3mo时,有70%(21/30)的患眼视力提高,23%(7/30)视力变化不明显,7%(2/30)视力下降。CCSC继发CNV的SRF是影响患眼视力的主要因素,部分患者虽然SRF较治疗前明显吸收,视力却提高不明显,甚至有所下降,这可能是由于长期的SRF导致RPE细胞功能障碍,从而引起了的进行性和不可逆性的视功能损害。同时我们也观察到,所有患眼的CNV血流面积在随访过程虽有一定程度的缩小,但总体变化不明显,可能与隐匿性CNV大多病程较长、血管相对成熟化有关,因此在短期内观察变化不明显。
本次研究的局限性在于治疗方案较为单一,未能与其它治疗方法及不同抗VEGF药物等进行对照研究;同时由于设备版本的局限性,未能将治疗前后CNV管径等进行量化分析比较,这些均有待于今后在这些方面进行更深入的全面研究,以探寻到CCSC合并CNV最佳的治疗方式。此外,本次研究样本量较小,随访时间仍然偏短,也均有待于积累更多样本和分析长期结果。
综上所述,CCSC合并CNV对抗VEGF治疗反应不一提示引起SRF的原因是多因素的,可能由CCSC、CNV或者二者的共同参与所导致,CNV并不是唯一因素。因此,治疗前能够明确引起SRF的因素,对确定治疗方案有重要的指导作用。同时,基线时的CNV血流面积、BCVA和CMT都可能是影响最终眼内注药治疗效果的有意义因素。
