环境内分泌干扰物对子宫内膜异位症影响的生物信息学分析
2022-05-05李楠陈蕾张琨
李楠 陈蕾 张琨
环境内分泌干扰物(environmental endocrine disrupting chemicals,EDCs)包括双酚类、邻苯二甲酸酯类、二恶英类等,广泛应用于洗涤剂、增塑剂、阻燃剂等生产中。大部分EDCs具有半衰期长和生物富集等特点,在体内改变DNA甲基化水平,并长期影响生殖和类固醇激素相关基因的表达水平,进而影响女性性腺发育的激素依赖途径。而作为雌激素依赖性的子宫内膜异位症(endometriosis,EMS)发病率呈逐年增加趋势,持久影响女性生育能力及生活质量。已知EMS发病受遗传、氧化应激、免疫、环境等多种因素影响,且大量研究提示EDCs可能在病因学上参与EMS的发生。但EDCs种类繁多,作用机制复杂,人类EMS和EDCs暴露之间因果关系的直接研究证据很难获得,导致EDCs对EMS发生的潜在机制仍无定论。随着生物信息学的发展,遗传多态性研究备受关注。笔者采用生物信息学分析挖掘EDCs暴露在EMS发生中的潜在作用靶点及相关通路,旨在寻找EDCs暴露对EMS的潜在影响,为继续探究复杂环境中EMS的病因、致病机制乃至防治提供参考。
1 资料和方法
1.1 基因筛选 在毒物基因组学数据库(comparative toxicogenomics database,CTD)(http://ctdbase.org/)中检索双酚A(bisphenol A,BPA)、四氯二苯并对二恶英(tetrachlorodibenzo-p-dioxin,TCDD)、邻苯二甲酸二酯[di-(2-ethylhcxyl)phthalate,DEHP],在疾病栏找到Endometriosis,确定在EMS发生中与各EDCs暴露相关的基因。
1.2 确定共同作用基因 在Venn图网络工具(bioinformatics.psb.ugent.be/webtools/Venn/)中输入CTD数据库检索到的上述3种EDCs在EMS中的调控基因,进而确定3者调控的公共基因。
1.3 基因生物信息学分析 将上述共同作用基因输入富集分析数据库(the Database for Annotation,Visualization and Integrated Discovery,DAVID)(https://david.ncifcrf.gov/),对其进行基因功能注释(gene onotology,GO)分析[错误发现率(FDR)值<0.01为差异有统计学意义]和京都基因与基因百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析(FDR 值<0.05为差异有统计学意义)。
1.4 基因蛋白互作网络(protein-protein interaction networks,PPI)构建 将共同作用基因上传到STRING数据库(http://string-db.org/)进行 PPI建设,并用 Cytoscape3.8.0 软件(www.cytoscape.org/)将 PPI网络可视化,并利用插件Analyze Network计算连接度最高的6个基因作为关键基因。
2 结果
2.1 确定共同作用基因 在CTD数据库检索到BPA与EMS相关的基因158个,TCDD与EMS相关的基因155个,DEPH与EMS相关的基因 25个,3者调控EMS的公共基因共25个,见图1。
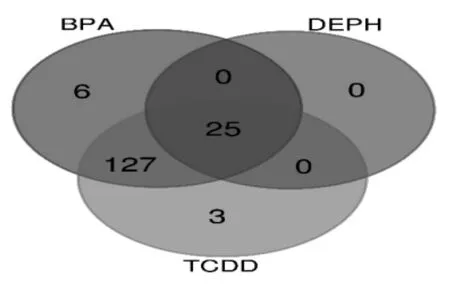
图1 环境内分泌干扰物作用的公共基因
2.2 EDCs公共作用基因的GO分析 上述25个基因中包含一个非人类基因,对剩下24个基因进行GO分析,这些公共作用基因主要富集于对遗传信息的调控,以及受体和信号的转导等功能,见图2。
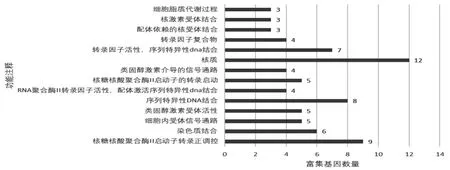
图2 环境内分泌干扰物公共作用基因的功能注释分析
2.3 EDCs公共作用基因的KEGG分析 对24个公共基因的作用途径进行KEGG分析,这些公共作用基因主要富集于甲状腺激素信号通路、催乳素信号通路、卵巢类固醇合成、MAPK信号通路和雌激素信号通路。结果提示,EDCs确实发挥了内分泌干扰作用,干扰机体内分泌相关信号通路,见图3。

图3 环境内分泌干扰物公共作用基因的富集通路分析
2.4 EDCs公共作用基因的PPI分析 最后筛选出原癌基因(fos proto-oncogene,FOS)、糖皮质激素受体(nuclear receptor subfamily 3 group C member 1,NR3C1)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、雌激素受体 β(estrogen receptor beta,ESR2)、类固醇受体共激活剂(nuclear receptor coactivator 1,NCOA1)、前列腺素内过氧化物合酶2(prostaglandin endoperoxide synthase 2,PTGS2)6 种在该网络中连接度最强的基因。
3 讨论
EMS是女性月经来潮后所发生的一种子宫内膜异位到其他部位的疾病。有研究发现,一些成人疾病可能起源于胎儿,即母体压力、污染物暴露等因素会影响胎儿基因编码,导致胎儿器官结构、新陈代谢和表观遗传等发生改变,增加患病风险[1]。EMS是一种雌激素依赖性疾病,雌激素对靶细胞的活性可能通过雌激素受体来实现。FOS被认为是雌激素早期反应的关键基因。一项研究发现,FOS基因在EMS中显著差异表达[2],其一方面可通过调控基质金属蛋白酶-9(MMP-9)表达参与17β-雌二醇促进的人子宫内膜基质细胞侵袭,另一方面也可能通过诱导雌激素发挥作用,参与EMS的发生、发展。通过对狒狒EMS模型疾病进展中异位子宫内膜的基因表达变化分析发现,FOS是在对照组和6~7个月疾病模型之间存在差异调节的单个基因,且其参与的EGF信号通路和ERK/MAPK信号通路被显著调节[3]。NR3C1基因编码糖皮质激素受体,参与炎症性疾病的病理生理学。已经有研究发现EMS患者血清中皮质醇水平降低,甚至会影响EMS患者受孕[4]。但其在EMS发展过程中的具体作用还不清楚。EGFR编码表皮生长因子受体,在EMS患者的异位病灶、血液、腹腔液中水平明显增高,促进EMS侵袭,转移过程中的血管生成。未来靶向VEGF基因治疗EMS将会是重要方向。ESR2基因编码ERβ,ERβ是EMS症患者的主要雌激素受体。多项研究均已证实ESR2基因多态性会增加患EMS的风险[5],且异位子宫内膜组织ESR2基因表达水平则明显高于正常子宫内膜,ESR2 mRNA水平表达与其甲基化程度相关[6-7]。NCOA1是一种类固醇受体共激活剂,在人类和小鼠异位内膜病变中有选择性地高水平表达,在子宫生物学和病理生物学中起着关键作用,没有NCOA1小鼠子宫内膜无法表现出完整的蜕膜反应。有研究提示,TNF-α-MMP-9-NCOA1异构体信号轴通过阻止TNF-α介导的人类EMS细胞的凋亡来促进EMS的发病进展[8]。有研究提示NCOA1是雌激素的主要辅激活子后,调控异位内膜基质细胞表达基质细胞衍生因子1[9]。而基质细胞衍生因子1是内皮细胞、淋巴细胞和造血祖细胞的增殖和趋化因子,在组织修复、血管生成、侵袭和迁移中发挥重要作用。PTGS2编码前列腺素内过氧化物合酶2,又名环氧合酶2,在各种细胞中可以被炎症因子,有丝分裂原及生长因子诱导,参与炎症反应,细胞增殖和凋亡。在EMS患者异位病灶和腹腔液中,PTGS2水平异常升高[10],且PTGS2抑制剂可以促进EMS子宫内膜细胞凋亡[11],提示PTGS2将来有望成为EMS的治疗靶点。
总之,上述分析可以预测EDCs在EMS中的作用机制与其内分泌干扰性质相关,能够作用于一些基因干扰内分泌信号通路,影响类固醇激素信号转导,可能在EMS发生、发展中起重要作用。EMS是女性生殖系统良性疾病,可能会恶变为卵巢透明细胞癌和子宫内膜癌,如何早期诊断EMS并提前干预、改善预后仍然是临床难题。近年针对基因水平改变的研究逐渐增多,在妇科肿瘤进展中表观遗传学机制已成为一个重要影响因素。随着检测技术的进步,一些表观遗传现象如DNA甲基化、微小RNA的表达和基因沉默、染色质重塑等改变在EMS中被鉴定出来,有望成为EMS新的预测生物标志物和治疗靶点。而通过进一步挖掘环境-基因作用对EMS发病的影响及未来对EMS表观遗传学研究的深入,可能会找到新的靶点并为EMS的预防及早期诊断和靶向治疗提供新的思路。
