医院耐甲氧西林金黄色葡萄球菌感染的风险模型建立及耐药基因检测
2022-05-05宋志伟蔡艳群郏伊范潘晓
宋志伟 蔡艳群 郏伊范 潘晓
金黄色葡萄球菌(Staphylococcus aureus,SA)是医院感染的常见病原菌。与甲氧西林敏感金黄色葡萄球菌(methicillin-sensitive Staphylococcus aureus,MSSA)相比,耐甲氧西林金黄色葡萄球菌(meticillin-resistant Staphylococcus aureus,MRSA)致病力强,治疗困难,对控制医院感染造成极大挑战[1]。MRSA感染患者易引发脓毒症、休克等并发症,一般病情较重,预后较差[2]。2018年CHINET数据显示,我国MRSA检出率高达34.4%,除尿标本中的MRSA对甲氧苄啶-磺胺甲吧恶唑敏感外,MRSA对大多数抗菌药物的耐药率均显著高于MSSA[3]。MRSA呈多重耐药,但目前其耐药机制尚未明确。因此,及时明确并控制MRSA感染的危险因素至关重要。笔者以SA感染患者为研究对象,探讨医院MRSA感染的独立危险因素,建立风险模型,并检测耐药基因,旨在为医院MRSA感染的防控提供参考,现将结果报道如下。
1 对象和方法
1.1 对象 收集2020年6月至2021年6月台州市立医院189例SA感染患者的189份临床标本,分离出SA 189株,其中MRSA 62株,MSSA 127株。纳入标准:(1)住院48 h后发生感染;(2)从感染部位采集的临床标本分离出SA;(3)经微量肉汤稀释法和mecA基因PCR法判断为MRSA或MSSA;(4)患者知情本研究并签署书面同意书。排除标准:仅分离出SA但无感染症状。
1.2 方法
1.2.1 标本收集及菌株鉴定 采集感染患者下呼吸道痰液、静脉血、创口分泌物、引流物、伤口拭子、穿刺液、咽拭子等临床标本。根据《全国临床检验操作规程》[4],采用Vitek-2 compact全自动细菌鉴定仪鉴定细菌。
1.2.2 MRSA鉴定 在33~35℃空气环境下,采用CAMHB培养基,肉汤稀释法接种细菌,孵育16~20 h。以头孢西丁4 μg/ml为判断折点,最低抑菌浓度(minimum inhibitory concentration,MIC)值>4 μg/ml判断为MRSA,否则判断为MSSA。
1.2.3 耐药基因检测 采用PCR法扩增mecA,94℃预变性3 min,50℃退火30 s,72℃延伸45 s,循环35次,72℃延伸5 min,反应结束后产物4℃下保存。扩增四环类(tetM)、氨基糖苷类 aac(6')/aph(2")、氨基糖苷类 aph(3')-Ⅲ、氨基糖苷类ant(4',4")基因方法相同,93℃预变性2 min,93 ℃变形30 s,55 ℃退火 30 s,72 ℃延伸60 s,循环35次。扩增erm基因,93℃预变性2 min,93℃变形1 min,37℃ 退火90 s,72℃ 延伸2 min,循环35次。
1.3 观察指标 (1)对比MRSA与MSSA感染患者临床指标间的差异;(2)分析MRSA感染的独立危险因素,建立风险模型并进行评价;(3)耐药基因检测结果。
1.4 统计学处理 采用SPSS 25.0统计软件。计数资料的比较采用χ2检验或Fisher确切概率法,将单因素分析中差异有统计学意义的自变量纳入多因素logistic回归,分析MRSA感染的独立危险因素,采用似然比检验、Hosmer-Lemeshow拟合优度检验模型拟合效果。P<0.05为差异有统计学意义。
2 结果
2.1 MRSA与MSSA感染患者临床指标的比较 结果发现,年龄、抗生素使用时间、抗生素使用种类、合并心脑血管疾病、合并慢性阻塞性肺疾病、留置胃管、留置尿管、留置引流管、气管切开/插管、机械通气与MRSA感染均有关(均P<0.05),见表1。
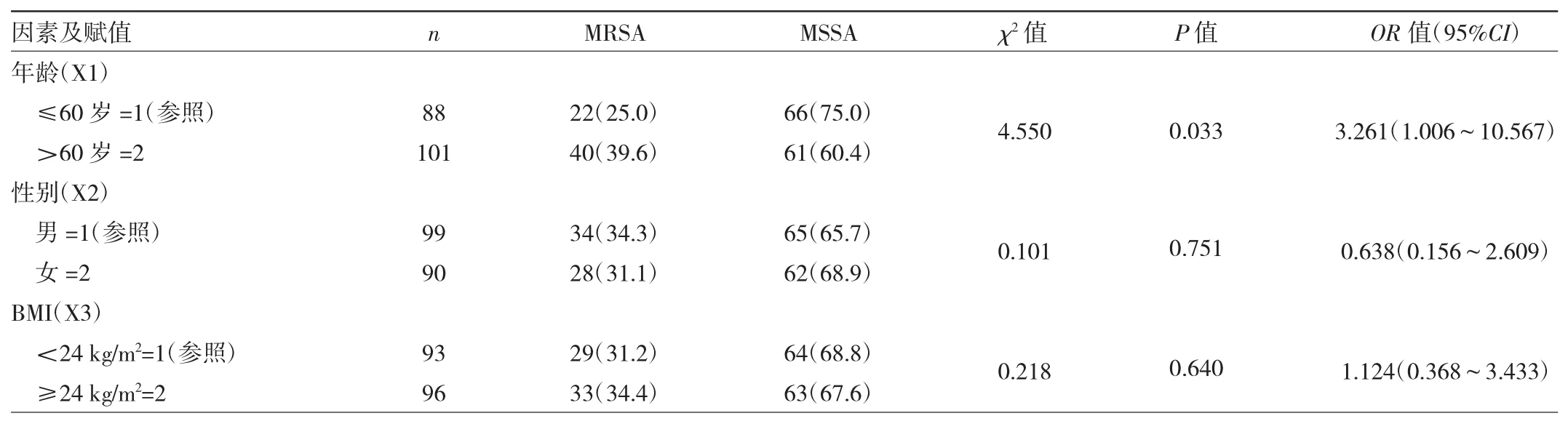
表1 MRSA与MSSA感染患者临床指标的比较[例(%)]
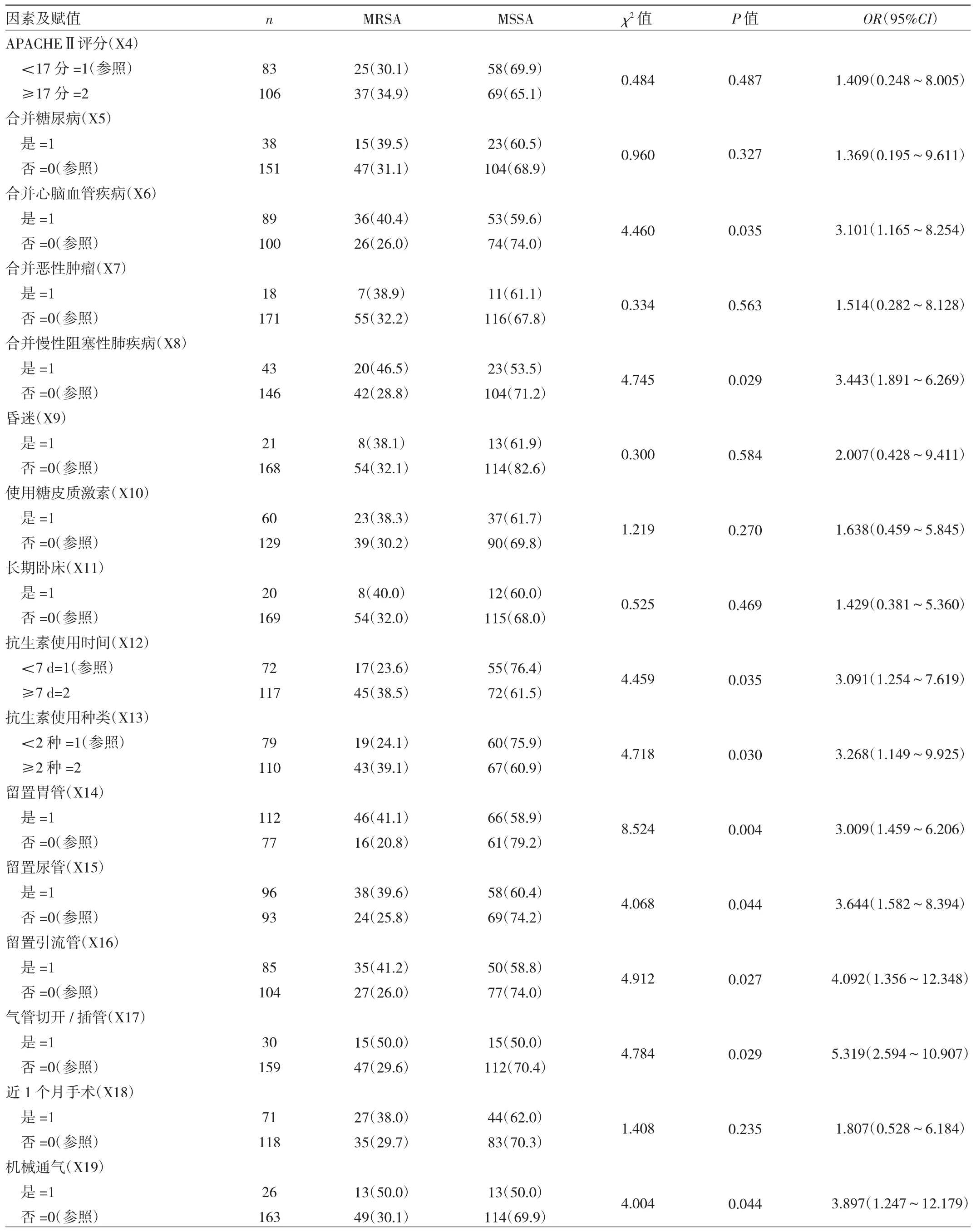
续表1
2.2 MRSA感染的危险因素分析 结果显示,合并慢性阻塞性肺疾病、抗生素使用时间、抗生素使用种类、留置胃管、留置尿管、留置引流管、气管切开/插管、机械通气是MRSA感染的独立危险因素(均P<0.05),见表2。构建logistic回归方程:logit(P)=-23.006+1.057×X8+1.116×X12+1.445×X13+1.143×X14+1.226×X15+1.155×X16+1.322×X17+1.399×X19。
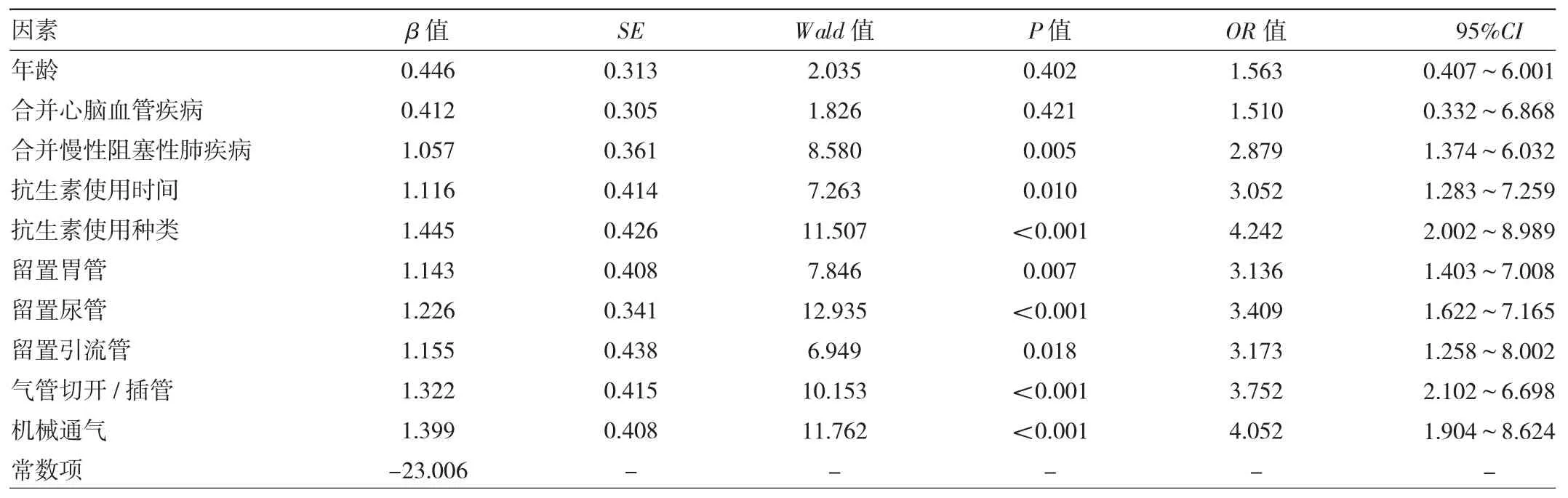
表2 MRSA感染的危险因素分析
2.3 logistic回归模型评价 (1)logistic回归模型总有效性:似然卡方比=398.671,DF=7,P<0.001,表明模型建立有统计学意义。进行Wald检验,Wald值=308.295,DF=2,P<0.001,表明回归方程的系数差异有统计学意义。(2)logistic回归方程的拟合优度检验:经Hosmer-Lemeshow 拟合优度检验显示,χ2=4.001,DF=8,P=0.810,表明该模型拟合度较好。见表3。
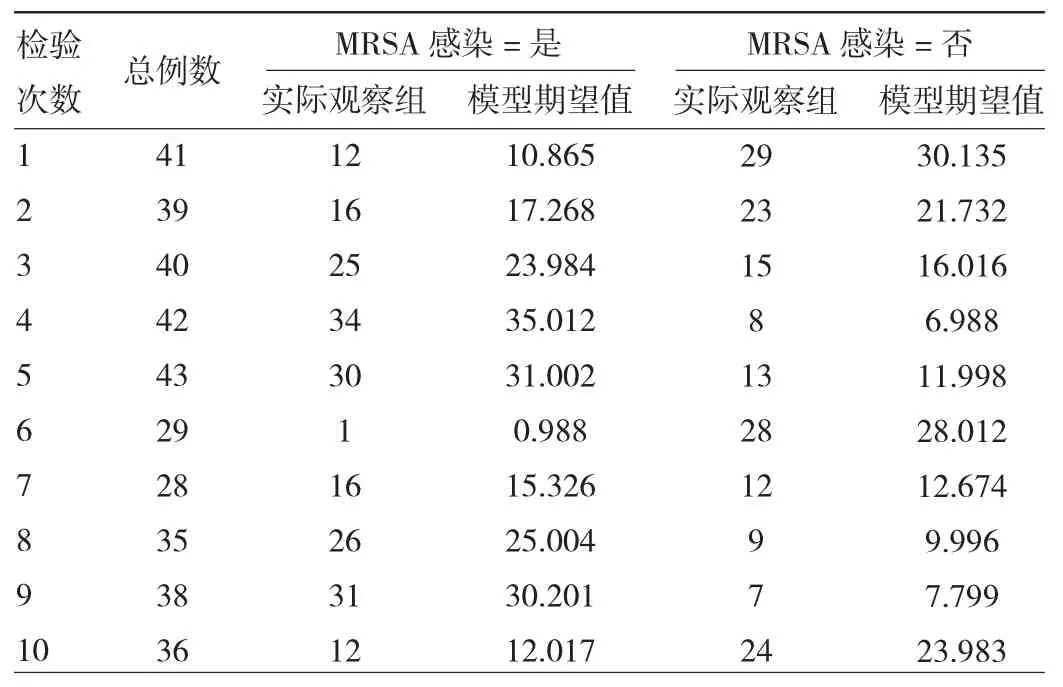
表3 Hosmer-Lemeshow检验的随机性表(例)
2.4 耐药基因检测结果 PCR检测结果显示,MRSA菌株中 tetM、aac(6')/aph(2")、aph(3')-Ⅲ表达高于MSSA菌株(均P<0.05),均未检出ant(4',4")。见表4。
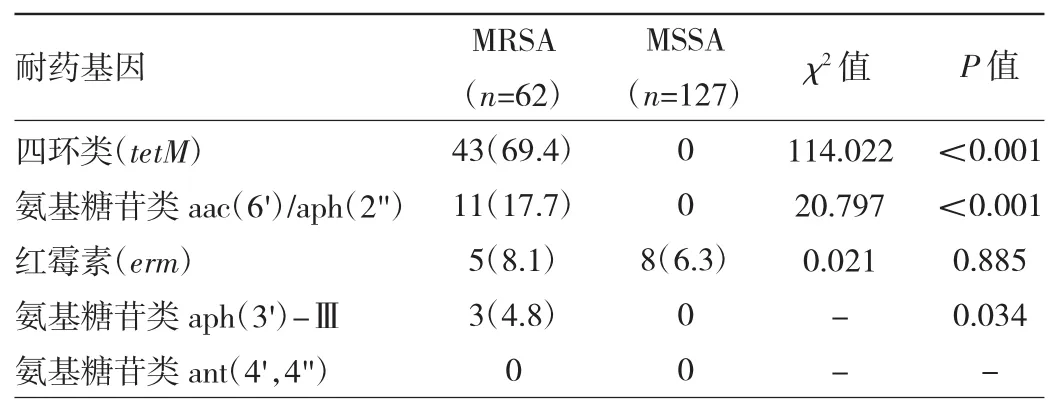
表4 耐药基因检测结果[株(%)]
3 讨论
MRSA感染的危害性已普遍受到临床医生的重视,对其危险因素的研究亦越来越多,但早期的研究多以未感染者作为参照,可能存在与MSSA感染的重叠因素[5]。此外,不同地区MRSA的检出情况及危险因素存在差异,故本研究选取本院SA感染患者为研究对象,以MSSA菌株为阴性对照,分析MRSA感染的危险因素,以探寻更为科学有效的防治方案。
本研究中MRSA检出率为32.8%,与陈小凤[6]32.9%的研究结果相似,但略高于卯建等[7]的调查结果(27.1%),分析可能与患者异质性、地域、医院环境等多种因素有关。经单因素分析发现,年龄>60岁患者MRSA感染率更高,主要是因为老年患者身体器官功能障碍,多存在细胞免疫功能减退,抗感染能力降低等情况[8]。合并心脑血管疾病患者,吞吐、咳痰、打喷嚏等生理活性减弱,难以及时清除痰液、呕吐物等,会增加MRSA的易感性。但以上两种因素未被引入logistic回归方程,说明可能是混杂因素。合并慢性阻塞性肺疾病患者多伴有肺部黏膜损伤,同时机体免疫功能失调,导致MRSA感染风险增加[9]。留置胃管、尿管、引流管及气管切开/插管、机械通气等侵入性操作会导致机体屏障功能遭到破坏,使细菌更易定植、移行,大大增加患者MRSA感染机会,如留置胃管、尿管、引流管均可能使细菌沿管壁上行进入机体引发感染,而气管切开/插管会直接破坏呼吸道黏膜,降低气道纤毛清除能力,细菌黏附于呼吸道,同时随着时间延长,口咽部细菌移行,引发下呼吸道感染;机械通气会破坏气道的解剖结构,导致口腔分泌物沿管道流至下呼吸道,造成感染[10-11]。进一步经多因素分析发现,侵入性操作是医院MRSA感染的独立危险因素,与文献通报结果相符[12]。此外,抗生素使用时间≥7 d、抗生素使用种类≥2种都会增加MRSA感染风险。使用抗生素会杀灭大量敏感的菌株,少数不敏感的菌株存活后会加速突变、增殖,成为优势菌,因此,抗生素使用时间、用法用量不合理或联用可能导致患者体内菌群失调,发生细菌耐药[13]。因此,对于存在感染症状的患者应结合既往用药情况选用抗生素,及时进行病原菌鉴定及耐药性分析,严格落实抗生素分级及联用制度,选取窄谱、敏感的药物治疗,并依照细菌耐药监测报告执行抗生素预警与轮换机制,合理规范使用抗生素。MRSA可改变抗生素作用位点,使机体对多种抗生素产生耐药性。本研究耐药基因检测结果显示,MRSA菌株中四环类(tetM)、氨基糖苷类 aac(6')/aph(2")、氨基糖苷类 aph(3')-Ⅲ表达高于MSSA菌株。结合现有研究分析主要是因耐药基因可帮助MRSA与其他细菌共生并获得外源性DNA的适应性[13],另外MRSA自身基因突变可直接影响其获得外源性基因的能力,而拥有上述特征的MRSA能在复杂人体微生物环境中生存并发生基因交换[14]。上述研究进一步证实MRSA的耐药性更严重,及早防治不容忽视。
综上所述,MRSA耐药严重,治疗困难,及时识别MRSA感染的独立危险因素,如合并慢性阻塞性肺疾病、抗生素使用种类及使用时间、侵入性操作,保护易感人群是控制MRSA感染的关键,同时应加强对患者基础疾病的治疗,谨慎行侵入性操作,侵入性操作过程中需严格无菌操作,避免接触传播,规范使用抗菌药物,减少MRSA的传播及耐药性菌株的产生。
