羧基功能化聚合物-量子点荧光微球探针的制备及其在槲皮素含量检测中的应用
2022-05-05谢采阳王斌珂翟晶晶杨喜张春丽蒲晓辉
谢采阳王斌珂翟晶晶杨喜张春丽蒲晓辉
河南大学 药学院药物研究所,河南 开封475000
槲皮素(Quercetin)广泛存在于蔬菜、水果和茶中[1],具有多种生物活性,如抗炎、抗菌、抗氧化、抗肿瘤和丙酮酸脱氢酶抑制作用等[2-5],常被作为各类中药材的有效成分进行质量控制。槲皮素含量的检测方法有电化学法(DPSV)[6-7]、基质辅助激光解吸电离质谱法(MALDI-MS)[8]和高效液相色谱法(HPLC)[9]等。其中,基于以量子点为荧光探针的荧光分析法具有便捷、快速、成本低等优点,量子点在化学和生物学等方面应用广泛[10]。
荧光量子点(QDs)是一种直径在10 nm 左右的半导体纳米材料,通常由Ⅱ-Ⅵ、Ⅲ-Ⅴ、Ⅳ-Ⅵ族原子构成,如CdSe/ZnS、CdSe、Cd Te、CdS、InP 等[11]。量子点由于其独特的尺寸和可调光学特性引起了人们极大的兴趣[12]。与传统有机染料相比,量子点可以更高效地提供荧光信号,同时具有可精确调控的发射波长、宽激发光谱、窄发射光谱、高量子产率、较大的斯托克斯位移和良好的光稳定性等优点[13-14],被广泛应用于生物检测(如多巴胺、半胱氨酸、阿米卡星等的测定[15-17]和金属离子Cu2+、As3+、Fe3+等的测定[18-20])。此外,量子点也可用于中药有效成分的定量检测。例如,Tan等[21]合成了巯基乙酸修饰的Cd Te量子点检测山柰酚的含量。Zhu等[22]合成了聚合物包覆的双量子点荧光传感器用于检测芥子酸。Chen等[23]合成了基于Cd Te量子点的纸基传感器用于测定茶叶中的左旋茶氨酸。Zhang等[24]以巯基丙酸为稳定剂合成了水溶性Cd Te量子点用于检测苋菜红。已有文献报道了使用量子点作为荧光探针快速、高效检测槲皮素的含量:Sadeghi等[25]合成了双硫腙包覆的ZnS量子点,将其作为荧光探针用于生物样品中槲皮素的测定,检测限为2.50×10-7mol/L。Chen[26]等合成了巯基乙酸修饰的Cd Te量子点测定槲皮素,检测限为1.7×10-7mol/L。然而,这些获得水溶性量子点的制备过程所用试剂较多,须在高温条件下进行,方法较为复杂,量子点荧光探针稳定性有待提高。
本课题通过操作简便的溶剂挥发法,采用两种聚合物PMMA 和PMA-ODE 包裹油溶性CdSe/ZnS量子点,制备了荧光较强、稳定性更好的羧基功能化的聚合物-量子点荧光微球,并基于槲皮素能够猝灭量子点荧光的特性,将荧光微球作为探针对槲皮素进行定量检测,建立了一种定量分析槲皮素的荧光光谱法。该方法检测限可达4.20×10-7mol/L,在灵敏度、精确度以及抗干扰能力方面表现极佳。
1 实验部分
1.1 仪器与试剂
透射电子显微镜(TEM,JEM-2100,日本电子株式会社),用于观测CdSe/ZnS量子点与聚合物-量子点荧光微球的大小和形貌;荧光分光光度计(F-4600,日本株式会社)和紫外-可见分光光度计(UV-2600,日本岛津公司),用于光谱表征;高速分散均质机(FJ-200,上海标本模型厂),用于产生乳化作用。
聚甲基丙烯酸甲酯(PMMA)和聚马来酸酐-1-十八烯交替共聚物(PMA-ODE,Mn=30 000~50 000)购于Sigma-Aldrich 试剂公司;槲皮素(QCT))标准品购于阿拉丁试剂有限公司;十二烷基磺酸钠购于Solarbio试剂公司;浓氨水、盐酸、丙三醇、无水乙醇购于天津市富宇精细化工有限公司;磷酸氢二钠、硝酸银、氯化钙、氢氧化钾、磷酸二氢钾、硼酸、四硼酸钠、柠檬酸等购于天津市科密欧化学试剂有限公司。实验用水为去离子水。
1.2 油溶性CdSe/ZnS量子点和羧基功能化聚合物-量子点荧光微球的制备
油溶性CdSe/ZnS 量子点参考文献[27]合成。羧基功能化聚合物-量子点荧光微球合成方法如下:在2 m L氯仿中加入5 mg油溶性CdSe/ZnS量子点、15 mg PMMA 和10 mg PMA-ODE 超声分散,放置8 h;将40 mg十二烷基磺酸钠溶于5 m L水中;将上述两种溶液混合,用高速分散均质机乳化形成水包油(O/W)乳液体系;搅拌结束后,将溶液转入25 mL 单口圆底烧瓶中封口搅拌1 h,随后挥发氯仿;氯仿挥发完毕后离心除去上清液,加入5 m L水(含有10μL 浓氨水)超声水解,用水洗涤两次离心;最后将产物分散于5 m L水中保存,即得羧基功能化聚合物-量子点荧光微球。
1.3 QCT含量检测
取200μL浓度为4.0 mg/m L的羧基化聚合物-量子点荧光微球、3.0 mL PBS缓冲溶液(p H=7.0)和0.8 m L待测样品于标准试管中,摇匀。室温放置1 h 后用荧光分光光度计检测其荧光强度值F;用0.8 m L去离子水替换待测样品配制空白组,检测其荧光强度值F0,得ΔF;结合槲皮素含量检测的标准曲线,计算样品中槲皮素的含量。
2 结果与讨论
2.1 羧基功能化聚合物-量子点荧光微球的制备及荧光稳定性
羧基功能化聚合物-量子点荧光微球的制备示意图,见图1。先将两种聚合物和CdSe/ZnS量子点分散于氯仿中形成有机相,再配制含有表面活性剂的水溶液备用。混合两相,在高速分散均质机的剧烈搅拌下可形成水包油(O/W)乳液体系;通过搅拌缓慢挥发有机溶剂,即可制备出聚合物包裹的量子点荧光微球;将聚合物-量子点荧光微球置于碱性环境中(加入微量氨水),使聚合物中马来酸酐环水解,最终可制备出羧基功能化的聚合物-量子点荧光微球。
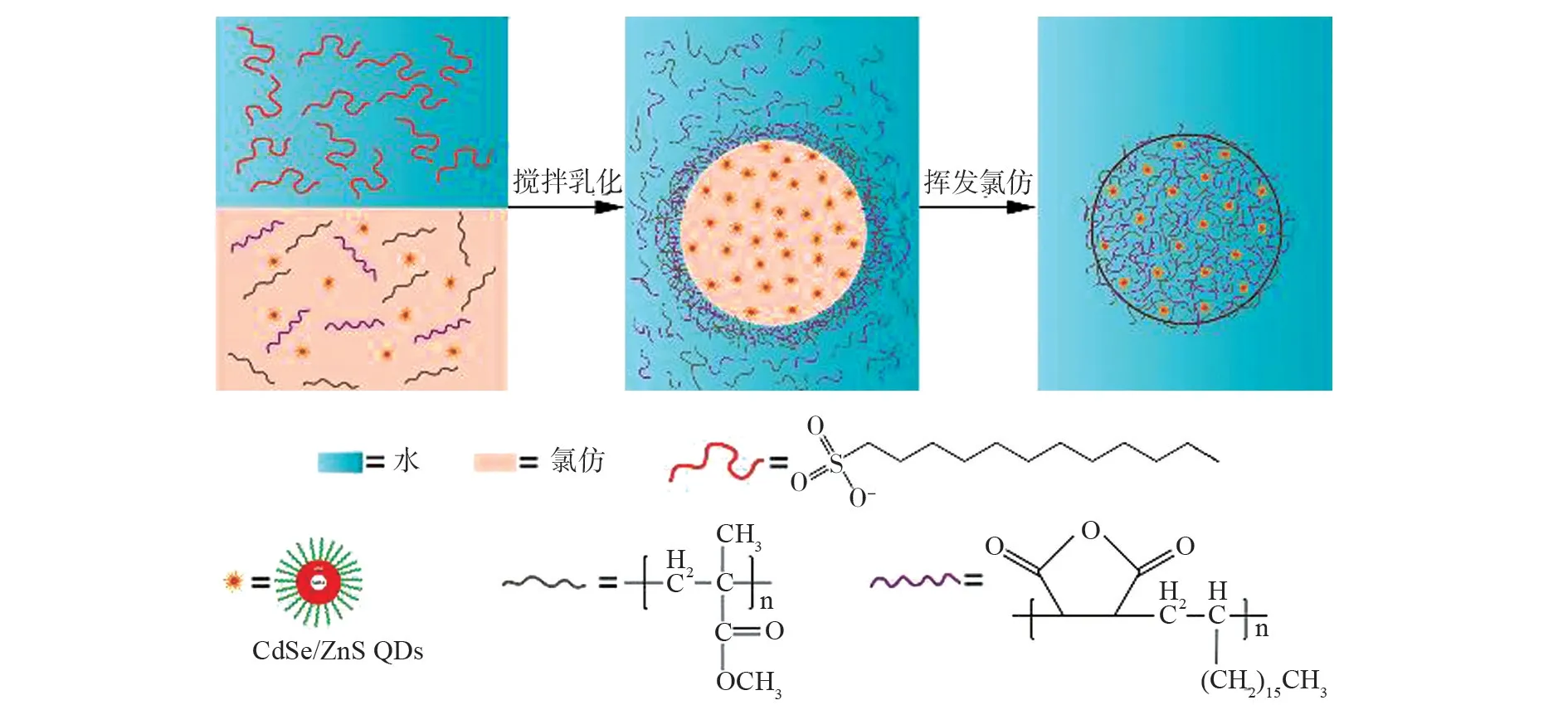
图1 羧基功能化聚合物-量子点荧光微球的制备示意图
CdSe/ZnS 量子点的TEM,见图2A。CdSe/ZnS量子点分散均匀,平均粒径约为9 nm。羧基功能化聚合物-量子点荧光微球的TEM,见图2B。粒径约为400 nm,微球中包裹着大量的CdSe/ZnS量子点。
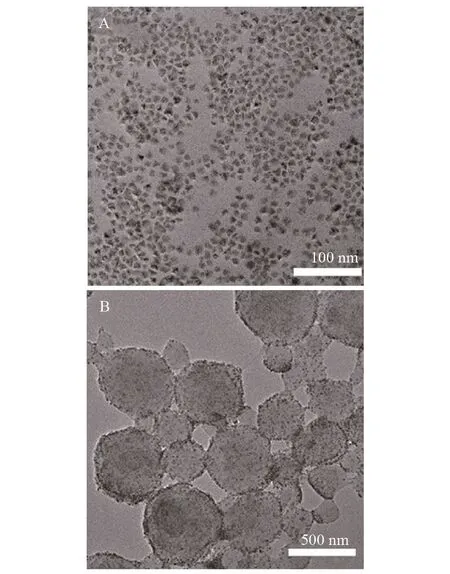
图2 CdSe/ZnS量子点(A)和聚合物-量子点荧光微球(B)的TEM 图
羧基功能化聚合物-量子点荧光微球及CdSe/ZnS量子点的荧光光谱,见图3A。可看出荧光峰均出现在615 nm 处且峰形对称,CdSe/ZnS 量子点(溶于正己烷)的荧光峰相较于羧基功能化聚合物-量子点微球的荧光峰,位置没有改变,且半峰全宽(FWHM)较窄,仅有39 nm。量子点被聚合物包裹后荧光强度仅降低了3%。羧基功能化聚合物-量A 中插图为聚合物-荧光量子点微球水溶液在日光(左)和紫外光(365 nm)(右)激发下的图片。子点微球水溶液在日光和紫外光(365 nm)激发下的图片见图3A,荧光微球水溶液在紫外灯照射下发出明亮的红色光。如图3B 所示,在p H=7的PBS溶液中,羧基功能化聚合物-量子点荧光微球放置100 d后其荧光强度基本不变,始终维持在较高水平,此稳定性为后续的生物检测提供了保证。
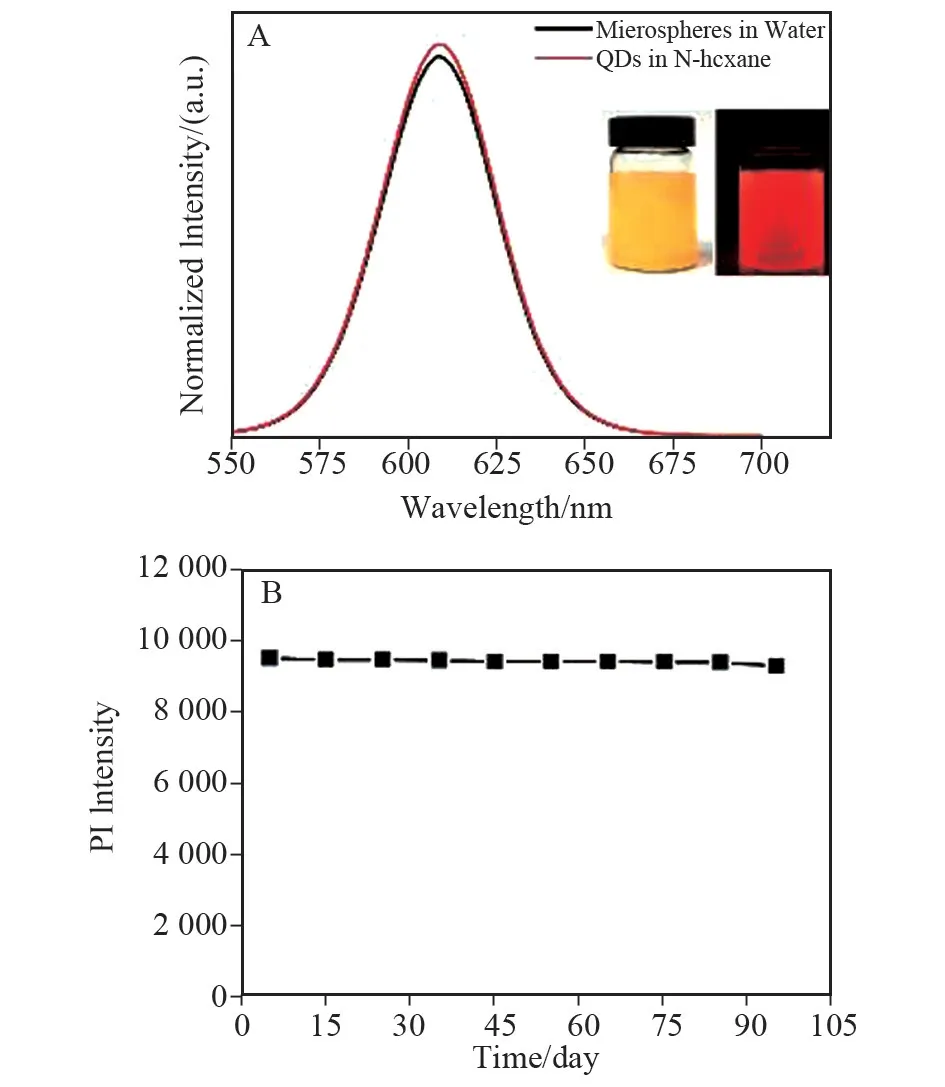
图3 CdSe/ZnS量子点及聚合物-量子点荧光微球的荧光光谱图(A)、聚合物-荧光量子点微球的荧光稳定性测试(B)
2.2 羧基功能化聚合物-量子点荧光微球荧光猝灭机理
荧光猝灭机理主要分为动态猝灭和静态猝灭两种类型[28]。在静态猝灭中,猝灭剂与荧光物质之间形成无荧光的络合物;在动态猝灭过程中,猝灭剂与激发态的荧光物质发生碰撞,阻止激发态电子与表面空穴的复合,从而导致荧光猝灭。由对槲皮素和聚合物-量子点荧光微球进行的紫外-可见吸收光谱和荧光发射光谱表征结果见图4A。槲皮素在255 nm 和372 nm 有两个吸收峰,而聚合物-量子点荧光微球的发射波长出现在615 nm 处,二者的吸收峰与发射峰没有重叠,此结果排除了由荧光内滤效应导致的荧光猝灭。
槲皮素在200~400 nm 之间出现两个吸收峰。加入聚合物-量子点微球后,槲皮素吸收峰位置没有改变,吸光度值相当于聚合物微球与QCT 吸光度值的简单叠加,见图4B。在图4C中,聚合物-量子点荧光微球在615 nm 处出现荧光峰,槲皮素在530 nm 处有一个微弱的荧光峰,聚合物-量子点荧光微球-槲皮素体系在615 nm 处的荧光峰强度改变位置无变化,其在530 nm 处的峰强度及位置皆无变化,且没有出现新的峰。由此可知,在聚合物-量子点荧光微球-槲皮素体系中无新产物生成,说明槲皮素猝灭聚合物-量子点荧光微球荧光的机理非静态猝灭。
进一步用Stern-Volmer区分荧光猝灭机理的类型,结果见图4D。由F0/F=1+KSV〔Q〕和分子猝灭方程KSV=Kq·τ0计算得,Kq(猝灭速率常数)的最大值为6.00×106L·mol-1·s-1,远小于各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数(2.00×1010L·mol-1·s-1),证明槲皮素猝灭聚合物-量子点微球荧光的原理为动态猝灭。
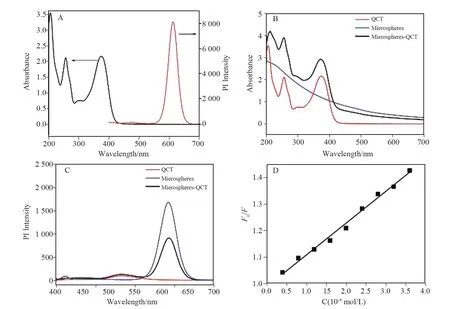
图4 槲皮素紫外-可见吸收光谱(左)与聚合物-量子点微球荧光发射光谱(右)(A),聚合物-量子点荧光微球-槲皮素体系(Microspheres-QCT)、聚合物-量子点荧光微球(Microspheres)与槲皮素(QCT)的紫外-可见吸收光谱(B)与相关的荧光发射光谱(C),槲皮素浓度变化的Stern-Volmer曲线(D)
综上所述,槲皮素作为电子受体可以猝灭荧光,是由于槲皮素吸收了导带激发态电子,从而阻碍被激发电子从导带到价带,最终表现为荧光猝灭。在聚合物-量子点微球荧光动态猝灭过程中,荧光微球的激发态电子被槲皮素吸收,致使聚合物-量子点荧光微球的荧光发生衰减,半导体的能带理论和前人的报道为这一结论提供了有力的科学依据[29]。
2.3 检测条件的优化
2.3.1 聚合物-量子点荧光微球浓度
对检测体系荧光微球的最佳浓度进行探究,浓度梯度分别为1、2、3、4、5 和6 mg/m L,结果见图5A。当浓度小于4 mg/mL 时,体系荧光强度随荧光微球浓度的增大而增大;浓度超过4 mg/mL 时,荧光强度快速下降,是由于荧光微球浓度过大发生荧光自猝灭,导致荧光强度不增反降。聚合物-量子点荧光微球加入量过低,会使荧光强度弱,标准曲线线性范围狭窄,不利于绘制精准的标准曲线;荧光微球加入量太大,则会导致上述荧光自猝灭现象[30],使得检测工作失败。综合考虑,选择4 mg/m L作为QCT 检测的最佳聚合物-量子点荧光微球浓度。

图5 聚合物-量子点荧光微球浓度(A)和待测样品pH(B)对聚合物-量子点荧光微球-槲皮素体系荧光强度的影响
2.3.2 检测体系pH值
作溶液环境的酸碱度不仅影响聚合物-量子点荧光微球的荧光强度,也会对荧光光谱法的灵敏度产生不可忽略的影响。槲皮素为五羟基黄酮,众多的羟基使其呈弱酸性,碱性环境会破坏槲皮素的结构,使其荧光猝灭能力降低。因此,理论上检测环境应为非碱性环境。由图5B 可知,偏酸或偏碱的环境均不利于QCT 的检测,在pH 值为7时荧光猝灭程度最大。因此,选择p H=7作为后续检测实验的环境酸碱度。
2.3.3 待测样品中缓冲液
为选出检测体系适合的缓冲溶液,选用硼酸盐缓冲液(a,BBS),柠檬酸盐缓冲液(b,CPBS),Tris-HCl缓冲液(c,Tris-HCl)和磷酸盐缓冲液(d,PBS),对比了四种缓冲液对聚合物-量子点荧光微球-槲皮素体系荧光猝灭效果的影响。从图6中可以观察到在相同浓度及pH 值的情况下,聚合物-量子点荧光微球-槲皮素体系在磷酸盐缓冲液中荧光猝灭程度最大。综合考虑,PBS为最适的缓冲溶液。
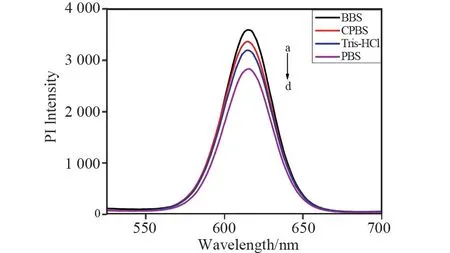
图6 聚合物-量子点荧光微球-槲皮素体系在硼酸盐缓冲液和磷酸盐缓冲液中的荧光发射光谱
2.3.4 检测体系处理温度及时间
处理温度对聚合物-荧光量子点微球-槲皮素体系的荧光强度的影响见图7A。在20~70 ℃之间,随着温度的升高荧光强度不断降低;在20~30 ℃之间,待测样品能保持较高的荧光水平。因此,在室温下处理待测样品即可。此外,处理时间过短荧光未达到最大猝灭值会导致QCT 检测浓度小于实际浓度。待测样品配制完成后的前20 min荧光强度迅速减小,随后持续降低,在1 h时荧光强度保持稳定,见图7B。综上,分别选择25 ℃和1 h为待测样品检测体系的最佳处理温度和时间。
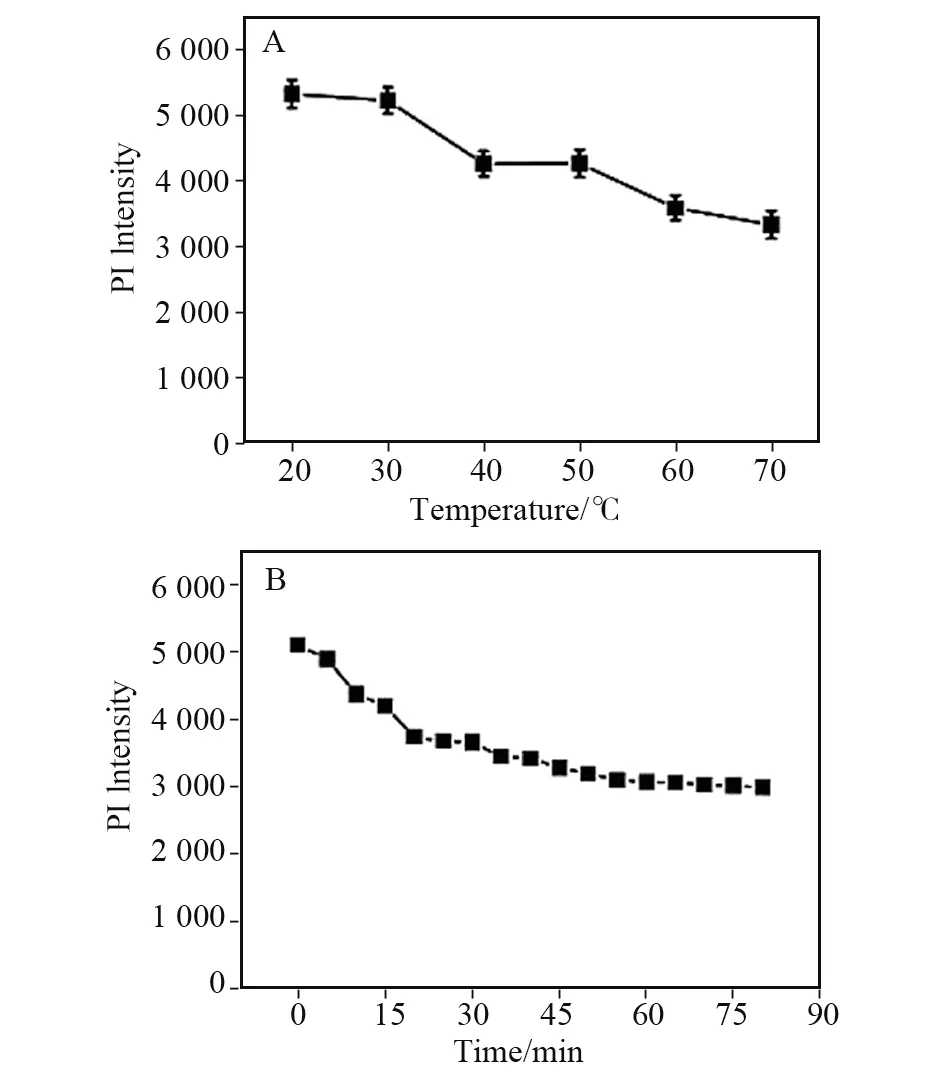
图7 处理温度(A)和处理时间(B)对聚合物-量子点微球-槲皮素体系荧光强度的影响
2.4 槲皮素检测标准曲线和检测限
在上述最优条件下,测定了一系列不同槲皮素浓度下聚合物-量子点荧光微球-槲皮素体系的荧光强度。随着QCT 浓度的增大,荧光猝灭的作用逐渐增强,荧光强度呈有规律的减弱,见图8。经拟合得回归方程ΔF=(F0-F)=665.89C+47.69(浓度单位:10-5mol/L)。相关系数R2=0.989 6,在0.40~3.60×10-5mol/L 之间呈现良好的线性关系。根据检测限(LOD)=3 SD/K(SD 为对照组的标准偏差,K为标准曲线的斜率),经计算,该方法的检测限为4.20×10-7mol/L。
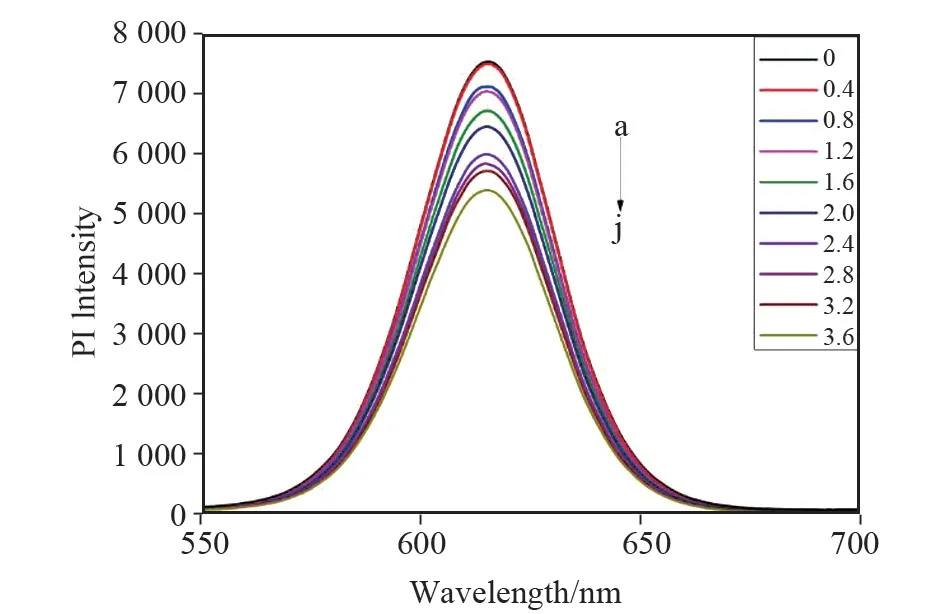
图8 不同槲皮素浓度下聚合物-量子点荧光微球-槲皮素体系的荧光光谱图
2.5 干扰组分的影响
在实际检测中,样品中时常存在多种干扰物质,从而影响检测结果,故需考察常见金属离子、酸根离子、常见阴离子及常规药用辅料等对该检测方法灵敏度的影响。结果见表1,葡萄糖、三乙醇胺和Na+、Mg2+、Al3+等金属离子对检测影响较小。
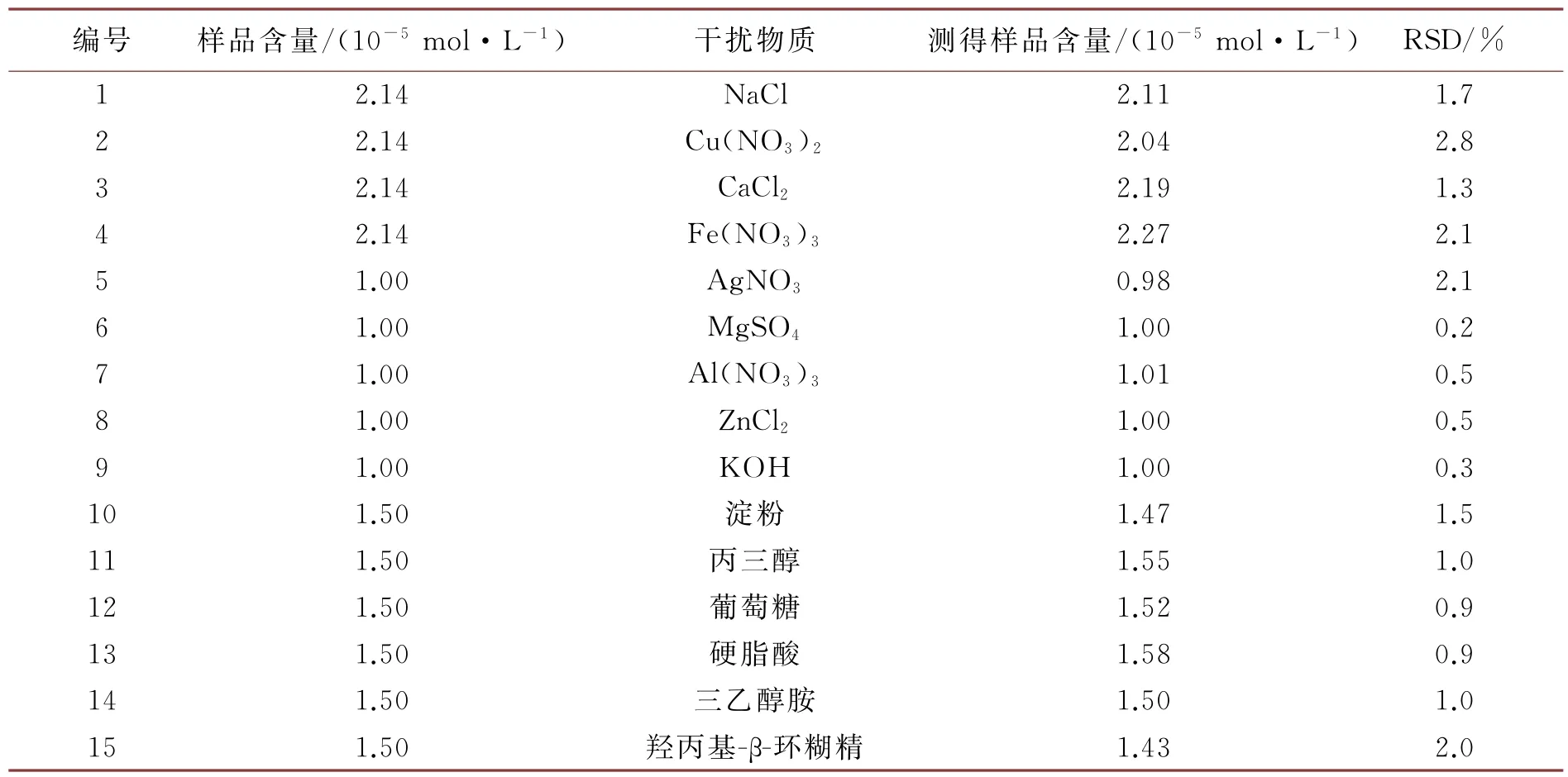
表1 样品含量测定(n=6)
2.6 精密度和重复性
在最佳检测条件下,对一个浓度为1.000×10-4mol/L的QCT 标准液进行6 次测试,经计算得平均浓度为1.027×10-4mol/L,相对标准偏差(RSD)仅为1.02%,表明采用的荧光光谱法精密度较高。随后,对平行的六个浓度为1.000×10-5mol/L 的QCT 标准液进行单次测试,经计算得平均浓度为1.029×10-5mol/L,相对标准偏差(RSD)为2.68%,表明采用的荧光光谱法重复性较好。
2.7 回收率测定
在最佳条件下,用不同浓度的样品考察了该方法的准确度,结果见表2。加标回收率在99.9%~106.4%之间,且RSD 小于3%,说明以聚合物-量子点荧光微球为探针的荧光光谱法用于QCT 检测可行。
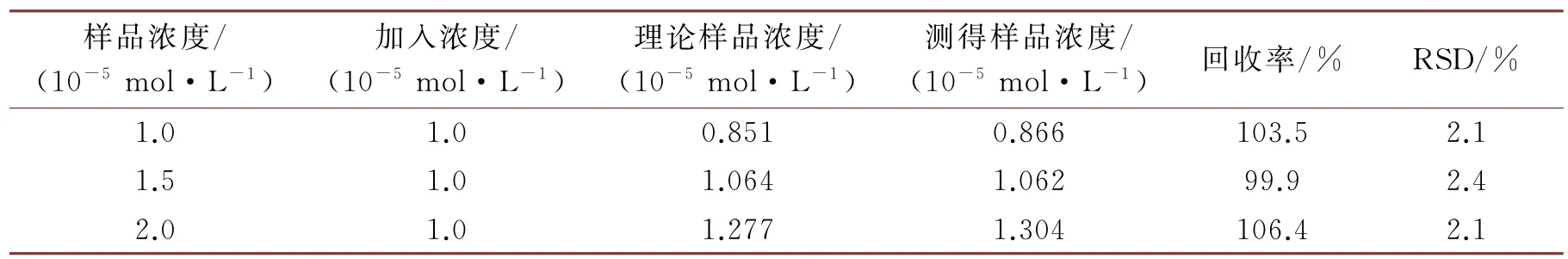
表2 加标回收率实验(n=6)
3 结论
本实验通过简单的溶剂挥发法,成功合成了水溶性的羧基功能化聚合物-量子点荧光微球。所制备的荧光微球具有较高的荧光强度和良好的荧光稳定性。基于槲皮素对量子点的荧光猝灭现象,本文建立了一种简便、高效测定槲皮素含量的荧光分析方法。该方法具有较好的精密度、重复性和高回收率,检测限可达4.20×10-7mol/L。一些常见金属阳离子、葡萄糖以及氨基酸对槲皮素含量测定的干扰较小,可用于槲皮素含量的测定。
