不同产地杭白菊中绿原酸、木樨草苷、异绿原酸含量分析
2022-05-05牛广东
牛广东
联勤保障部队第九八八医院 开封院区,河南 开封,475004
菊花为菊科植物菊(Chrysanthemum morifoliumRamat.)的干燥头状花序,主产于安徽歙县、屯溪、滁州、亳州,浙江桐乡,江苏射阳,湖北麻城,山东嘉祥,河南武陟,河北安国等7个省10个县(市)[1]。菊花的传统加工炮制方式有蒸制、炒制、酿制、酒制、浆制、阴干、烘干,现代一般采用的加工方式是烘房干燥、热风干燥等[2]。按产地及加工方式的不同,菊花可分为“亳菊”“滁菊”“贡菊”“杭菊”和“怀菊”五大品种。杭菊经产区长期栽培,分化为杭白菊和杭黄菊两种类型。杭白菊产量大,有较强的保健养生功效;杭黄菊近年来种植很少[3-4]。杭菊道地产地浙江桐乡主要栽培的杭菊为杭白菊,共有三个品种:湖菊(D.morifolium“Huju”),小白菊(D.morifolium“Xiaobaiju”),大白菊(D.morifolium“Dabaiju”)。小白菊的栽培最多,又被称为“小洋菊”。
菊花始载于《神农本草经》:“味苦平,主诸风头眩,肿痛目欲脱泪出,皮肤死肌,恶风湿痹,久服利血气,轻身耐老延年”。现代研究表明菊花中的活性成分包括黄酮、挥发油、多糖、有机酸、三萜等[5-7]。本文以绿原酸、异绿原酸、木樨草苷为指标,采用高效液相色谱方法对市场上购买的10批杭白菊药材进行检验。
1 仪器、试剂与材料
1.1 仪器及试剂
高效液相色谱系统(LC-20AT 液相色谱输液泵、CTO-10AS柱温箱、SPD-20A 紫外检测器、LCSolution色谱数据处理系统,日本岛津),AB135-S电子分析天平(梅特勒-托利多仪器有限公司,瑞士),KQ-500DB超声波清洗仪(昆山市超声仪器有限公司)。绿原酸(批号18071907,成都普菲德生物技术有限公司),木樨草苷(批号:19070302,成都普菲德生物技术有限公司),异绿原酸(批号:18121001,成都普菲德生物技术有限公司),色谱纯乙腈、甲醇、磷酸均为分析纯。
1.2 样品
菊花1号(产地:浙江桐乡,批号:200102,浙江良一药业股份有限公司),菊花2号(产地:浙江,批号:20200108,泌阳县玉坡农业专业合作社),菊花3号(产地:浙江,批号:190304010,湖南省博世廉中医药有限公司),菊花4号(产地:浙江,批号:A200203,湖北金贵中药饮片有限公司),菊花5号(产地:浙江,批号:191250481,康美药业股份有限公司),菊花6号(产地:浙江,批号:A200411,湖北金贵中药饮片有限公司),菊花7号(产地:浙江,批号:A190507,湖北金贵中药饮片有限公司),菊花8号(产地:浙江,批号:200202,亳州市张仲景中药饮片有限责任公司),菊花9 号(产地:安徽黄山,批号:190601),菊花10号(产地:亳州中强,批号:180701)。
2 方法
2.1 供试品溶液的制备
取菊花粉末(过一号筛)约0.25 g,精密称定,置具塞锥形瓶中;精密加入70%(v/v)甲醇25 m L,密塞,称定重量;超声处理(功率300 W,频率45 k Hz)40 min,放冷,再称定重量;用70%(v/v)甲醇补足减失的重量,摇匀,滤过,取续滤液。
2.2 对照品溶液的制备
精密称取绿原酸、木樨草苷、异绿原酸对照品适量,用70%(v/v)甲醇制成绿原酸浓度为32 mg/L、木樨草苷浓度为25 mg/L、异绿原酸浓度为84 mg/L的对照品混合溶液。
2.3 色谱条件
采用Merk Purosher RP-18 e(4.6 mm×250 mm,5μm)测定方法,流动相A 为乙腈,流相B 为0.2%(m/m)磷酸水溶液。梯度洗脱:0~10 min A为10%~15%;10~40 min A 为15%~25%;40~60 min A 为25%。流速0.8 m L/min,检测波长348 nm,柱温30 ℃,进样量10μL,理论塔板数不低于8 000。
2.4 含量测定
取菊花1号到10号样品,分别按第2.1节中方法制备供试品溶液,按第2.3节中所记录的色谱条件进行测定。
3 结果与分析
3.1 线性关系考察
精密吸取第2.2 节中对照品溶液0.5、1、2、3、5、10、15μL 注入高效液相色谱仪,根据第2.3节中所记录的色谱条件测定,记录各色谱峰峰面积,以绿原酸、木樨草苷、异绿原酸进样量(μg)为横坐标(X)、峰面积为纵坐标(Y),绘制标准曲线,计算回归方程(见表1)。结果显示:绿原酸在0.016~0.48μg范围内,峰面积和浓度有良好的线性关系;木樨草苷在0.012 5~0.375μg范围内,峰面积和浓度有良好的线性关系;异绿原酸在0.042~1.26μg范围内,峰面积和浓度有良好的线性关系。

表1 线性关系考察结果
3.2 精密度试验
取第2.2节中混合对照品溶液,精密吸取,注入高效液相色谱仪中,连续进样6次;按第2.3节中所记录的色谱条件测定,记录各色谱峰峰面积。计算得:绿原酸峰面积的RSD=0.2%,木樨草苷峰面积的RSD=0.5%,异绿原酸峰面积的RSD=0.9%。可知,实验所用仪器的精密度较好。
3.3 重复性试验
精密称取同一批菊花粉末供试品,按第2.1节中方式制备6份供试品溶液,按第2.3节中所记录的色谱条件测定,记录各色谱峰峰面积。计算得:绿原酸含量的RSD=0.2%,木樨草苷含量的RSD=0.3%,异绿原酸含量的RSD=0.2%。可知,该方法的重复性较好。
3.4 稳定性试验
精密吸取第2.1节中同一供试品溶液,依次在0、2、6、12、18、24 h时向高效液相色谱仪中进样;按第2.3节中所记录的色谱条件测定,记录各色谱峰峰面积。计算得:绿原酸峰面积的RSD=1.2%,木樨草苷峰面积的RSD=1.7%,异绿原酸峰面积的RSD=0.4%。可知,供试品溶液在24 h内稳定性良好。
3.5 加样回收率试验
采用加样回收法,精密称取已知含量的同一供试品6份,分别精密加入混合对照溶液适量,精密吸取10μg,向高效液相色谱仪中进样,按“2.3”中所记录的色谱条件测定,记录各色谱峰峰面积,计算绿原酸、木樨草苷、异绿原酸的平均加样回收率,绿原酸的平均加样回收率为99%、木樨草苷的平均加样回收率为99%、异绿原酸的平均加样回收率为99%,RSD 绿原酸为2.6%,RSD 木樨草苷为1.7%,RSD异绿原酸为1.2%,均在允许范围内,此方法准确度良好,结果见表2。
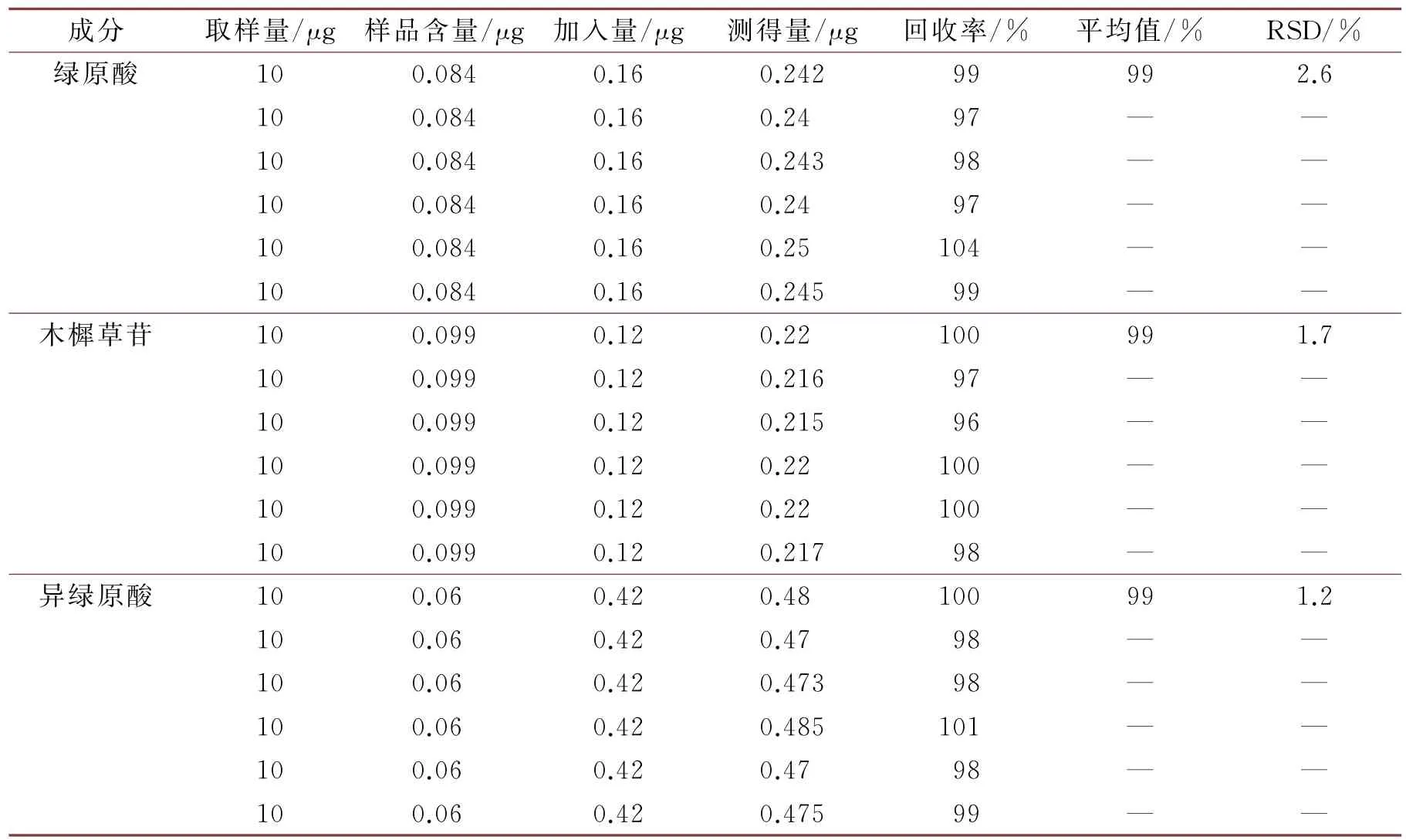
表2 加样回收率试验结果
3.6 含量测定
取市售10批菊花样品,分别按第2.1节中方法制备供试品溶液,精密吸取,注入高效液相色谱仪;按第2.3节中所记录的色谱条件测定。结果见表3。
从表3可看出,10批菊花药材中活性成分绿原酸的平均含量为0.29%、木樨草苷的平均含量为0.53%、异绿原酸的平均含量为1.37%。《中国药典》2020版一部中[8]要求,菊花中所含绿原酸含量不得少于0.2%、木樨草苷含量不得少于0.080%、异绿原酸含量不得少于0.70%。市售的10批杭白菊药材中,大多数菊花的绿原酸含量在0.2%~0.3%左右,8号和10号样品中的绿原酸含量最高,分别为0.42%和0.45%;9号样品的绿原酸含量最低,为0.18%,未达到《中国药典》2020 版一部的要求,可判定为不合格药材。木樨草苷的含量大多在0.25%~0.35%左右,10 号样品中木樨草苷的含量最高(2.6%);异绿原酸含量大多在0.8%~1.5%左右,8号和10 号样品中的异绿原酸含量最高,分别为2.26%和2.6%,2号和3号样品的异绿原酸含量最低,分别为0.82%和0.83%。综上可看出:10批菊花中,除9号样品外,其余厂家的菊花药材中绿原酸、木樨草苷和异绿原酸均达到了《中国药典》2020年版的要求。其中以亳州中强的10号样品质量最好,其次是浙江的8号样品,其他样品质量相近。
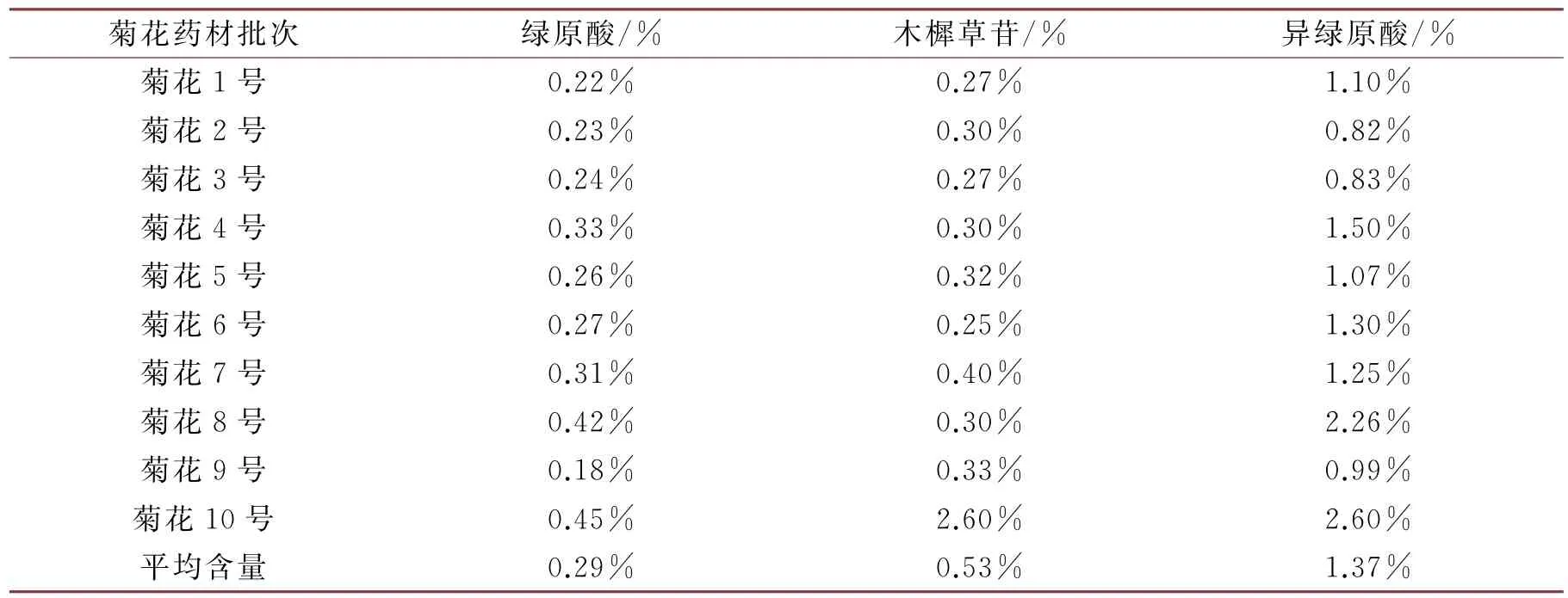
表3 含量测定结果
4 讨论
不同柱温、不同检测波长对实验结果的影响较大,本实验在20~40℃柱温之间根据分离效果选择了30 ℃柱温为色谱条件;在200~400 nm 检测波长之间根据色谱峰大小,选择了348 nm 检测波长为色谱条件,实际实验过程中,发现目标峰与杂质峰分离度不符合要求,所以调整流动相的组成和洗脱程序,确定乙腈-0.2%磷酸水溶液流动相。
