TCIRG1基因突变致婴儿恶性型骨硬化症的临床表现及家系分析*
2022-05-05尚丽娜张欢欢蒋益毛旭华
尚丽娜,张欢欢,蒋益,毛旭华
(1.宁夏吴忠市人民医院儿科,宁夏吴忠 751100;2.江苏大学附属宜兴医院a.儿科,b.检验科,江苏无锡 214200)
骨硬化症(osteopetrosis)又称石骨症、大理石骨病等,是一种罕见的全身性骨结构发育异常的恶性遗传病,发病率约为1/250 000[1]。破骨细胞功能异常或破骨细胞缺失是骨硬化症的主要诱因。由多种蛋白质聚合而成的液泡ATP酶(vacuolar ATP,V-ATP)在破骨细胞中发挥重要作用,该酶具有以下功能:催化ATP水解和传递质子,以及稳定细胞内外pH值。在目前已发现的十余种与骨硬化症相关的突变基因中以TCIRG1基因突变较为常见[2]。当TCIRG1基因发生突变时,其编码的a3亚单元蛋白质功能出现异常,V-ATP 酶无法为破骨细胞的骨吸收功能提供酸性微环境[3]。本研究拟调查一骨硬化症家系的基因型,利用外显子组高通量测序技术确定患儿遗传学病因,提高临床医师对恶性骨硬化症遗传病的认识,以期指导孕妇的产前诊断,提升优生优育水平。
1 对象与方法
1.1病历资料 患儿男性,年龄8个月,主因“发热2 d,伴呻吟、气促半天”于2021年3月入住宁夏吴忠市人民医院普儿科,反复发热,热峰达38.9 ℃、呼吸50~60次/分。门诊血常规示:白细胞 20.16×109/L,红细胞 3.92×1012/L,血红蛋白101 g/L,血小板74×109/L,中性粒细胞百分比25%、淋巴细胞百分比65%。体格检查示:前额突出,前囟膨隆,口唇发绀,双肺呼吸音粗,可闻及细湿性啰音,鼻翼煽动,三凹征阳性。腹部膨隆,肋右肋下4 cm,质韧,脾脏肿大,左侧肋下5 cm,质韧。实验室检查示: C反应蛋白(CRP)14.8 mg/L;降钙素原1.620 ng/mL(增高);血清钙1.75 μmol/L(减低)。痰培养示:大肠埃希菌阳性,金黄色葡萄球菌阳性。药敏结果示:阿莫西林克拉维酸钾、头孢噻肟、头孢他啶、头孢曲松、万古霉素、头孢噻肟钠等敏感。影像学胸腹X片示:肋骨、锁骨、脊椎骨密度增高;两肺纹理增粗紊乱,心脏影增大、心胸比例0.6。心脏彩超示:无异常。腹部彩超示:肝脏大、脾大。目前生长发育落后,至1岁2个月仍不能独立坐、爬、行走。根据患儿临床特点、影像学检查,诊断为骨硬化症,但患儿父母未表现出骨硬化症状。患儿在院期间经过鼻导管吸氧,监测血氧饱和度、头孢噻肟钠抗感染、乙酰半胱氨酸稀释痰液雾化吸入等治疗5 d,复查血常规示:白细胞14.1×109/L,红细胞 3.5×1012/L,血红蛋白98 g/L,血小板70×109/L,降钙素原0.7 ng/mL,体温下降咳嗽症状好转,炎症指标下降,家长签字后出院。
1.2方法
1.2.1主要仪器及试剂 GenEluteTM血液基因组DNA提取试剂盒(美国Sigma公司),PCR扩增试剂Phanta Max Super-Fidelity DNA聚合酶(南京诺唯赞公司),DNA胶回收试剂盒(美国Axygen公司),测序试剂盒ABI BigDye Terminator v3.1(美国ABI公司)。NanoDrop微量紫外分光光度计、PCR扩增仪(美国Thermo Science公司),核酸电泳仪(美国Bio-Rad公司),ABI 3730XL全自动测序仪(美国ABI公司)。
1.2.2样本收集及DNA抽提 在患儿就诊时用含肝素钠抗凝剂的真空采血管对患儿及其双亲外周血样本进行采集,采血样体积为3~5 mL。样本立即置于-80 ℃保存。按照GenEluteTM血液基因组DNA试剂盒说明书进行DNA提取,采用NanoDrop微量紫外分光光度计对提取的DNA进行定量和纯度检测,取吸光度(A260 nm/A280 nm)值为1.7~1.8的样本用于后续实验,置于-20 ℃保存。
1.2.3突变位点检测 全外显子检测由北京贝瑞和康生物技术公司完成,采用高通量测序技术筛查医学上与外显子异常相关的5 000种疾病。利用该公司自主研发的“Verita Trekker”变异位点检测系统和“Enliven”变异位点注释解读系统对数据进行分析,按照遗传模式、发病年龄、人群频率、危害预测等指标对数据进行过滤,选择与表型相关且致病可能性较高的位点进行后续研究。根据美国医学遗传学与基因组学学会(ACMG)指南[4]及ClinGen序列变异解释(sequence variant interpretation,SVI)专家组对指南标准的应用建议[5-7]对突变位点分析。
1.2.4Sanger测序验证突变位点 Sanger测序进一步验证患者及其父母基因组中致病位点,引物序列使用 Primer Premier 6.0软件设计,并由苏州金唯智公司合成。序列覆盖TCIRG1基因(NC_000011.10)第5号外显子及其侧翼序列(TCIRG1上游引物序列:5′-CTCCCACCCAGGCAGGAGACT-3′,下游引物序列:5′-GCTCAGCCTGGCCCAGCCCAG-3′)。使用Phanta Max Super-Fidelity DNA聚合酶对目标区域进行PCR扩增。PCR扩增体系为50 μL,包括:2×PCR mix 25 μL,10 μmol/L上、下游引物各2 μL,dNTP 2 μL,DNA模板1 μL,高保真酶1 μL,ddH2O 17 μL。PCR循环参数:95 ℃ 5 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 15 s;共35个循环;72 ℃ 5 min。PCR产物经20 g/L琼脂糖凝胶电泳后使用 PCR纯化试剂盒对产物进行纯化,后利用 ABI BigDye Terminator v3.1试剂盒构建测序反应,使用ABI 3730XL全自动测序仪进行测序验证。
2 结果
2.1先证者及其父母TCIRG1基因突变检测结果 全外显子组测序结果发现,患儿基因TCIRG1(NM_006019.4)在外显子5位处存在c.493_494dup变异,且为纯合型,即在基因序列493和494位核苷酸序列C和T发生了重复性插入(图1),而患儿父母为杂合型突变。
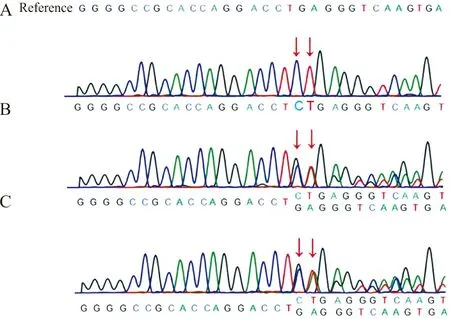
注:Reference,参考序列;A,先证者;B,先证者父亲;C,先证者母亲;箭头示CT插入突变。
2.2生物信息学蛋白质翻译预测结果 运用DNAMAN软件进行生物信息分析,发现该二核苷酸插入导致该基因编码的蛋白质发生移码突变,破坏了164位氨基酸后的读码框,且在166位处获得一终止密码子,从而使该蛋白质翻译提前终止,即R166*变异(图2)。该变异在SNP公共数据库中未见报道,在人群中不属于多态位点。ACMG指南及ClinGen序列变异解释结果表明,突变所致移码突变使得该蛋白质翻译提前终止,导致蛋白质功能改变(极强致病性证据PVS1);该变异在神州基因组数据库、人群基因组突变频率数据库(gnomAD)、人类外显子数据库(ExAC)和参考人群千人基因组(1000G)中均没有发现(中等致病性证据PM2);受检者检出纯合型变异(支持致病性证据PM3_Supporting);经公共数据库查询,TCIRG1基因(OMIM:604592)突变会导致患者发生常染色体隐性遗传疾病骨硬化病Ⅰ型(osteopetrosis, autosomal recessive Ⅰ,OMIM:259700),该疾病特征与本案例表型相符,但突变类型不一样。Sanger法测序验证结果显示:受检者在TCIRG1基因上发生c.493_494dup纯合突变,其父亲和母亲均发生杂合突变,突变来源于父母,该家系图谱见图3。

注:A,参考序列;B,先证者166位氨基酸处产生终止密码子,提前终止翻译;蓝色方框,TCIRG1基因5号外显子;蓝色箭头,5号外显子部分核苷酸序列及氨基酸序列;红色方框,CT插入突变;红色箭头,先证者在5号外显子处存在c.493_494dup变异。
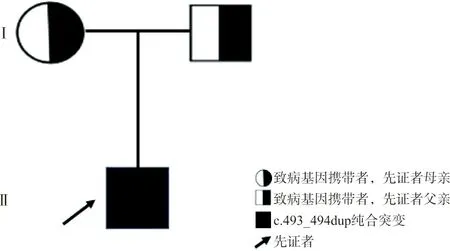
图3 该患儿家系图
3 讨论
目前临床上骨硬化症发病率较低,根据其临床表现和遗传方式,主要分为3类,常染色体隐性(恶性)石骨症(autosomal recessive osteopetrosis,ARO)、X-连锁石骨症(X-linked osteopetrosis,XLO)、常染色体显性石骨症(autosomal dominant osteopetrosis,ADO)[8]。骨硬化症作为一种遗传性代谢性骨病,主要是由于破骨细胞数目减少或功能缺陷导致骨吸收障碍,进而引起骨密度的增加而致病,临床症状主要表现为:生长发育迟缓;骨折;颅底骨硬化导致的视神经受压、面部神经麻痹和听力下降;牙齿异常,出现牙瘤,增加下颌骨骨髓炎风险;低钙血症;甲状旁腺功能异常等,可严重影响患儿的身心健康。
至今为止至少发现 10多个基因与ARO相关[9]。研究发现,在TCIRG1基因发生错义突变、微小错失或插入、无义突变、剪切位点突变、基因组缺失等时,会导致ARO发生[10]。TCIRG1基因编码破骨细胞中V-ATP 酶的a3亚单元,当TCIRG1基因发生缺陷时,a3蛋白功能受损,V-ATP 酶转运氢离子的功能受到影响[11],导致破骨细胞无法吸收骨组织,骨组织不能改建,骨髓腔消失,骨密度增加进而引发骨硬化症。近年来,除了TCIRG1基因的外显子检测外,TCIRG1基因内含子与剪切位点的研究也逐渐成为热点。2009年,有研究者对俄罗斯人群进行基因测序分析[12],结果发现TCIRG1基因中有1个独特的剪切位点变异——c.807+5G>A,其导致部分内含子发生转录,最终导致ARO的发生。TCIRG1基因突变与ARO密切相关,临床医师应了解TCIRG1基因的不同突变形式,提高对遗传性恶性骨硬化症的认识。
在本研究中,对先证者及其父母进行全外显子组测序[13],结果表明先证者的TCIRG1基因在外显子5位氨基酸处存在c.493_494dup CT二核苷酸纯合插入突变,经变异位点突变检测系统分析,该异常插入使得基因的蛋白质翻译发生移码突变而提前终止于166位氨基酸处,严重影响该基因的正常生理功能。该患儿在5个月时就表现出异常,发病时间也较同类患者更早。患儿反复出现呼吸道感染,累积肺炎病史3次,易合并呼吸衰竭,感染指标PCT、CRP增高,发病时体温持续高热(38.5~40 ℃)。病程中肝脾进行性肿大,血小板减少、贫血严重、血钙减低,运动落后仍不能独立坐及爬、行走,语言迟缓,与骨硬化症临床症状吻合。出院5个月后进行电话随访,患儿反复感染发热咳嗽,呼吸困难、意识障碍出现抽搐。由于TCIRG1突变所致的骨硬化症为常染色体隐性遗传病,患者该基因的2个等位基因均突变后才会发病,常为复合突变型,而本研究中的先证者是纯合突变型,较为少见,通过Sanger测序确认患儿的父母亲携带相同杂合子突变。随着二代测序技术在临床诊断中的广泛应用,对石骨症的基因诊断已初步成熟,但在产前诊断中采用基因检测方式的报道仍较少见。2015年有学者发现了一恶性石骨症家系,并确定家系中患儿携带TCIRG1基因c.242delC和c.1114C>T复杂杂合性突变,患儿母亲再次怀孕,第18周进行基因产前诊断,确定为携带c.1114C>T突变的正常男婴[14]。本案例确认了家系中的致病基因及突变位点,若先证者父母有再生育意愿,可通过基因诊断方式进行孕期产前诊断,可有效避免骨硬化症患儿的出生。
综上所述,本研究证实TCIRG1基因的c.493_494dup突变是骨硬化症的1个新的突变位点,与常染色体隐性遗传疾病骨硬化症Ⅰ型相关。本研究将遗传学理论与精准医学技术相结合,研究分析了该类骨硬化症家系,探讨其致病机制,可提供更好的遗传咨询和生育指导,最大程度减轻患儿家庭痛苦,有利于提升国家优生优育水平做贡献。
