系统性红斑狼疮患者血浆和外周血细胞人巨细胞病毒miR-UL22a-3p水平变化及价值*
2022-05-05魏文雁王成张明威周万青张春妮张辰宇汪俊军
魏文雁,王成,,张明威,周万青,张春妮,张辰宇,汪俊军
(1.南方医科大学第一临床医学院&东部战区总医院临床检验科,南京210002;2.南京大学生命科学学院,南京210046;3.南京鼓楼医院临床检验科,南京210008)
系统性红斑狼疮(SLE)是一种累及多系统的自身免疫性疾病,但其发病机制仍不明确[1]。人类巨细胞病毒(HCMV)是一种β疱疹病毒,在中国人群中的感染率高达90%以上,且与多种自身免疫病(包括SLE)的发生、发展关系密切[2-3]。最新研究表明,人外周血中存在多种HCMV miRNA,其可作为疾病新型生物标志物,参与疾病分子病理过程。血浆中hcmv-miR-UL112已被证实可作为原发性高血压新型标志物,并可通过诱导血管内皮细胞功能障碍促进原发性高血压发生[4]。本课题组既往研究表明,血清hcmv-miR-US4-3p可作为糖尿病肾病肾损害的潜在辅助诊断生物标志物[5]。hcmv-miR-UL22a-3p和hcmv-miR-UL22a-5p可显著抑制SMAD3转录和蛋白质表达,并通过经典TGF-β通路阻断信号传导,维持病毒在髓系细胞中的终生感染及再激活,在免疫性疾病的发生过程中发挥重要作用[6]。然而,关于hcmv-miR-UL22a-3p在SLE患者外周血中的表达水平变化、潜在来源及临床价值,国内目前尚未见报道。因此,本研究拟通过检测SLE患者和健康人对照血浆和外周血细胞中hcmv-miR-UL22a-3p的水平,初步探讨hcmv-miR-UL22a-3p在SLE患者血浆和血细胞中的表达变化及潜在的临床价值。
1 资料与方法
1.1研究对象 选取2019年10月至2020年1月在中国人民解放军东部战区总医院门诊或住院确诊的SLE患者49例, 其中女性42例,男性7例,年龄(37.39±12.00)岁,所有患者均符合1997年美国风湿病学会分类诊断标准[7],其中13例患者合并狼疮性肾炎。根据SLE疾病活动指数(SLEDAI)判断疾病活动度[8],24例处于非活动期(SLEDAI<5.0分),25例处于活动期(SLEDAI≥5.0分)。选取同期在健康体检中心体检各项指标正常的健康人49例作为健康人对照组,其中女性42例,男性7例,年龄(37.86±11.88)岁。SLE患者与健康人对照组之间性别、年龄差异无统计学意义(P>0.05)。
1.2试剂及仪器 5418型高速冷冻离心机(德国Eppendorf公司),Thermo Scientific Multiskan GO全波长酶联仪(美国Thermo Fisher Scientific公司),MaxyGeneⅡ梯度PCR仪(美国Corning公司),TL988-IV 96实时荧光定量PCR仪(西安天隆科技公司)。酸性水饱和酚(北京索莱宝公司),Trizol试剂(美国Life Technologies公司),分析纯级氯仿、异丙醇、无水乙醇(上海国药集团试剂公司),人工合成的MiR2911成熟体(上海Invitrogen公司),miRNA逆转录引物、qRT-PCR引物及TaqMan探针(美国ABI公司),逆转录体系和qRT-PCR试剂(大连TaKaRa公司)。
1.3方法
1.3.1标本采集 所有受试者均禁食12 h以上用EDTA-K2抗凝真空采血管采集静脉血3~5 mL,血液标本采集后迅速在室温下以1 500×g离心10 min,用Eppendorf(EP)管分别收集上层血浆和下层外周血细胞,置于-80 ℃保存备用。
1.3.2RNA提取
1.3.2.1血浆总RNA提取 用酸性苯酚-氯仿一步法提取血浆总RNA。步骤:100 μL血浆中加入300 μL DEPC水、200 μL水饱和酚和200 μL氯仿,剧烈震荡,室温静置15 min后于4 ℃、12 000×g离心20 min。上清液与1.5倍体积的异丙醇和1/10体积的醋酸钠溶液(3 mol/L,pH5.3)混匀,-20 ℃静置1 h后于4 ℃、16 000×g离心20 min。所得RNA沉淀加入75%乙醇(DEPC水稀释)洗涤,室温晾干约10 min后加入20 μL DEPC水溶解RNA沉淀。待RNA完全溶解后置-80 ℃保存备用。每份血浆样本在提取过程中均加入20 μL人工合成的浓度为107fmol/L的植物MIR2911(5′-GGCCGGGGGACGGGCUGGGA-3′)成熟体作为外源性参照,用于校正RNA提取效率和误差。
1.3.2.2外周血细胞RNA提取 用Trizol法提取外周血细胞RNA。步骤:500 μL外周血细胞样本中加入1 mL Trizol试剂、200 μL氯仿充分涡旋混匀,室温静置10 min后于4 ℃、16 000×g离心20 min。取上清与等体积异丙醇混匀,于-20 ℃静置1 h后于4 ℃、16 000×g离心20 min。所得RNA沉淀加入75%乙醇(DEPC水稀释)洗涤,室温晾干约10 min后加入20 μL DEPC水溶解RNA沉淀,待RNA完全溶解后,测其纯度及浓度,取纯度均大于1.8、浓度定量至0.5 μg/μL的RNA样本用于逆转录,以U6作为内源性参照。
1.3.3实时荧光定量PCR(qRT-PCR) 基于TaqMan探针的qRT-PCR法检测血浆和外周血细胞样本中hcmv-miR-UL22a-3p(5′-UCACCAGAAUGCUAGUUUGUAG-3′)的表达水平[9]。逆转录反应及qRT-PCR总反应体系和扩增条件:逆转录反应体系为10 μL,包括DEPC水3.5 μL,5×AMV缓冲液2.0 μL,dNTPs 1.0 μL,逆转录引物1.0 μL,AMV逆转录酶0.5 μL,RNA样本 2.0 μL。反应条件:16 ℃ 30 min;42 ℃ 30 min,85 ℃ 5 min。cDNA样本置于-20 ℃保存。qRT-PCR反应体系为20 μL,包括ddH2O 14.77 μL,10×PCR缓冲液2.0 μL,25 mmol/L MgCl21.2 μL,dNTPs 0.4 μL,Taq聚合酶0.3 μL,miRNA检测引物和探针0.33 μL,cDNA 1.0 μL。反应条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。hcmv-miR-UL22a-3p的相对表达量采用2-ΔCt法计算,公式:ΔCt(血浆)=Ct目的miRNA-CtMIR2911;ΔCt(外周血细胞)=Ct目的miRNA-CtU6。每个Ct值为相应样本重复测定3次后所得的均值,同时以ddH2O作为阴性对照。
1.4统计学分析 采用SPSS 25.0软件对数据进行统计学分析。非正态分布计量资料采用[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验。正态分布资料采用均数±标准差表示,两组间比较采用两独立样本的t检验。变量间的相关性分析采用Spearman相关分析。采用ROC曲线评估hcmv-miR-UL22a-3p表达对SLE患者的临床诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1SLE患者血浆和外周血细胞hcmv-miR-UL22a-3p的表达水平 qRT-PCR结果显示,与对照组相比,SLE患者血浆hcmv-miR-UL22a-3p的表达水平显著降低(P<0.001);SLE组活动期与非活动期比较差异无统计学意义(P>0.05);与单纯SLE组相比,狼疮性肾炎组患者hcmv-miR-UL22a-3p的表达水平差异无统计学意义(P>0.05)。与对照组相比,血细胞中SLE组患者hcmv-miR-UL22a-3p的表达水平升高(P<0.001);SLE组活动期与非活动期比较差异无统计学意义(P>0.05);与单纯SLE组相比,狼疮性肾炎组患者hcmv-miR-UL22a-3p的表达水平升高(P<0.05)。见表1。
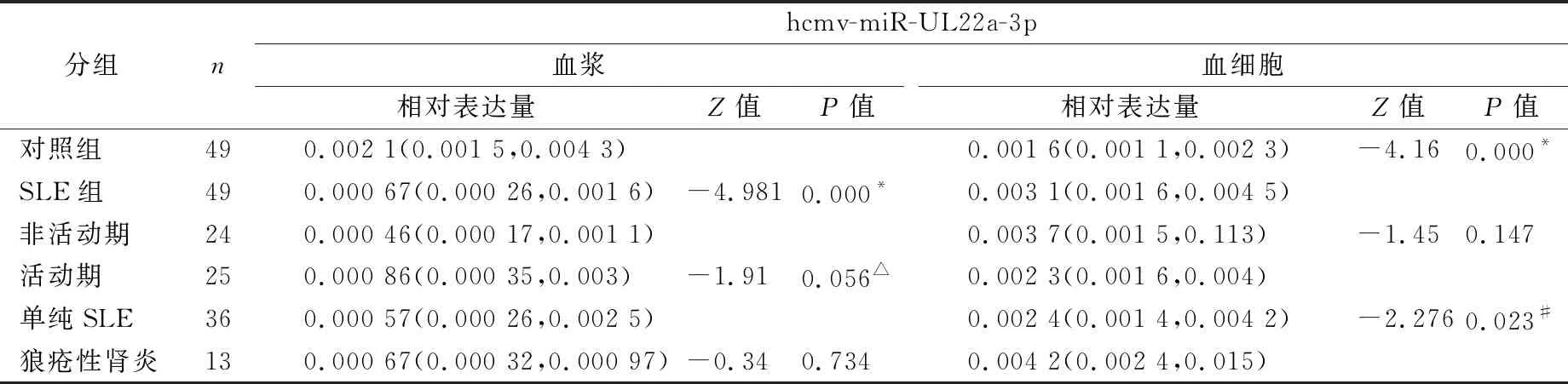
表1 SLE患者血浆和外周血细胞hcmv-miR-UL22a-3p的表达水平
2.2血浆和外周血细胞hcmv-miR-UL22a-3p与SLE患者临床指标之间的相关性分析 Spearman相关性分析显示,血浆hcmv-miR-UL22a-3p与白细胞数目呈正相关(P<0.05);血细胞hcmv-miR-UL22a-3p与血沉呈正相关(P<0.05),而与补体C3、血清蛋白、白细胞计数均呈负相关(P<0.05)。见表2。
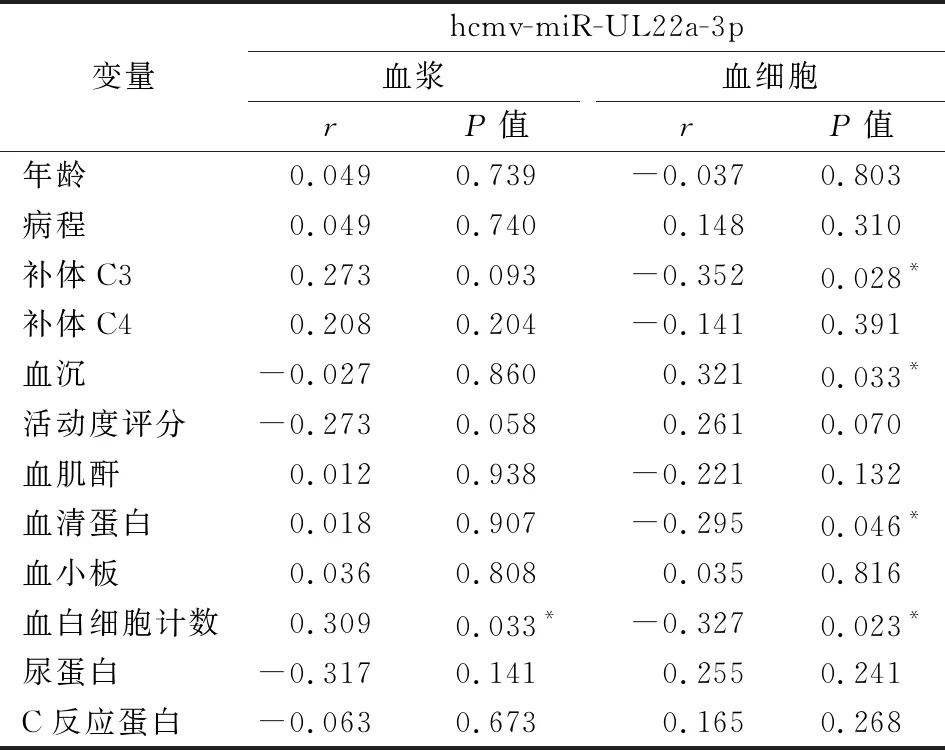
表2 hcmv-miR-UL22a-3p和SLE患者临床指标的相关性
2.3血浆和外周血细胞hcmv-miR-UL22a-3p对 SLE 的预测及区分价值 ROC曲线分析显示,血浆和血细胞hcmv-miR-UL22a-3p以及血细胞与血浆hcmv-miR-UL22a-3p水平比值均能够较好地区分SLE患者和健康人对照,血浆区分SLE患者和健康人对照的ROC 曲线下面积(AUCROC) 为 0.792(95%CI:0.701~0.883),当cut-off值为0.001 3时,血浆hcmv-miR-UL22a-3p诊断SLE的敏感性为75.5%,特异性为79.6%。外周血细胞hcmv-miR-UL22a-3p区别SLE患者和健康人对照 AUCROC为0.744(95%CI:0.647~0.841),当cut-off值为0.001 9时,敏感性为69.4%,特异性为63.3%。血细胞和血浆hcmv-miR-UL22a-3p水平比值联合区分SLE患者和健康人对照的AUCROC为0.830(95%CI:0.751~0.910),当cut-off值为 1.81时,敏感性为71.4%,特异性为85.7%。见图1。
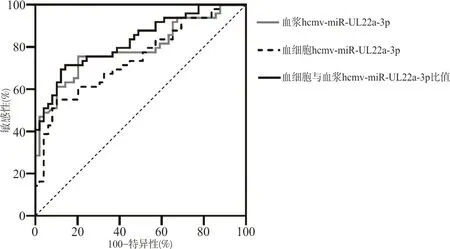
图1 hcmv-miR-UL22a-3p对SLE预测的ROC曲线
2.4Logistic回归分析 单因素Logistic 回归分别纳入血浆hcmv-miR-UL22a-3p、血细胞hcmv-miR-UL22a-3p以及血细胞与血浆hcmv-miR-UL22a-3p水平比值分析,结果显示在SLE和对照组的二分类变量模型中,低水平的血浆hcmv-miR-UL22a-3p和高水平血细胞hcmv-miR-UL22a-3p以及血细胞与血浆hcmv-miR-UL22a-3p的高比值与SLE发生相关(OR=0.083,95%CI:0.027~0.250,P<0.001;OR=17.537,95%CI:3.748~82.047,P<0.001;OR=1.676,95%CI:1.223~2.297,P<0.001)。
当以单纯SLE和狼疮性肾炎为二分类变量时,结果显示仅高水平的血细胞hcmv-miR-UL22a-3p与狼疮性肾炎发生相关(OR=7.296, 95%CI:1.328~40.098,P<0.05),血浆hcmv-miR-UL22a-3p水平差异无统计学意义(P>0.05);进一步以SLE活动期和SLE非活动期为二分类变量时,血浆及血细胞hcmv-miR-UL22a-3p水平与SLE是否处于活动期均无统计学意义(P>0.05)。
多因素Logistic回归分析结果显示,在以SLE和对照组为二分类变量时,在校正年龄、性别影响后,低水平的血浆hcmv-miR-UL22a-3p和高水平的血细胞hcmv-miR-UL22a-3p以及血细胞与血浆hcmv-miR-UL22a-3p的高比值仍与SLE的发生密切相关(OR=0.079,95%CI:0.026~0.243,P<0.001;OR=18.661,95%CI:3.955~88.044,P<0.001;OR=1.681,95%CI:1.224~2.31,P<0.001)。当以单纯SLE和狼疮性肾炎为二分类变量时,在校正年龄、性别影响后,高水平的血细胞hcmv-miR-UL22a-3p仍与狼疮性肾炎的发生相关(OR=14.772,95%CI:1.958~111.433,P<0.05)。
3 讨论
近年来,病原微生物的潜伏感染与人类疾病的关系受到广泛关注,HCMV感染与 SLE 发生、发展密切相关,HCMV miRNA在此过程中发挥重要作用[2]。研究显示,HCMV能够通过其编码的miRNA调节多种生物学过程,如囊泡运输、细胞周期调控、凋亡、免疫逃逸及病毒潜伏和激活[10]。同时,外周血中特定变化的HCMV miRNA具备作为疾病新型分子标志物潜能,参与疾病发生、发展。本研究发现,SLE 患者hcmv-miR-UL22a-3p在血浆中的表达水平低于健康人群,而在外周血细胞中高于健康人群, 提示联合检测血细胞与血浆hcmv-miR-UL22a-3p有望成为SLE的辅助诊断指标。
大量研究显示,多种不同疾病(包括自身免疫病)患者外周血循环中HCMV编码的miRNA具备作为分子标志物潜能。本课题组既往研究表明,口腔扁平苔藓(OLP)患者血浆中hcmv-miR-UL112-3p、hcmv-miR-UL22a-5p、hcmv-miR-UL148d、hcmv-miR-UL36-5p和hcmv-miR-UL59的表达水平显著高于健康个体血浆[9]。血浆hcmv-miR-UL112可通过诱导血管内皮细胞功能障碍促进原发性高血压发生,已被证实可作为原发性高血压的新型标志物[4]。研究表明,HCMV感染婴儿的血清细胞外囊泡中hcmv-miR-US25-1-5p和hcmv-miR-UL112-3p的水平与肝损伤显著相关,提示HCMV miRNA可以作为疾病发生、发展的非侵入性或微创生物学标志物[11]。本研究中的ROC曲线及Logistic回归分析结果显示,SLE患者血浆hcmv-miR-UL22a-3p水平下调,外周血细胞hcmv-miR-UL22a-3p水平上调,血细胞和血浆hcmv-miR-UL22a-3p高比值均能较好区分SLE患者和健康人群,且与SLE发生密切相关,提示其具有作为SLE生物学标志物的潜能。
免疫紊乱与SLE发病关系密切,HCMV编码miRNA可能在此过程中发挥重要作用。研究表明,Toll样受体(TLR)的激活可以导致干扰素调节家族(IRF-3)、NF-κB 和MAP激酶的下游激活,产生干扰素-α和RNA结合自身抗体,包括抗Ro、La、Sm和RNP抗体[1]。报道显示,hcmv-miR-UL112-3p可靶向TLR2,从而调节先天免疫应答,抑制TLR2介导的NF-κB信号传导[12]。最近研究表明,中性粒细胞在受到细胞因子、活化的血小板和血管内皮细胞等因素激活后,刺激Ⅰ型干扰素的产生,促进免疫细胞成熟,并导致组织损伤和血管功能障碍,在SLE的发病机制中起重要作用[13]。而hcmv-miR-UL112可以通过下调Ⅰ型IFN信号传导,抑制NK细胞的细胞毒性来破坏先天免疫,规避宿主免疫反应。hcmv-miR-UL22a-3p可通过丝裂原活化蛋白激酶途径诱导内皮细胞生长,并可通过激活编码黏附分子、趋化因子和细胞因子-细胞因子受体相互作用等相关分子的基因,诱导内皮细胞功能障碍[4,14]。T细胞中靶向TGF-β1信号传导的突变被证实可以导致自身免疫综合征,并与狼疮抗DNA或抗Sm抗体的产生有关,而hcmv-miR-UL22a-3p可通过经典TGF-β通路阻断信号传导[6,15]。本研究通过相关分析显示,血浆与血细胞hcmv-miR-UL22a-3p均与白细胞计数呈显著相关,外周血细胞hcmv-miR-UL22a-3p还与补体C3相关,其中白细胞计数、补体均属于狼疮活动度评分标准,狼疮活动度评分反映了疾病严重程度和器官受累情况。因此,笔者推测,hcmv-miR-UL22a-3p可能通过调节免疫细胞导致免疫紊乱,从而促进SLE的发生、发展。本研究还发现,狼疮性肾炎组相对单纯 SLE 组血细胞hcmv-miR-UL22a-3p的表达水平上调,单因素及多因素分析显示血细胞hcmv-miR-UL22a-3p的表达水平与狼疮性肾炎发病相关,但鉴于本研究病例数不足,仍需扩大样本量探究hcmv-miR-UL22a-3p与狼疮性肾炎之间的关系。
研究表明,细胞外囊泡(EVs)在细胞间通讯中起着重要作用,EVs内富含供体细胞来源的miRNA,并可与相关蛋白质形成蛋白质-miR复合物,防止被核糖核酸酶降解,这些miRNA可以被运输至靶器官来调节靶基因[16]。Ding等[9]研究表明,OLP患者hcmv-miR-UL59可能通过潜藏在血浆的外泌体中来实现免疫逃逸,表明受病毒感染的细胞有可能通过分泌外泌体来调节血浆中HCMV miRNA水平变化。Zhang等[11]检测并分析HCMV感染婴儿的血清EVs中miRNA水平时发现,在感染6 h后,EVs中的hcmv-miR-US25-1-5p和hcmv-miR-UL112-3p水平升高,且与肝损害密切相关,该研究结果表明病毒可以改变被感染宿主细胞的EVs特征,HCMV miRNA可以通过EVs转运至未感染的细胞。然而HCMV miRNA与EVs之间的具体机制仍未阐明。
本研究结果显示,hcmv-miR-UL22a-3p在血浆及血细胞中的表达水平不一致, hcmv-miR-UL22a-3p的表达水平在血浆中降低而在血细胞中升高,且hcmv-miR-UL22a-3p在血浆中的表达水平与白细胞计数呈正相关,而在血细胞中呈负相关,但具体分子机制不清楚。有研究结果显示,hcmv-miR-UL22a-3p可维持病毒在髓系细胞中的终生感染及再激活[6];另有报道表明,外周血单个核细胞miR-199a-3p水平升高与白细胞降低显著相关,且上调的miR-199a-3p可显著提高单个核细胞凋亡率[17]。因此,笔者推测与miR-199a-3p作用类似,hcmv-miR-UL22a-3p同样有利于病毒在细胞内潜伏,可能在白细胞内合成增多,而分泌至外周血中减少,且其在白细胞内高水平的表达可能促使白细胞凋亡,白细胞参与机体炎症和免疫反应的调控,在特异以及非特异性免疫应答中均起重要作用。
综上所述,联合血浆和外周血细胞hcmv-miR-UL22a-3p的表达水平可能成为SLE的潜在生物学标志物,并为研究HCMV在SLE中潜伏以及致病机制提供线索。但血浆和外周血细胞hcmv-miR-UL22a-3p在免疫逃逸、中性粒细胞激活机制和运输方式仍需要进一步实验研究证实。为更深入探究hcmv-miR-UL22a-3p对SLE患者的临床价值,除扩大样本量外,还应开展前瞻性研究以及临床随访。
