单细胞测序技术在胃癌研究中的应用*
2022-05-05齐茜刘鹏王明义王玉珊罗红
齐茜,刘鹏,王明义,王玉珊,罗红
(1.威海市立医院中心实验室,山东威海 264200;2.大连医科大学检验医学院,辽宁大连 116044)
胃癌(gastric cancer,GC)作为一种高度侵袭性的癌症[1],死亡率高,预后差,平均5年生存率不到20%[2-3]。幽门螺杆菌感染、吸烟、高盐饮食、高肉类摄入和胆汁反流等均是胃癌的临床危险因素[4-5]。基于胃癌的传统测序方法是多细胞水平的,比如转录组测序技术,是提取器官、肿瘤组织或者细胞群的混合RNA进行测序,最终得到的信号值代表多个细胞群体水平,无法精确揭示其中的基因表达差异等异质性的信息,而这些肿瘤生物学特征差异对于癌症的诊疗及预后有重要意义[6-7]。二代测序技术的飞速发展,极大地促进了对肿瘤发病机制的深入研究[8]。单细胞测序技术能更精准地从细胞、基因以及分子层面揭示GC的发生、发展和转移机制,提高GC的诊断和个体化治疗以及预后评估水平。
1 单细胞测序技术
随着流式细胞术(fluorescence activated cell sorting,FACS)[9-10]、激光捕获显微切割(laser capture microdissection, LCM)[11-12]以及微流控(microfluidics)[13]等单细胞分离技术的出现以及新一代测序平台的广泛应用,单细胞测序技术应运而生[14]。单细胞测序技术是对单个细胞进行测序分析的一项新技术,能够弥补传统高通量测序的局限性,对单个细胞进行无偏倚、高通量和高分辨率的转录组分析[15](图1),从而揭示单个细胞的基因结构和基因表达状态,反映细胞间的异质性并将其归类分析,进行个性化研究。因此,该技术可应用于检测循环肿瘤细胞的分子表型分型[16]、发现早期的肿瘤细胞、监测肿瘤内异质性以及指导靶向精准治疗等[17]。单细胞测序主要涵盖转录组和基因组两部分,通过分析比较单个细胞的RNA和DNA序列来反映转录组和基因组的变化。
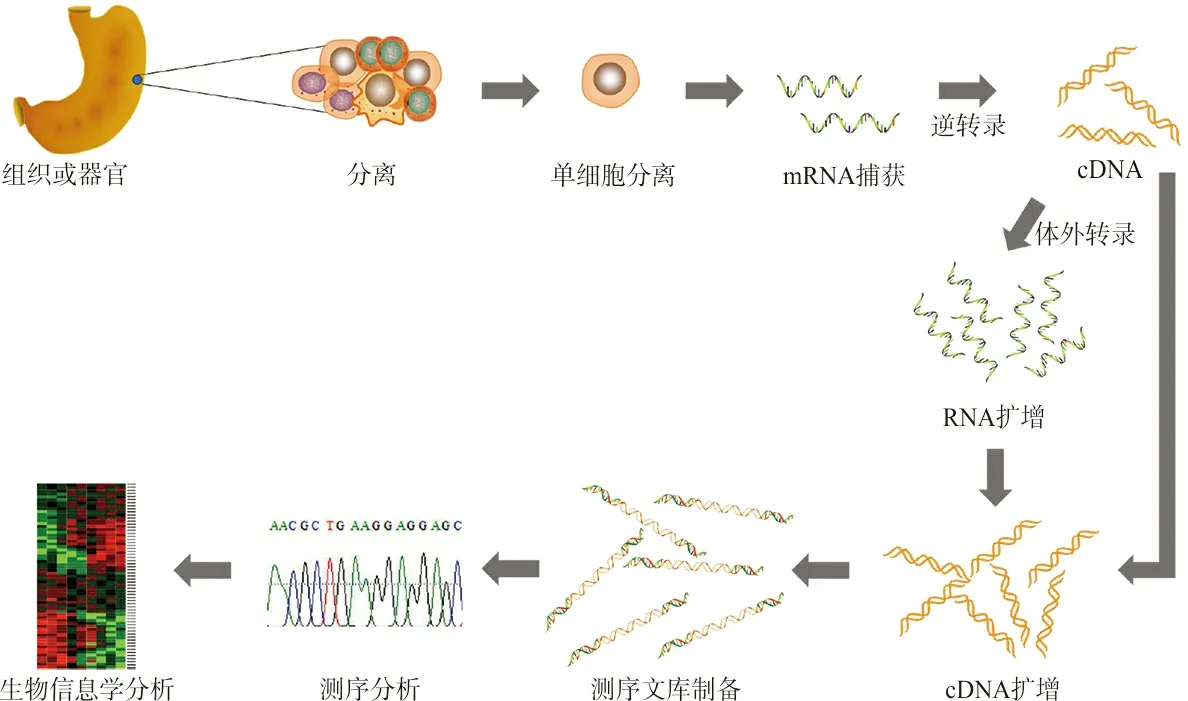
图1 单细胞RNA测序工作流程
单细胞转录组是基因组和表观基因组的功能性读数。理想情况下,转录组分析应能准确地捕捉到生物体最小功能单元(单个细胞)中所有种类的全长RNA的精确数量。Tang等[18]首次使用单细胞转录组测序(single cell RNA-Seq,scRNA-Seq)技术在单个小鼠卵母细胞和卵裂球进行分析,随后经过不断优化,包括单细胞 mRNA 深度测序文库构建方法、提高测序通量等,使得单细胞转录组测序能够适用于更多研究中。诸如单细胞标记反转录测序(single-cell tagged reverse transcription sequencing, STRT-seq)[19-20]、模板转换法(switching mechanism at 5′end of the RNA transcript, SMART-seq)[7]、体外线性(IVT)扩增单细胞转录组的方法(cell expression by linear amplification and sequencing, CEL-seq)[17]、单细胞全转录扩增技术(whole-transcript amplification for single cells,Quartz-seq)[21]以及日本理化所开发的Quartz-seq2[22]等方法的发展和运用,大大拓展了scRNA-seq 分析技术的应用范围。目前,scRNA-seq分析逐渐成为研究细胞间转录组的差异性,揭示细胞类型、亚型、状态和发展轨迹等的有效方法[23],在揭示肿瘤发生发展、细胞异质性、微量样品的转录组分析、真核生物转录组基因复杂性等方面被广泛应用。
单细胞基因组扩增和测序技术在肿瘤发生机制研究和临床诊断中发挥了不可替代的作用。2011 年,Navin等[24]利用简并寡核苷酸引物PCR(degenerate oligonucleotide primed PCR, DOP-PCR)全基因组扩增及DNA测序技术对来自多基因组肿瘤的 100 个单细胞和单株原发肿瘤及其肝转移的100 个单细胞进行测序分析,揭示了乳腺癌单细胞水平的基因组拷贝数变异(copy number variations,CNV) ,推断出肿瘤的克隆演化过程。而后,随着多重置换扩增(multiple displacement amplification,MDA)[ 25]和多重退火和基于环状循环扩增 (multiple annealing and looping-based amplification cycles,MALBAC)[26]等技术的涌现,基因组覆盖率得到了提高,PCR错误率也迅速降低[27]。近年来,随着科研人员对单细胞全基因组测序的精确度及覆盖度的高要求,单细胞全基因组扩增技术也在不断改善与提高中,比如利用微流体反应器进行单链测序(single-stranded sequencing using microfluidic reactors, SISSOR)方法[28],通过转座子插入的线性扩增 (linear amplification with transposon insertion,LIANTI)方法[29]等。
2 单细胞测序技术在GC研究中的应用
2.1GC免疫微环境方面的单细胞测序技术研究 肿瘤免疫微环境(TME)的重要组成部分是肿瘤浸润的免疫细胞,包括T 淋巴细胞、B 淋巴细胞、自然杀伤细胞、巨噬细胞等细胞亚群;这些免疫细胞既对肿瘤细胞起杀伤作用 (例如 CD8+T细胞、自然杀伤细胞),又能够促进肿瘤发展[30]。因此,肿瘤微环境已成为一个潜在的抗癌靶点,对其的研究已成为肿瘤生物学的热点[31]。单细胞测序技术是分析TME中细胞成分异质性的有力工具,通过scRNA-seq分析可以检测到使用内窥镜切除的肿瘤组织中更多样的TME免疫细胞,甚至可以检测肿瘤中的B细胞或Treg细胞的亚群[32],故而可作为分析肿瘤微环境高度可行的平台。
为了筛选GC潜在的、新的免疫治疗标志物和靶点,Sathe等[33]从7例GC患者和1例肠道上皮化生(GIM)患者中获取组织,对其进行单细胞转录组分析,结果发现与正常胃组织相比,同一种类型的细胞具有异质性。这种异质性在肿瘤内和肿瘤间均存在,如巨噬细胞具有转录异质性,不符合M1/M2型巨噬细胞;细胞毒性T细胞(CTL)内具有肿瘤耗竭T细胞型亚组等。此外,该学者通过单细胞测序和受体配体相互作用分析了TME专有的细胞间通讯,有助于了解肿瘤生物学,对筛选GC的潜在免疫治疗靶点具有重要价值。
GC的发展过程是从非萎缩性胃炎到慢性萎缩性胃炎,再到肠上皮化生,最终进展为GC。在GC进展过程中TME细胞的变化尚未阐明,因此,scRNA-seq技术可以帮助检测特定的细胞和转录特征,以揭示TME细胞与GC的关联。Yin等[34]使用单细胞测序技术在GC发展过程中的各个阶段生成了各种 TME 细胞的动态转录组图谱,检测出一组与 TME 细胞致癌相关的关键转变标记,如PLAU、S100A8和CLEC10A基因,并描绘了这些细胞的动态致癌轨迹。因此,未来可以基于上述的关键转变基因确定免疫抑制检查点靶点,从而创立新的免疫疗法,以有效预防和控制肿瘤的发生和转移[35]。
2.2GC免疫细胞方面的单细胞测序技术研究 近年来,肿瘤免疫疗法已成为肿瘤治疗领域的热点,但由于难以确定可用于临床的生物标志物,肿瘤免疫疗法仍面临诸多困难。单细胞测序技术作为研究肿瘤免疫的一个有力工具,能够预测潜在的抗癌靶点,在GC的免疫治疗中有极高的实用价值。2020年,Fu等[36]利用scRNA-seq对2例GC患者的组织和3 例GC患者的外周血进行转录组分析,发现与癌旁组织相比,GC癌组织中耗竭性CD8+T细胞中的干扰素调节因子8(interferon regulatory factor 8, IRF8)表达下调,且GC患者外周血中CD8+T细胞中IRF8的表达也降低,提示IRF8的表达与GC相关,可能成为免疫治疗的潜在靶点。该研究从肿瘤浸润 T 细胞表型的转换机制切入,对不同的免疫细胞亚群进行鉴定,并对其发育轨迹进行描述,在单个细胞水平上揭示了GC患者T细胞的异质性。另有学者揭示了GC的免疫抑制机制,并为GC的免疫检查点疗法筛选了潜在靶点[35]。
肿瘤免疫中,CD8+效应T细胞起到重要的抗肿瘤作用,但肿瘤介导的 T 细胞耗竭阻碍了CD8+T细胞正常发挥细胞毒性,从而导致免疫抑制[37]。研究表明,在肿瘤发生发展过程中可变启动子(alternative promoters)在肿瘤特异基因表达的调控方面发挥了相当重要的作用[38]。Sundar等[39]用scRNA-seq分析证实了GC中可变启动子高负荷表达的T细胞活性水平降低,并表现出免疫耗竭的特征。进一步对接受免疫治疗的胃肠道癌症患者分析发现,可变启动子高负荷表达与低负荷表达相比,GC的无进展生存期更短。这提示了可变启动子与GC患者免疫细胞之间具有相关性,借助单细胞测序技术进一步揭示了GC的免疫抑制机制,为今后GC患者的临床治疗提供了潜在的免疫治疗新思路。
2.3GC细胞异质性方面的单细胞测序技术研究 肿瘤异质性是导致肿瘤药物治疗耐药性的重要原因,也是肿瘤精准医疗所面临的挑战。胃腺癌(GAC)作为一种高度侵袭性的癌症,死亡率高,分子和临床特征复杂[40]。对GC肿瘤细胞进行分群分析有助于发现对药物治疗耐药的细胞类群,对GC的精准治疗有重要的参考意义。单细胞测序技术可实现更精准无偏倚地对GC细胞进行分群。2020年,Zhang等[41]对9例GC患者和3例非肿瘤患者样本中的27 677个细胞进行无偏倚的单细胞测序,确定了5个肿瘤细胞亚群(C1~C5),并对其分子特征进行了描述。该研究发现C4亚群特异性表达基因RNF43富集了WNT相关信号通路,这与主细胞主导型胃底腺癌(GA-FG-CCP)具有一致性。另外,在单细胞层面描述了主细胞有可能向解痉肽表达化生细胞(SPEM)转变的途径。该研究在单细胞水平上阐述了胃化生细胞的起源和胃癌异质性,说明在可预见的未来,单细胞测序技术可用于检测罕见肿瘤类型(如GA-FG-CCP)及准确诊断 GA。
腹膜转移(PC)是晚期GC患者死亡的首要原因之一,发生在约45%的晚期GAC患者中。Ajani等[42]使用单细胞测序技术结合免疫组化染色检测出PC肿瘤细胞具有高度异质性,证明了YAP1在PC细胞中呈高表达,并使得PC细胞具有肿瘤干细胞的性质。该研究还通过联合使用单细胞测序技术发现YAP1高表达可作为GC患者发生PC的靶标。因此,干扰或抑制YAP1的功能,或与目前的化疗药(如多西紫杉醇)联合治疗可能对GC治疗有效。YAP1抑制剂可成为新的抗癌药物,为GC患者带来希望。
2.4癌前病变和早期胃癌病变方面的单细胞测序技术研究 癌前病变向侵袭性疾病进展过程中,肿瘤细胞通常是罕见的群体,不会大量出现,无法轻易通过常规的针对细胞集合的测序获得数据。Zhang等[43]对非萎缩性胃炎(NAG)、慢性萎缩性胃炎(CAG)、肠上皮化生(IM)或早期胃癌(EGC)患者的13例胃窦黏膜样本进行活检,获取32 332个高质量的细胞并进行单细胞转录组分析,以构建单细胞图谱,同时在细胞和分子2个层面构建不同病变胃上皮的的单细胞转录组网络。基于单细胞图谱,该研究团队发现了一组胃癌特异性标记基因,其在其他细胞类型中低表达,但在癌细胞中显著上调,该组基因包括SLC11A2、KLK7、SULT2B1和LMTK3等。这些基因作为GC细胞特异性分子标记,可在GC早期阶段识别癌细胞发育,进而识别早期GC[33]。另外,该研究团队还发现OR51E1可用来标记早期癌变中的内分泌细胞,HES6可能标记出杯状前细胞簇,这为鉴别早期化生提供重要价值。
Owen等[44]从6名Barrett食管(Barrett′s Esophagus, BE)患者和2名无食管病变患者中获取组织,对其进行单细胞测序,发现癌前病变细胞中与GC进展相关的标记基因,如SPINK4和ITLN1基因标记Barrett食管杯状细胞分化的早期阶段的细胞,有助于鉴别化生。另外,该研究团队还发现以LEFTY1和OLFM4基因为标记的Barrett食管中的细胞与食管黏膜下腺细胞有转录重叠,但与胃或十二指肠细胞没有重叠。这些研究揭示了癌前状态下正常组织和细胞间的转录关系,有助于对癌前病变或GC早期诊断。
2.5利用单细胞测序技术构建GC细胞图谱 2018年9月,人类肿瘤图谱网络(Human Tumor Atlas Network,HTAN)计划启动。2020年4月,HTAN研究取得的进展发表于Cell杂志。该图谱将使人们全面深入了解癌症生物学,对肿瘤预防、监测和治疗有重要的指导价值。2020年6月,Gut杂志发表了全方位的胃癌表达谱图谱[41],并建立了一种新型的区分良恶性上皮细胞的分类方法。该研究着眼于非恶性上皮细胞,阐述了胃化生细胞的起源;着眼于恶性上皮细胞,构建了一种量化细胞分化程度的计算方法,并揭示分化程度与GC的预后密切相关;发现了一种新型的GC类型:主细胞主导型GC,并在大规模数据库中验证了这种类型GC的存在。该研究为剖析GC异质性、预后和解析GC化生演变进程提供了宝贵的数据资源。现今,GC的基因组图谱已经被描绘出来。每个分子亚型的分子特征和新的治疗靶点已被鉴定。这些进展使临床将基于基因组和基于表型的诊断和治疗方法结合起来并应用于精确医学时代的个体GC患者成为可能[8]。
3 小结及展望
单细胞测序技术能表征大量细胞异质性,并为GC异质性的研究提供有价值的资源,为GC的诊断和预后评估提供宝贵的参考资料。然而,单细胞测序技术还有许多不足之处,迫切需要改进与创新。如在获取单细胞时形成的单细胞悬液,在细胞分选过程中其转录状态是否发生改变,单细胞检测样品是否能够较为准确地揭示细胞在组织中的空间结构信息,单细胞是否会打破组织和器官的整体性。另外,检测样品的制备受到捕获效率的限制,由于现有技术的破坏效应或其低效率,珍稀的细胞类群很可能被忽略。因此,提高样品制备的效率及转录组和基因组在扩增时的覆盖率、降低错配率和减少噪音影响,以及建立更完善的生物信息算法用于评估群体发展趋势,对单细胞测序技术体系进行优化等都十分必要。
随着单细胞测序技术不断发展,人们对GC研究的新思路也不断涌现, 特别是基于单细胞多组学研究技术,不仅可以对来自同一个细胞的多种分子形式进行联合分析,还可进行多个肿瘤细胞间的多维数据分析,如同步检测单细胞ATAC和单细胞RNA信息的单细胞测序技术(simultaneous high-throughput ATAC and RNA expression with sequencing,SHARE-seq)[45-46]的开发,实现了在单细胞中同时高质量、高通量的检测基因表达,为单细胞多组学研究提供了一个可以参考的范例。随着单细胞测序技术中具有创新性和创造性的方法被不断开发和应用,其在未来精准医疗的应用前景将十分广阔。
