不同剂型的砂生槐总生物碱对多房棘球蚴小鼠的药效学作用※
2022-05-03甘雪辉胡春晖高瑞雪张发斌
甘雪辉,胡春晖&,都 涛,高瑞雪,高 攀,张发斌*
(1.青海大学,青海 西宁 810001;2.西部战区总医院,四川 成都 610083;3.陕西中医药大学,陕西 咸阳 712046)
不同剂型的砂生槐总生物碱(Total alkaloids ofSophoramoocrorftiana,简称TA-SM)对多房棘球蚴小鼠的药效学作用效果不明确,导致临床选择无明确依据。本研究比较不同剂型的TA-SM对多房棘球蚴小鼠的药效学作用效果。
1 材料与方法
1.1 材料
1.1.1 实验动物
用多房棘球蚴保种的蒙古长爪沙鼠由青海省包虫病重点实验室提供。昆明雄性小鼠(Kunming mice,KM小鼠),体重(20±2)g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008。实验动物的使用和处理经过青海大学医学院实验动物伦理委员会批准。
1.1.2 实验试剂
Total RNA提取试剂(TaKaRa公司,货号:9109);去基因组DNA反转录试剂盒(TaKaRa公司,货号:RR047A);Takara嵌合法Real Time PCR(qPCR)试剂盒(TaKaRa公司,货号:RR820A);10×红细胞裂解液(联科生物,货号:4006721600);PE-CF594 CD3e流式抗体(BD公司,货号:562286);APC CD4流式抗体(BD公司,货号:553051);PE CD8a流式抗体(BD公司,货号:553032);FITC CD19流式抗体(BD公司,货号:557398);碱性磷酸酶(ALP) 比色法测试盒(Elabscience公司,货号:E-BC-K091-M);γ-谷氨酰转肽酶(GGT/γ-GT)比色法测试盒(Elabscience公司,货号:E-BC-K126-M);Caspase 3活性检测试剂盒(分光光度法)(Elabscience公司,货号:E-CK-A311)。砂生槐子采自西藏林芝地区。
1.1.3 实验仪器
Resona 7彩色多普勒超声系统(mindray公司);3-30 KS台式高速冷冻离心机(SIGMA公司);NanoDrop 2000 c超微量核酸蛋白测定仪(ThermoFisher Scientific 公司);GeneAmp PCR System 9700 PCR基因扩增仪(ABI公司);Light Cycler 480 II实时荧光定量PCR仪(Roche公司);Multiskan Sky酶标仪(ThermoFisher Scientific公司)。
1.2 方法
1.2.1 动物造模
实验动物造模参照文献[1]。通过腹腔注射原头节的方式完成造模,4个月后通过多普勒超声检测,能够看到明显包块者确定造模成功,见图1。

A:超声检测横截面;B:超声检测纵截面图1 典型超声图(虚线标注为病灶范围)Figure 1 Typical ultrasound image
1.2.2 分组
将造模成功的小鼠随机分为砂生槐总生物碱片剂组和水剂组,每组18只。片剂组每天予TA-SM片剂,水剂组每天予TA-SM水剂,片剂组和水剂组给药剂量为28 mg/kg/d,采用灌胃给药。连续给药15、30、60天时每组随机处死6只小鼠做检测。
1.2.3 脾脏指数、囊重指数测定
以异氟烷(流速1.5mL/min)吸入法麻醉后解剖小鼠,取脾脏、腹腔包囊进行称重,计算脾脏指数、囊重指数(脾脏指数=脾脏质量/小鼠总质量×100;囊重指数=腹腔包囊质量/小鼠总质量×100)。
1.2.4 CD4+、CD8+、T、B相对含量测定
取出小鼠脾脏后,于70 μm细胞筛中加入预冷磷酸盐缓冲液(PBS)研磨,收集细胞悬液,离心(4℃,1600r/min,5min);去上清液,再加入2 mL红细胞裂解液,用PBS冲洗两遍,加入0.2% BSA重悬细胞,计数后将细胞浓度调到1×107Cell/mL。吸取100 μL细胞悬液到流式管中进行抗体染色,每只流式管中加入PE-CF594 CD3e、APC CD4、PE CD8a、FITC CD19抗体各1.5 μL,以涡旋混匀后避光孵育30 min,用预冷的PBS清洗两次去除多余的染料,用400 μL 1%多聚甲醛重悬细胞,上机检测样品。流式细胞术数据用Flow Jo软件分析。
1.2.5 TGF-β1、Gadd 45 γ mRNA相对表达量测定
使用Trizol法提取肝脏组织中的总RNA,检测纯度和浓度,保证OD260nm/OD280nm在1.8~2.0之间。mRNA反转录反应条件:37 ℃,15 min;85 ℃,5 s;4 ℃保持。用荧光定量PCR扩增配制20 μL PCR反应体系,预变性条件:95 ℃,30 s(循环1次)。PCR反应条件:95 ℃,5 s;60 ℃,30 s;95 ℃,5 s(循环40次)。熔解曲线条件:60 ℃,1 min;95 ℃,0 min(循环1次)。降温条件:50 ℃,30 s(循环1次)。用LightCycler480 System系统检测得到Ct值,以2-△△Ct为统计量,计算目的基因的相对含量。所有样本重复检测3次,取平均值。引物由上海生工生物工程公司合成,引物序列见表1,内参基因选用GAPDH。

表1 实时荧光定量PCR引物Table 1 Real-time PCR primers
1.2.6 其他相关指标测定
碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)和Caspase 3活性检测按照试剂盒说明书进行。Caspase 3活性检测通过试剂盒利用分光光度法检测肝组织裂解液中的吸光度,判断Caspase 3活性蛋白活化程度。
1.2.7 统计学分析
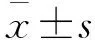
2 结果
2.1 囊重指数和脾脏指数
2.1.1 囊重指数
予不同剂型TA-SM治疗15天时,囊重指数无统计学差异(P>0.05)。治疗30、60天时,片剂组囊重指数明显低于水剂组(P<0.01)。水剂组和片剂组小鼠治疗时间越长效果越好(P<0.05)。详细数据见表2。经过不同剂型的TA-SM治疗后,囊重指数降低,片剂组疗效优于水剂组。
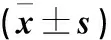
表2 以不同剂型TA-SM治疗后囊重指数比较表Table 2 Comparison of sac weight index after treatment with different formulations of
2.1.2 脾脏指数
予不同剂型TA-SM治疗15天时,片剂组脾脏指数高于水剂组(P<0.05)。治疗30、60天时,片剂组脾脏指数高于水剂组(P<0.01)。片剂组治疗时间越长效果越好(P<0.01)。详细数据见表3。说明不同制剂对棘球蚴病模型小鼠均有效,且片剂组药效优于水剂组。
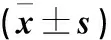
表3 以不同剂型TA-SM治疗后脾脏指数比较表Table 3 Comparison of spleen index after treatment with different formulations of
2.2 淋巴细胞的变化情况
2.2.1 CD4+/CD8+变化情况
结果显示,以不同剂型TA-SM治疗30、60天时,片剂组脾脏组织中的CD4+/CD8+比例高于水剂组(P<0.01)。治疗时间越长,水剂组和片剂组CD4+/CD8+比例越高(P<0.01)。数据详见表4。模型小鼠感染棘球蚴病处于感染晚期(超过4月)时经过TA-SM治疗,CD4+/CD8+上升,说明不同制剂治疗有效,片剂优于水剂,治疗时间越长疗效越好,数据详见表4。
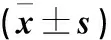
表4 以不同剂型TA-SM治疗后脾脏中CD4+/CD8+比较表Table 4 Comparison of CD4+/CD8+ in the spleen after treatment with different formulations of
2.2.2 T/B细胞变化情况
结果显示,不同剂型TA-SM治疗15、30天时,实验组小鼠脾脏中的T/B<1。治疗60天时,片剂组和水剂组脾脏中的T/B>1,说明细胞免疫功能正在恢复。随治疗时间延长,T/B 淋巴细胞比值增大(P<0.01)。数据详见表5。
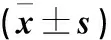
表5 以不同剂型TA-SM治疗后脾脏中T/B比较表Table 5 Comparison of T/B in the spleen after treatment with different formulations of
2.3 基因表达水平
2.3.1 TGF-β1表达水平
治疗15、30、60天时片剂组TGF-β1相对表达量明显低于水剂组(P<0.05)。数据详见表6。TA-SM治疗后TGF-β1相对表达量降低,治疗有效,片剂组优于水剂组。
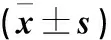
表6 以不同剂型TA-SM治疗后TGF-β1相对表达量Table 6 The relative expression of TGF-β1 after treatment with different formulations of
2.3.2 Gadd45γ表达水平
机体感染棘球蚴病时,虫体蛋白促进肝细胞TGF-β1基因高表达,从而使Gadd45γ的基因表达上调。治疗30天时片剂组Gadd45γ相对表达量明显低于水剂组(P<0.05)。数据详见表7。实验中小鼠肝脏中细胞周期关键调控因子Gadd45γ相对表达量下降,说明药物治疗有效。
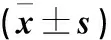
表7 以不同剂型TA-SM治疗后Gadd45γ相对表达量Table 7 The relative expression of Gadd45γ after treatment with different formulations of
2.4 生化指标变化情况
2.4.1 ALP
当胆汁淤积和肝胆管、肝细胞微粒体损伤时,ALP含量会上升。以不同剂型的TA-SM治疗15天时,片剂组ALP明显低于水剂组(P<0.05);治疗30、60天时,片剂组明显低于水剂组(P<0.01)。治疗时间越长,水剂组和片剂组ALP水平越低(P<0.01)。数据详见表8。实验组ALP水平降低说明肝功能处于恢复期,TA-SM对肝脏具有保护作用。
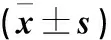
表8 以不同剂型的TA-SM治疗后ALP变化表Table 8 Changes of alkaline phosphatase after treatment with TA-SM of different
2.4.2 GGT
GGT是肝功能和胆道功能的血清生化学指标,肝胆管损伤,胆汁淤积和肝细胞微粒体损伤时,GGT含量会上升。以不同剂型的TA-SM治疗15、30、60天时,GGT变化情况均无统计学差异(P>0.05)。数据详见表9。
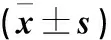
表9 以不同剂型的TA-SM治疗后γ-谷氨酰转肽酶变化表Table 9 Changes of γ-glutamyl transpeptidase e after treatment with TA-SM of different
2.5 Caspase 3蛋白活性
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase 3为关键的执行分子,凋亡早期,Caspase 3被激活,活化的Caspase 3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。从实验结果看,不同剂型的TA-SM治疗15、30、60天时,Caspase 3活性变化情况无统计学差异(P>0.05)。随着治疗时间的延长,Caspase 3活性增强(P<0.05)。数据详见表10。
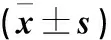
表10 以不同剂型的TA-SM治疗时Caspase 3活性变化情况表Table 10 Changes of Caspase 3 activity after treatment with different formulations of
2.6 形态学表err达结果
水剂组小鼠肝组织中出现炎症因子浸润,片剂组接近正常。各组小鼠肝组织病理形态学HE染色图见图2。

A:15d,水剂组;B:30d,水剂组;C:60d,水剂组;D:15d,片剂组;E:30d,片剂组;F:60d,片剂组(蓝色箭头所指为肝血窦中的红细胞)图2 病理形态学染色图(HE染色,×20)Figure 2 The pathological and morphological staining(HE staining,×20)
3 讨论
目前,棘球蚴病的治疗现状是以手术治疗为主,药物治疗为辅[2]。根据《WHO棘球蚴病治疗指南》,棘球蚴病患者需长期服用苯并咪唑类药物阿苯达唑,但阿苯达唑存在溶解度低、结晶趋势强、口服生物利用度差等问题,同时阿苯达唑类药物会带来肝损伤等副作用,患者的依从性低,严重限制了其在临床上的应用。
砂生槐属豆科槐族槐属,生长于西藏地区,具有极强的抗旱、耐痔薄等特性,子味略苦,可以消炎解毒,主要用于治疗湿热黄疸、痢疾、赤巴病、寄生虫病等。课题组前期研究发现,砂生槐种子中含4种生物碱,分别为苦参碱、氧化苦参碱、槐果碱和槐定碱。这4种生物碱在用于治疗多房棘球蚴病时效果显著,并且通过调节IL2、IL4、IL6、IL10等改善继发性多房棘球蚴病小鼠的免疫功能[1,3],与传统的棘球蚴病药物苯并咪唑类相比,具有毒副作用小的优势[3,4]。TA-SM水剂药物具有良好的亲水性,在生物体内具有吸收快、血药浓度升高迅速的特点。TA-SM片剂是以基于粘附材料海藻酸钠和卡波姆合成的生物粘附片,通过粘附材料增加药物在继发性多房棘球蚴病小鼠体内的滞留时间,从而提高药物吸收速率,增加药物口服生物利用度。
机体最大的免疫器官是脾脏,它由 T、B 淋巴细胞和巨噬细胞等多种免疫细胞组成,其免疫状态和功能改变对于免疫应答有极其关键的作用。T 细胞在抑制多房棘球蚴病的病灶活性或清除棘球蚴病病原体过程中发挥重要作用,CD8+T细胞质量和数量决定着多房棘球蚴病患者临床转归[5,6]。在机体感染棘球蚴病时,通过抗原提呈细胞提呈抗原,诱导T细胞免疫,感染晚期,机体受虫体影响,以Th2介导的体液免疫为主,甚至出现Treg细胞负调节,导致CD4+T细胞凋亡,CD4+/CD8+下降[7,8]。本研究中,继发性多房棘球蚴病感染小鼠超过四个月,机体的免疫应处于以Th2介导的体液免疫为主的时期,CD4+T细胞凋亡,CD4+/CD8+下降,但经药物治疗,CD4+/CD8+上升,且TA-SM片剂组高于水剂组,提示片剂和水剂均有疗效,但片剂疗效高于水剂。
转化生长因子-β(transforming growth factor-β,TGF-β)是一组具有多种生物学功能的细胞因子,对细胞的生长、分化起重要调节作用,在多种生理、病理过程中起重要调节作用[9]。TGF-β1不但参与细胞信号转导、细胞周期调控,而且还参与诱导细胞的凋亡及免疫调节等过程。棘球蚴与宿主交互作用时,会通过诱导炎症性细胞因子TGF-β1参与宿主肝脏病理性损伤过程[10]。TGF-β可激活非经典型MAPK(Mitogen Activated Protein Kinase)信号转导途径和细胞周期关键调控因子Gadd45γ,调控肝脏细胞的生长、抑制或凋亡,导致宿主肝脏的病理性损伤[11]。因此,当机体感染棘球蚴病时,虫体蛋白能够促进肝细胞TGF-β1、Gadd45γ基因表达上调。30天片剂组TGF-β1的表达水平明显低于水剂组,Gadd45γ的表达水平也呈现同样的趋势,说明行TA-SM治疗时,抑制了虫体蛋白导致的TGF-β1、Gadd45γ基因的高表达,治疗有效。30天片剂组明显低于水剂组,提示30天TA-SM片剂组的疗效优于水剂组。
研究表明,ALP和GGT是反映肝功能的重要指标,血液中ALP、GGT升高水平与肝细胞受损程度呈正相关[12]。实验表明,小鼠感染棘球蚴病时,包囊的浸润性生长及其造成的机械性损伤可引起血清中ALP、GGT水平显著升高[13-15]。因此,ALP、GGT水平的检测可反映藏药TA-SM治疗棘球蚴病小鼠时的肝脏功能状态。治疗时,ALP的给药组明显低于模型组,提示TA-SM对继发性多房棘球蚴病小鼠有疗效。感染多房棘球蚴病时,小鼠脾脏指数升高,脾脏代偿性增大[1,4]。经过治疗,脾脏指数不同程度下降,TA-SM片剂组下降更为明显(P<0.05),说明TA-SM片剂组治疗更有利于脾脏恢复。对囊重指数进行分析发现,在给药时囊重指数下降,显示经药物治疗后囊肿缩小。
综上所述,不同剂型的TA-SM治疗继发性多房棘球蚴病小鼠时,CD4+/CD8+表达上调,TGF-β1、Gadd45γ的表达水平下降,血清中的ALP含量降低,脾脏指数上升,囊重指数下降,提示TA-SM治疗继发性多房棘球蚴病小鼠有效,且片剂疗效高于水剂。
