2%氧浓度下H9C2细胞缺氧/复氧模型的优化※
2022-05-03宫佰会马春秀寇毅英李永芳
宫佰会,马春秀,寇毅英,李永芳*
(青海大学医学院,西宁 810001)
以往利用2%氧浓度下的H9C2细胞缺氧/复氧模型所得研究结果备受质疑,可能与研究模型未考虑高原条件有关。本研究拟选用三气培养箱,摸索、建立高原环境下最佳培养条件,拟解决在高原环境下,以往研究模型可重复性差、稳定性差、可控性差的问题。
1 材料与方法
1.1 材料
1.1.1 实验细胞
细胞H9C2(2-1)大鼠心肌细胞株,武汉普诺赛生命科技有限公司,批号CL-0089。
1.1.2 实验试剂
DMEM培养基,武汉普诺赛生命科技有限公司,批号:WH01132012SP02;0.25%胰蛋白酶-EDTA,北京索莱宝生物科技有限公司,批号:20200728;胎牛血清,依科赛生物技术有限公司,批号:111360;双链霉素,北京索莱宝生物科技有限公司,批号:20200429;CCK-8细胞活性试剂盒,Elabscience公司,批号:E-CK-A362;1×PBS无菌磷酸盐缓冲液,北京索莱宝生物科技有限公司,批号:20201219;乳酸脱氢酶LDH试剂盒,南京建成生物工程研究所,批号:20201225。
1.1.3 实验仪器
CO2培养箱,上海力康公司;H100移动式三气培养箱,上海力康公司;倒置显微镜,徕卡显微系统(上海)有限公司;超净工作台,苏州安泰空气技术有限公司;高压灭菌锅,上海申安医疗器械厂;酶标仪,赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 细胞培养
取H9C2(2-1)细胞株,观察细胞形态是否异常,若无异常,于常氧培养箱(37℃,5%CO2)中适应环境并等待细胞贴壁,弃上清液并用无菌PBS清洗三遍,将消化细胞放在常氧培养箱中,1 min后取出细胞于倒置显微镜下观察,出现细胞形态变圆且漂浮量较大的情况时置超净工作台,用含1%双抗、10%FBS培养基终止消化并吹打均匀,更换新的培养皿继续培养,待处于对数生长期时进行实验。
1.2.2 心肌细胞缺氧/复氧模型建立
待H9C2细胞生长到对数生长期时消化并计数,将含1%双抗、10%胎牛血清的DMEM按一定比例进行稀释并接种到96孔板上,置其于培养箱(37℃,5%CO2)培养24 h后分组:正常组(N组)和模型组(M组)。正常组置常氧培养箱(37℃,5%CO2)培养,模型组置三气培养箱(2%O2)培养,待培养环境内气体浓度达到缺氧条件时开始计时,M1、M2、M3、M4、M5组缺氧时间分别为4、6、8、10、12 h,复氧时间均为4 h[1],将37 ℃、5%CO2作为复氧条件。考察2%氧浓度和不同缺氧时间下的心肌细胞形态变化情况、心肌细胞存活率和LDH活性。
1.2.3 细胞形态学观察
按“1.2.2”项下所述方法造模,造模成功后于倒置显微镜(200×)下观察细胞状态(细胞壁结构、死细胞数量)。
1.2.4 细胞存活率检测
用CCK-8法检测细胞存活率。心肌细胞分组同“1.2.2”项,另设空白组(只加空白培养基,不接种细胞),每组设 6 个复孔。复氧结束后,配置CCK-8溶液(按总体积的10%)并孵育(37℃,1h),用酶标仪测定450 nm 处吸光度值(A)。
计算细胞存活率(%):(模型组-空白组)/(阴性对照组-空白组)×100%。
1.2.5 细胞LDH活性测定
心肌细胞分组同“1.2.2”项,复氧结束后,每孔吸出细胞上清液作为待测样品。按试剂盒要求加入相应试剂测定450 nm处吸光度值(A)。
1.2.6 心肌细胞缺氧/复氧模型培养条件的优化
在确定模型复制方法为三气培养箱法后,为优化模型细胞培养条件,采用正交试验设计法,以缺氧时间(A)/复氧4 h、空白血清比例(B)[2]、含糖量(C)为考察因素,设计L9(33)正交试验因素水平表(表1),对影响缺氧/复氧模型复制的条件进行优化。对H9C2心肌细胞计数并分为9组实验,将细胞存活率和LDH作为模型优化指标。
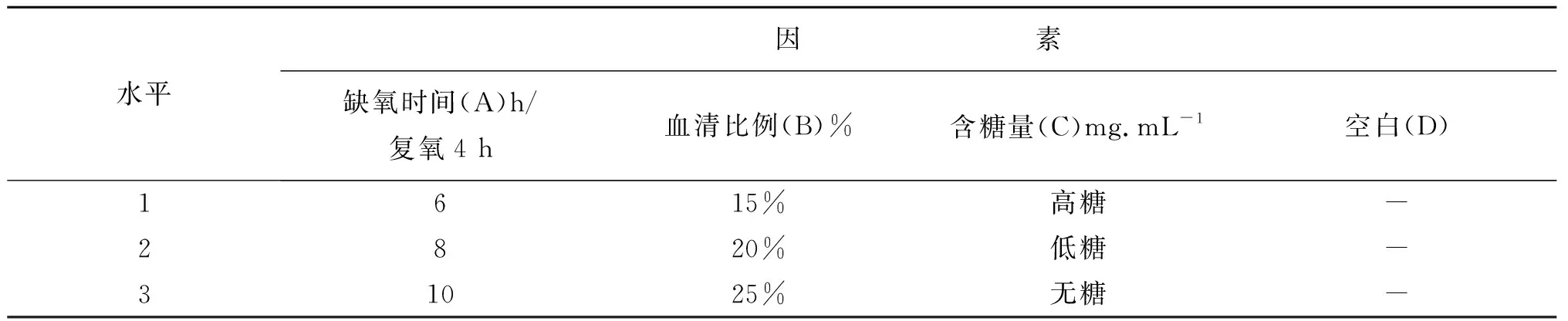
表1 正交试验因素水平表Table 1 Factor levels of orthogonal test
1.3 统计学方法

2 结果
2.1 缺氧/复氧的细胞形态变化情况
与正常组比较,缺氧4h/复氧4h时,细胞壁清晰,细胞质内颗粒物增多,心肌细胞死亡极少;缺氧6h/复氧4h时,细胞壁出现破损,心肌细胞形态发生轻微改变;缺氧8h/复氧4h时,细胞质内颗粒物近一步增多,大多数心肌细胞形状变得短粗,细胞壁破损明显;缺氧10h/复氧4h时,细胞壁结构不完整,细胞存活量少;缺氧12h/复氧4h时,细胞壁形状不规则者增加,细胞数量减少显著,死细胞数量显著增加,损伤进一步加重。(图1)
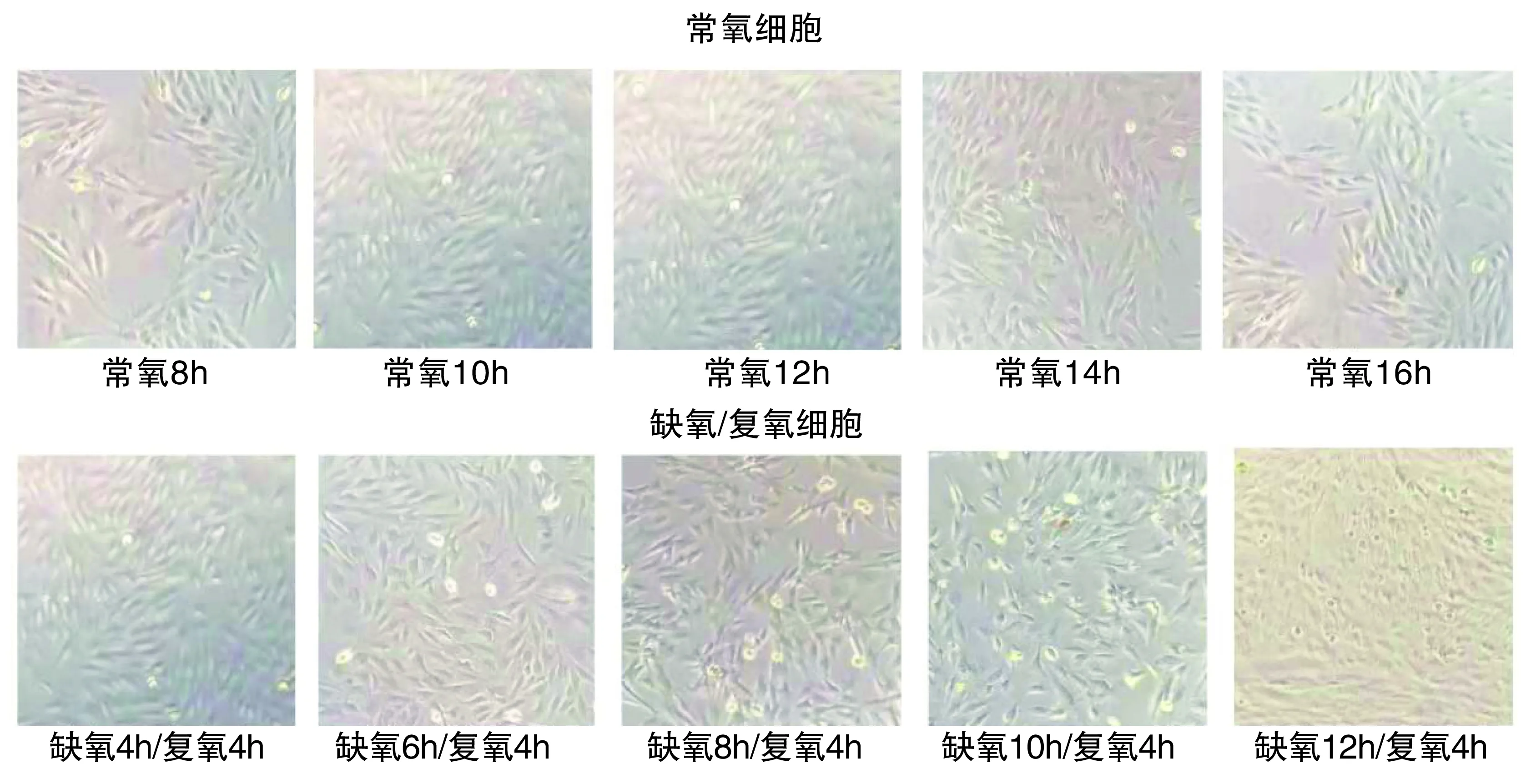
图1 H9C2细胞的形态学变化图(200×)Figure 1 Morphological changes of H9C2 cardiomyocytes(200×)
2.2 2%氧浓度及缺氧/复氧时间对H9C2心肌细胞存活率的影响情况
与正常组比较,缺氧4h/复氧4h、缺氧6h/复氧4h、缺氧8h/复氧4h、缺氧10h/复氧4h、缺氧12h/复氧4h组心肌细胞存活率随缺氧时间延长逐渐下降,具有统计学差异。(P<0.05)(表2)

表2 不同缺氧/复氧时间对H9C2细胞存活率的影响结果Table 2 Effects of different hypoxia / reoxygenation times on the viability of H9C2
2.3 不同时间缺氧/复氧4 h对H9C2心肌细胞LDH的影响情况
与正常组比较,缺氧/复氧各组LDH活性明显升高(P<0.05),且随着缺氧时间的延长,LDH活性升高越明显。(表3)

表3 不同时间缺氧/复氧4h对细胞LDH活性的影响Table 3 Effect of hypoxia at different time and reoxygenation for 4h on LDH
2.4 模型培养优化结果
正交试验结果从极差值(Rj)来看,缺氧时间(A因素)/复氧4h和血清比例(B因素)对模型优化的影响最大,含糖量(C因素)次之。细胞存活率正交试验中缺氧时间F=26.183,P<0.05,血清F=27.887,P<0.05,含糖量F=0.963,P=0.391;细胞LDH正交试验中含糖量F=103.115,P<0.05,缺氧时间F=1.467,P=0.243,血清F=1.545,P=0.226。以细胞存活率和LDH初步判定:H9C2心肌细胞缺氧/复氧模型的优化培养条件为缺氧8h/复氧4h、无糖、20%血清。(表4~5)

表4 细胞存活率正交试验结果Table 4 Orthogonal test results of cell
表5 细胞存活率正交试验结果乳酸脱氢酶正交试验结果Table 5 Orthogonal test of lactate
3 讨论
H9C2细胞株是从大鼠胚胎心肌细胞分离得到的,可稳定传代并保持遗传信息不变,在心脏损伤后可保有增殖能力,易于存活和培养,是心肌细胞缺氧/复氧模型常用的心肌细胞株之一。缺氧/复氧模型常用的制备方法有化学法和物理法。其中,化学法包括二亚硫酸钠(Na2S2O4)耗氧法、氯化钴(CoCl2)培养法;物理法包括三气培养箱法、厌氧箱法、厌氧罐法、低氧/厌氧工作站法、液体石蜡封闭法、安宁包厌氧法。化学法的弊端在于稳定性不好,且有毒,并且需要摸索化学试剂的用量和作用时间。液体石蜡法和安宁包厌氧法的弊端在于不容易控制氧气的浓度。厌氧箱、厌氧罐法和低氧/厌氧工作站法的弊端在于厌氧产气袋模型组的细胞存活率和LDH活性均不随时间呈规律性变化,系统达到预定气体浓度所需时间较长,密闭性能也不如三气培养箱法,难以较长时间保持培养环境气体的稳定性[3]。
CCK-8法是一种测定细胞存活率的比色方法,可对其受损程度进行评估。LDH是细胞代谢、能量传递、免疫调节的重要物质,其主要存在于心肌细胞浆和心肌组织中,当心肌细胞受到外界影响时,LDH释放量增加,血清或细胞培养基活性增高,可作为诊断心肌细胞损伤的重要标志物。从形态变化发现,在缺氧时间增加、复氧时间不变的条件下,心肌细胞质内颗粒物不断增加,心肌细胞壁的损伤程度逐渐加重,心肌细胞外形结构不断皱缩,死亡心肌细胞数量不断增加。细胞存活率和LDH结果显示,在2%氧气浓度下,H9C2细胞缺氧4h/复氧4h、缺氧6h/复氧4h、缺氧8h/复氧4h、缺氧10h/复氧4h、缺氧12h/复氧4h均可引起心肌损伤(细胞存活率下降、LDH活性升高、心肌细胞形态变化等),且随缺氧时间的增加,细胞存活率下降、LDH释放量增多更明显,心肌损伤逐渐加重。说明这几种制备方法均可创建心肌细胞缺氧/复氧损伤模型。
为了建立稳定性、可控性、可重复性较好的细胞缺氧/复氧模型,本课题采用正交试验法,从多个方面进行考虑和实验,排除单一因素对缺氧/复氧实验的干扰,将多种影响因素综合分析,选出最佳的实验方案。本实验对大鼠血清和有关培养基的含糖量进行了筛选,通过正交试验设计法对三气培养箱法建立的相关模型条件进行了摸索、优化,选择以细胞存活率和LDH为判定指标来确定模型优化条件。从正交试验的结果来看,随缺氧时间的延长和血清浓度的上升,细胞存活率逐步上升,细胞活力在缺氧8h/复氧4h和缺氧10h/复氧4h时最低;但随着含糖量和血清比例的改变,细胞存活率呈现一定的波动;时间和血清对模型复制的影响最大,含糖量次之。在LDH的结果中,随细胞缺氧时间延长,LDH呈现波动式改变。在综合分析细胞存活率和LDH时发现,在6 h时,LDH的上升可能是由于细胞生长空间达到负荷而导致细胞生长性死亡;在8 h时,由于细胞在15%低糖缺氧状态下仍然能够正常生长致LDH释放较少,在20%无糖缺氧状态下,由于发生损伤致LDH释放量增大,在25%高糖缺氧状态下,细胞因无太大损伤致LDH释放量较低;在10 h时,在15%无糖缺氧状态下,由于细胞存活率低并且随缺氧时间的延长和血清浓度的降低造成细胞LDH释放量增加,对细胞造成的伤害更加严重,20%高糖缺氧的细胞存活率较高、LDH释放率较低,对细胞造成的伤害不明显,25%低糖缺氧的细胞存活率较高、LDH释放率较低,原因可能是25%血清对细胞在缺氧/复氧中的损伤有一定的缓解作用,降低了其在缺氧/复氧中的损伤程度。综合判断,缺氧时间和大鼠空白血清浓度是缺氧/复氧模型建立过程中最大的影响因素,同时糖分的缺失会加速心肌细胞损伤。但随缺氧时间延长,细胞会逐步适应培养环境,活力回升,消耗营养物质增多,不利于模型的建立。因此,优化的缺氧/复氧模型条件为20%大鼠空白血清、无糖培养基、缺氧(2%氧浓度)8 h;正常培养基、常氧(21%氧浓度)4 h。
综上所述,优化的2%氧浓度下H9C2细胞缺氧/复氧模型的稳定性、可控性、重复性较好,但也存在不足,仅考虑了培养基中含糖量、缺氧时间及大鼠空白血清等因素对模型的影响,未充分考虑三气培养箱中不同氧气浓度对细胞缺氧造成的损伤和不同复氧时间对细胞造成的损伤。
