岩藻多糖调节JAK2/STAT3信号通路保护神经元免受缺氧缺糖/再灌注损伤※
2022-05-03刘川川樊海宁
巨 虎,刘川川,王 虎,樊海宁&
(1.青海大学附属医院神经外科,西宁 810001;2.青海省包虫病重点实验室,西宁 810001;3.青海大学附属医院肝胆胰外科,西宁 810001;4.青海省卫生健康委员会,西宁 810001)
最新研究显示,岩藻多糖(Fucoidan,Fu)的使用有效降低了神经功能缺损评分,减小了脑梗死缺血灶区域[1],但其作用机制不明,本研究拟用缺氧缺糖/再灌注(Oxygen and glucose deprivation/reperfusion,OGD/RP)模型开展相关研究。
1 材料与方法
1.1 主要试剂仪器
大鼠PC12细胞、DMEM培养基、青霉素-链霉素混合液、0.25%胰蛋白酶溶液购于武汉Procell公司;胎牛血清、马血清购于美国Gibco公司;岩藻多糖购于美国Sigma公司;线粒体膜电位检测试剂盒RIPA、蛋白裂解液、ECL发光液、蛋白定量试剂盒购于美国ThermoFisher公司;Annexin V FITC/PI染色试剂盒购于美国BD Biosciences公司;Bax、Bcl-2、cleaved caspase-3、LC3 I/II、JAK2、p-JAK2、STAT3、p-STAT3和β-actin抗体购于武汉Abclonal公司;JAK2抑制剂WP1066购于Selleck公司。NanoDrop 2000紫外分光光度计、CO2细胞培养箱购于美国ThermoFisher公司;全自动酶标仪购于瑞士Tecan公司;三气培养箱购于德国BINDER公司;蛋白电泳仪购于美国Bio-Rad公司;流式细胞仪购于美国艾森公司。
1.2 实验方法
1.2.1 细胞培养方法
大鼠PC12细胞用含有10%胎牛血清、5%马血清和1%青霉素-链霉素溶液的高糖DMEM培养基置培养箱(37℃,5%CO2),每两天以2/3的比例更换培养基。
1.2.2 OGD/RP和药物处理方法
用1 μM的FU处理细胞24 h,再加入Earle′s平衡盐溶液(EBSS)来制备OGD/RP模型。然后,将细胞转移到含有5%CO2、95%N2的厌氧箱中,在37 ℃下放置4 h行缺氧处理,之后再放入含氧正常的培养箱中培养24 h。对照组的细胞没有经过OGD/RP和FU处理,而是在正常的DMEM培养基中培养(37℃,常氧条件下培养24h)。当加入JAK/STAT抑制剂WP1066干预时,PC12细胞用10 μM WP1066预孵育30 min,经OGD/RP处理前用1 μM FU处理24 h。
1.2.3 细胞活力检测方法
使用CCK-8试剂盒检测细胞活力。将对数生长期的PC12细胞按照1×104个/孔接种到96孔细胞培养板,每组设置6个复孔,经过不同条件的处理后,加入10 μL CCK-8试剂,根据试剂盒说明书所示方法检测PC12细胞的活力。在450 nm处检测各组吸光度值。
1.2.4 细胞凋亡检测方法
使用Annexin V FITC/PI染色试剂盒按照说明书所示方法检测PC12细胞凋亡情况。将对数生长期的PC12细胞按照1×104个/孔接种到96孔细胞培养板,每组设置3个复孔。经过不同条件的处理后,将细胞密度调整为1×105个/管。细胞用Binding Buffer洗涤后,加100 μL Binding Buffer重悬细胞,并加入5 μL Annexin V FITC、5 μL PI,在室温下避光染色15 min。细胞用Binding Buffer洗涤后,加200 μL Binding Buffer重悬细胞,用流式细胞仪检测。
1.2.5 抗氧化剂酶含量检测方法
收集经处理后的PC12细胞上清液,用超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)酶联免疫吸附试验试剂盒按照说明书所示方法检测细胞培养上清液SOD、GSH-Px含量。绘制标准曲线计算SOD、GSH-Px浓度。
1.2.6 实时荧光定量聚合酶链反应(RT-qPCR)方法
使用Trizol试剂提取各组细胞总RNA。使用紫外分光光度计测定RNA浓度和纯度,以1%琼脂糖凝胶电泳法检测RNA完整性。在每组细胞的总RNA中各取2 μg RNA,按照cDNA第一链合成试剂盒说明书所示方法将总RNA反转录为cDNA。qPCR特异性引物由上海生工生物公司合成,序列:HO-1 F,5′-TGC TCA ACA TCC AGC T-3′,R:5′-GCA GAA TCT TGC ACT T-3′;GCLC F,5′-CTC CTC ACA GTC ACG GCA TT-3′,R:5′-TGA ATG GAG ACG GGT TG-3′;GCLM F:5′-AAG CCA GAC ACT GAC ACA CC-3′,R:5′-ATC TGG AGG CAT CAC ACA GC-3′;β-actin F:5′-CAT GTA CGT TGC TAT CCA GGC-3′,R:5′-CTC CTT AAT GTC ACG CCA CGAT-3′。按照SYBR®qPCR Master Mix检测试剂盒配制反应体系,用Quant Studio 5荧光定量PCR仪进行PCR实验,反应条件:95 ℃,15 min;95 ℃,10 s;60 ℃,30 s;共计40个循环。以β-actin为内参基因,用2-ΔΔCt法计算各基因相对表达量。实验重复三次。
1.2.7 蛋白印迹分析方法
收集各组细胞,用含有PMSF的RIPA裂解液于冰上裂解各组细胞30 min,离心(4℃,12000r/min,10min)后取上清液。用BCA蛋白定量法检测样品总蛋白浓度。煮沸后,将蛋白样品按照30 μg/孔在SDS-PAGE凝胶上进行电泳。电泳结束后将凝胶上的目的蛋白电转(160mA恒流)至PVDF膜,用5%脱脂奶粉在室温下封闭1 h。将膜置一抗Bax、Bcl-2、cleaved-caspase3、LC3 I/II、JAK2、p-JAK2、STAT3、p-STAT3、β-actin孵育(4℃,过夜)。膜经TBST缓冲液洗涤后,加入HRP标记的羊抗兔IgG孵育(室温,1h)。膜经TBST缓冲液洗涤后,用ECL超敏发光液在凝胶光成像仪下检测特异性免疫反应蛋白条带,用Image J软件分析条带灰度值。
1.2.8 活性氧(Reactive oxygen species,ROS)水平检测方法
使用2′,7′-二氯荧光素-二乙酸酯(DCFH-DA)染色液染色后分析PC12细胞中的ROS水平。收集各组PC12细胞沉淀,用PBS清洗三次后,将细胞转移到24孔细胞培养板(1.0×104个/孔),加入10 μM DCFH-DA孵育(避光,30min)后用流式细胞仪分析。
1.2.9 线粒体膜电位(MMP)检测方法
使用荧光探针JC-1检测PC12细胞的线粒体膜电位水平。将PC12细胞加入10 μM JC-1孵育(37℃,30min),将孵育细胞用PBS洗涤一次后加PBS重悬细胞,用流式细胞仪分析。
1.3 统计学方法

2 结果
2.1 FU抑制PC12细胞免受OGD/RP诱导的增殖抑制和避免细胞凋亡
首先,我们确定了FU对PC12细胞活力和细胞凋亡存在影响。CCK-8检测显示,与Control组细胞相比,OGD/RP诱导的细胞活力下降;而经FU处理后,这种情况得到了明显缓解。(表1)与Control组细胞相比,经OGD/RP诱导的细胞凋亡有所增加,而经FU处理后相较于OGD/RP组细胞凋亡率减少。(图1,表2)用蛋白印迹法分析细胞凋亡调节因子(Bax、Bcl-2和cleaved-caspase3)发现,与OGD/RP诱导的细胞相比,经FU处理24 h后Bax、cleaved-caspase3细胞凋亡蛋白表达量明显减少,Bcl-2蛋白表达量增加。(图2,表3)
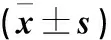
表1 FU处理对PC12细胞增殖的影响值Table 1 Effects of FU treatment on the proliferation of PC12
图1 经FU处理后的PC12细胞凋亡图Figure 1 PC12 cells apoptosis after FU treatment
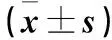
表2 经FU处理后的PC12细胞凋亡率分析结果Table 2 Analysis of PC12 cells apoptosis rate after FU
图2 FU对PC12细胞凋亡相关蛋白表达的影响图Figure 2 Effects of FU on the expression of apoptosis-related proteins in PC12 cells
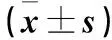
表3 FU对PC12细胞凋亡相关蛋白表达的影响值Table 3 Effects of FU on the expression of apoptosis-related proteins in PC12
2.2 FU减少了由OGD/RP诱导的PC12细胞氧化应激和自噬的发生
脑损伤过程中细胞凋亡的发生伴随有细胞自噬的改变,我们进一步检测了FU是否能抑制OGD/RP诱导的细胞发生氧化应激和自噬。用1 μM FU处理PC12细胞24 h后再经OGD/RP处理,经DCFH-DA染色后用流式细胞仪分析所得结果显示,与对照组细胞相比,OGD/RP能明显提高细胞内ROS水平(P<0.05)。(图3,表4)另外,与OGD/RP诱导的细胞相比,FU处理降低了ROS水平(P<0.05)。(图3,表4)由于抗氧化蛋白(如SOD、GSH-Px)具有预防氧化应激的功能,我们进一步检测了各组细胞中这些蛋白的表达水平。经OGD/RP处理后,SOD、GSH-Px含量明显下降(P<0.05)。(表4)正如预期的那样,与OGD/RP诱导的细胞相比,经FU处理,SOD、GSH-Px表达水平显著增加(P<0.05)。(表4)
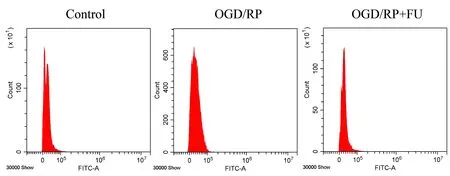
图3 经FU处理后的PC12细胞中的ROS分析图Figure 3 ROS analysis of PC12 cells after FU treatment
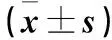
表4 经FU处理后的PC12细胞ROS和培养上清液中SOD、GSH-Px的表达水平Table 4 Expression levels of ROS in PC12 cells and SOD,GSH-Px in supernatant after FU
值得注意的是,氧化应激通常表现为细胞自噬的改变,我们进一步检测了FU处理PC12细胞后对MMP和细胞自噬的影响。结果表明,OGD/RP会导致MMP的损耗(P<0.05),但经FU处理可使MMP损耗减少。(图4,表5)细胞自噬是一种应对损伤的病理生理反应,LC3是一个自噬蛋白的标志物。当自噬发生时,LC3 I被泛素化修饰,并与自噬膜表面的磷脂酰乙醇胺结合形成LC3 Ⅱ。在本研究中,我们用Western blot法来检测LC3自噬蛋白的表达水平。OGD/RP诱导的PC12细胞的LC3的表达水平增加(图5,表5),而经FU处理,LC3蛋白的表达水平降低。这些结果表明,经FU处理可以保护PC12细胞免受OGD/RP引起的氧化损伤和自噬。
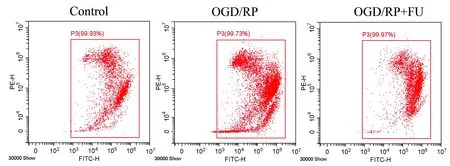
图4 经FU处理PC12细胞线粒体膜电位图Figure 4 Mitochondrial membrane potential of PC12 cells after FU treatment
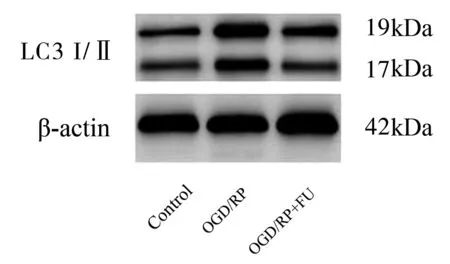
图5 FU对PC12细胞LC3 I/II蛋白表达的影响图Figure 5 Effects of FU on the expression of LC3 I/II protein in PC12 cells
表5 FU对PC12细胞MMP水平和LC3 I/II蛋白表达的影响值Table 5 Effects of FU on the level of MMP and the expression of LC3 I/II protein in PC12
2.3 FU能抑制OGD/RP诱导的PC12细胞JAK2/STAT3水平
我们进一步确认了FU处理PC12细胞是否影响JAK/STAT信号通路的改变,明确了FU对OGD/RP诱导的JAK/STAT信号通路激活的影响(图6,表6)。与Control组相比,OGD/RP能显著增强JAK2和STAT3的磷酸化水平(P<0.05)。与OGD/RP组相比,FU处理能抑制OGD/RP诱导的JAK2/STAT3的激活。这些结果表明,FU的抗OGD/RP作用可能通过抑制JAK2/STAT3的途径来实现。
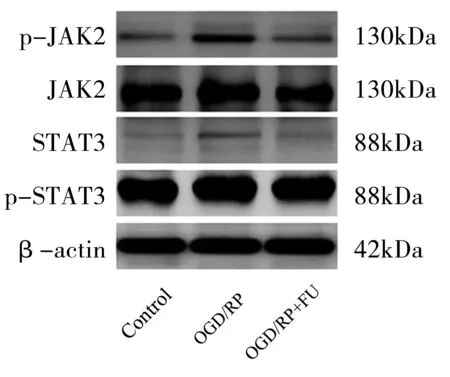
图6 FU对PC12细胞JAK/STAT信号通路蛋白表达的影响图Figure 6 Effects of FU on the protein expression of JAK/STAT signal channel in PC12 cells
表6 FU对PC12细胞JAK/STAT信号通路蛋白表达的影响值Table 6 Effects of FU on the protein expression level of JAK/STAT signaling pathway channel in PC12
2.4 FU通过介导JAK2/STAT3信号通路实现对OGD/RP的抗损伤作用
为了进一步验证FU抗OGD/RP引起的凋亡和自噬作用是否与JAK/STAT信号通路相关,我们使用JAK/STAT抑制剂WP1066后进一步检测细胞凋亡和自噬相关改变情况。首先,我们检测了FU和WP1066共同作用于PC12细胞后对抗氧化剂酶含量的影响。结果表明,与经FU+OGD/RP处理的细胞相比,WP1066组的细胞培养上清液中抗氧化酶SOD、GSH-Px的含量增加,但差异无统计学意义(P>0.05)。(表7)进一步检测经WP1066和FU处理后的MMP水平,结果显示,与经FU+OGD/RP处理的细胞相比,经WP1066处理的MMP水平增加(P<0.05)(图7,表8);而ROS水平有降低的趋势,但无统计学意义(P>0.05)(图8,表8)。
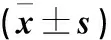
表7 经FU和WP1066共处理的PC12细胞培养上清液中SOD、GSH-Px的比较结果Table 7 Comparison of SOD and GSH-Px in PC12 cells culture supernatants co-treated with FU and
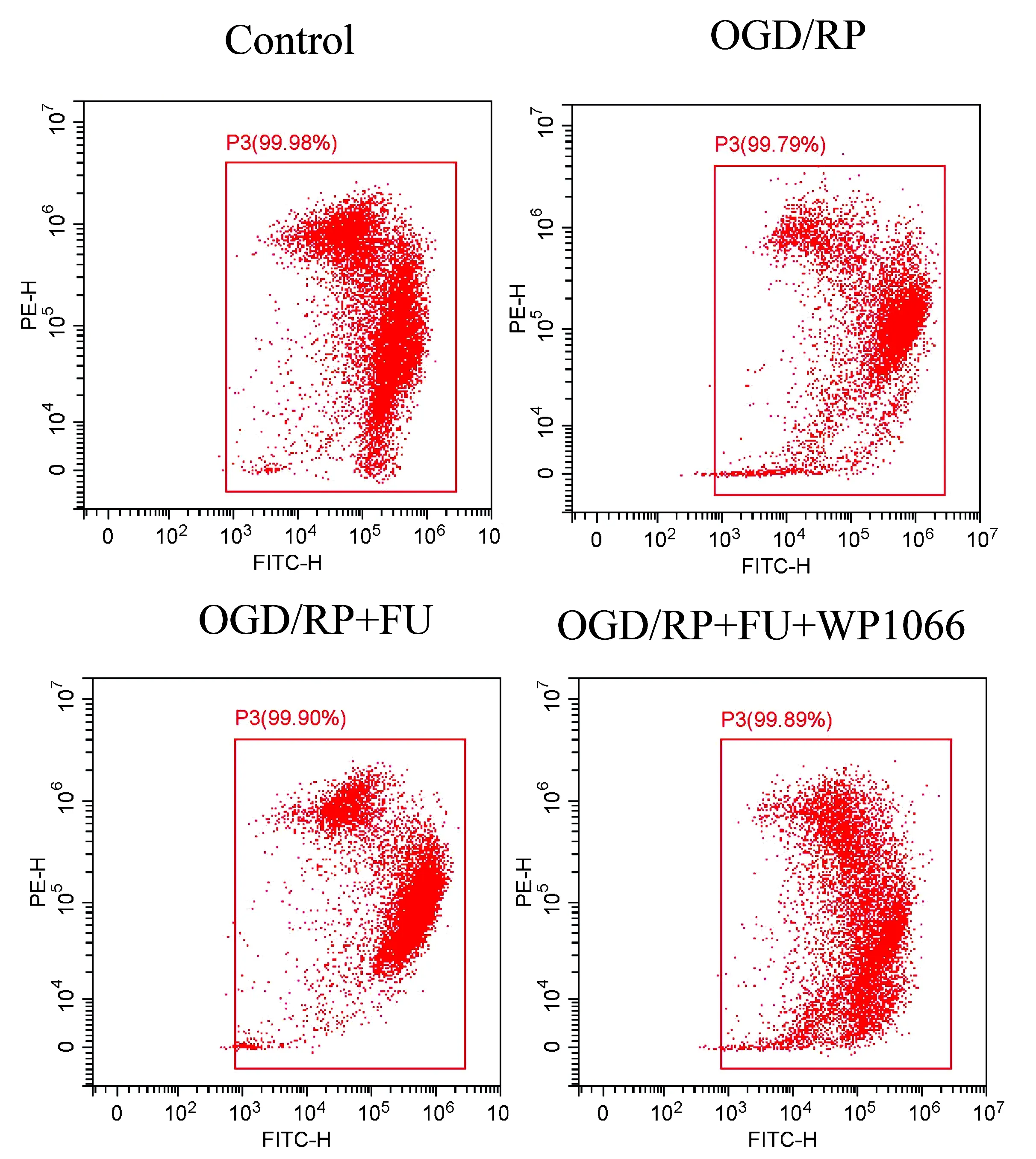
图7 经FU和WP1066共处理PC12细胞对MMP的影响图Figure 7 Effects of PC12 cells co-treated with FU and WP1066 on MMP
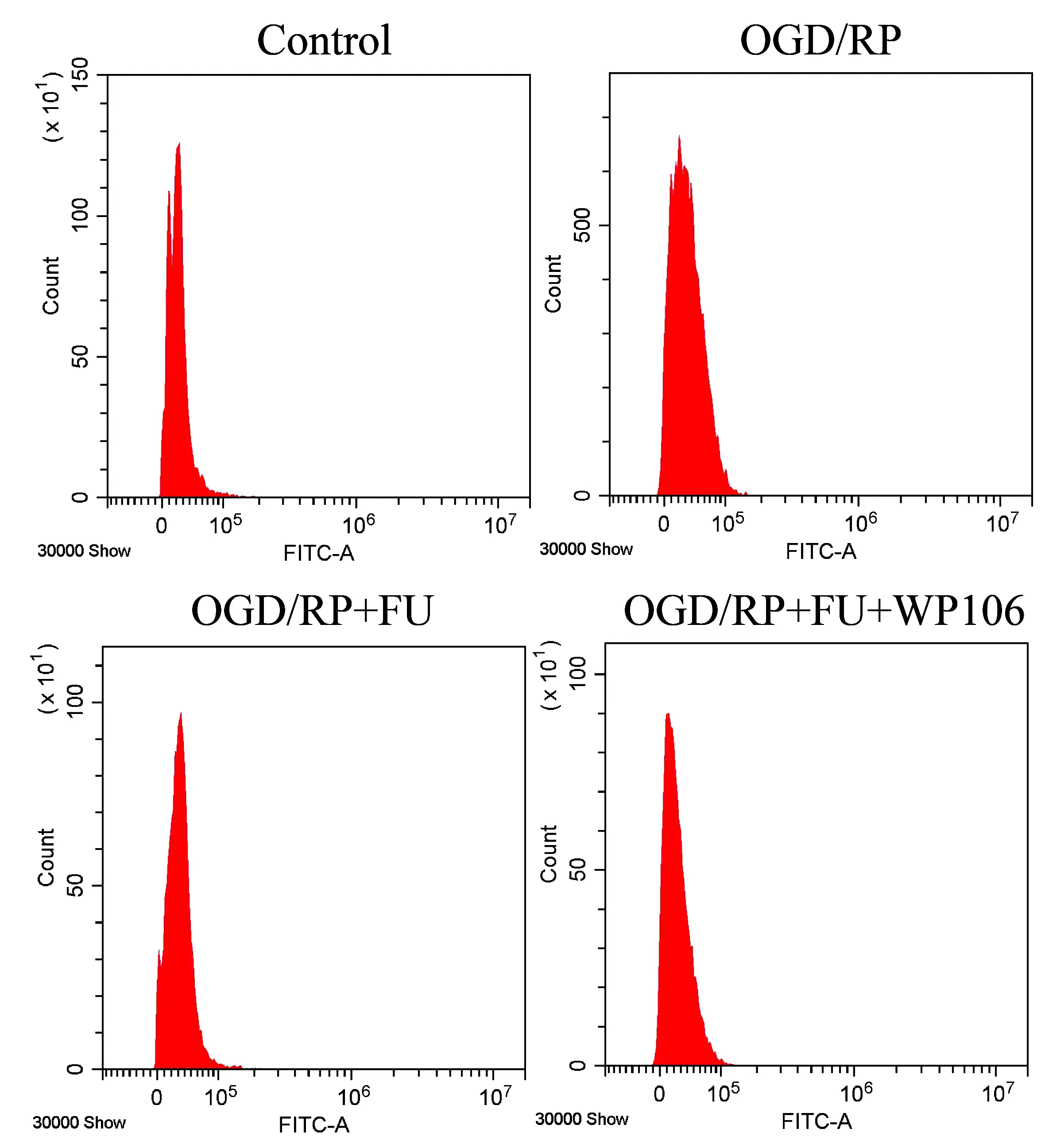
图8 经FU和WP1066共处理的PC12细胞对ROS的影响的流式分析图Figure 8 Flow cytometric analysis of PC12 cells co-treated with FU and WP1066 on ROS
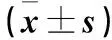
表8 经FU和WP1066共处理的PC12细胞MMP和ROS的比较结果Table 8 Comparison of MMP and ROS in PC12 cells co-treated with FU and
最后,我们研究了WP1066抑制剂对细胞凋亡和自噬相关蛋白的影响情况。蛋白印迹分析证明,与OGD/RP+FU组相比,经WP1066处理能增强FU效果、抑制PC12细胞凋亡(P<0.05)(图9,表9);而LC3 I/II有减少的趋势,但差异无统计学意义(P>0.05)(图9,表9)。这些发现进一步表明,抑制JAK2/STAT3信号通路能加强FU抗OGD/RP引起的细胞凋亡和自噬作用。
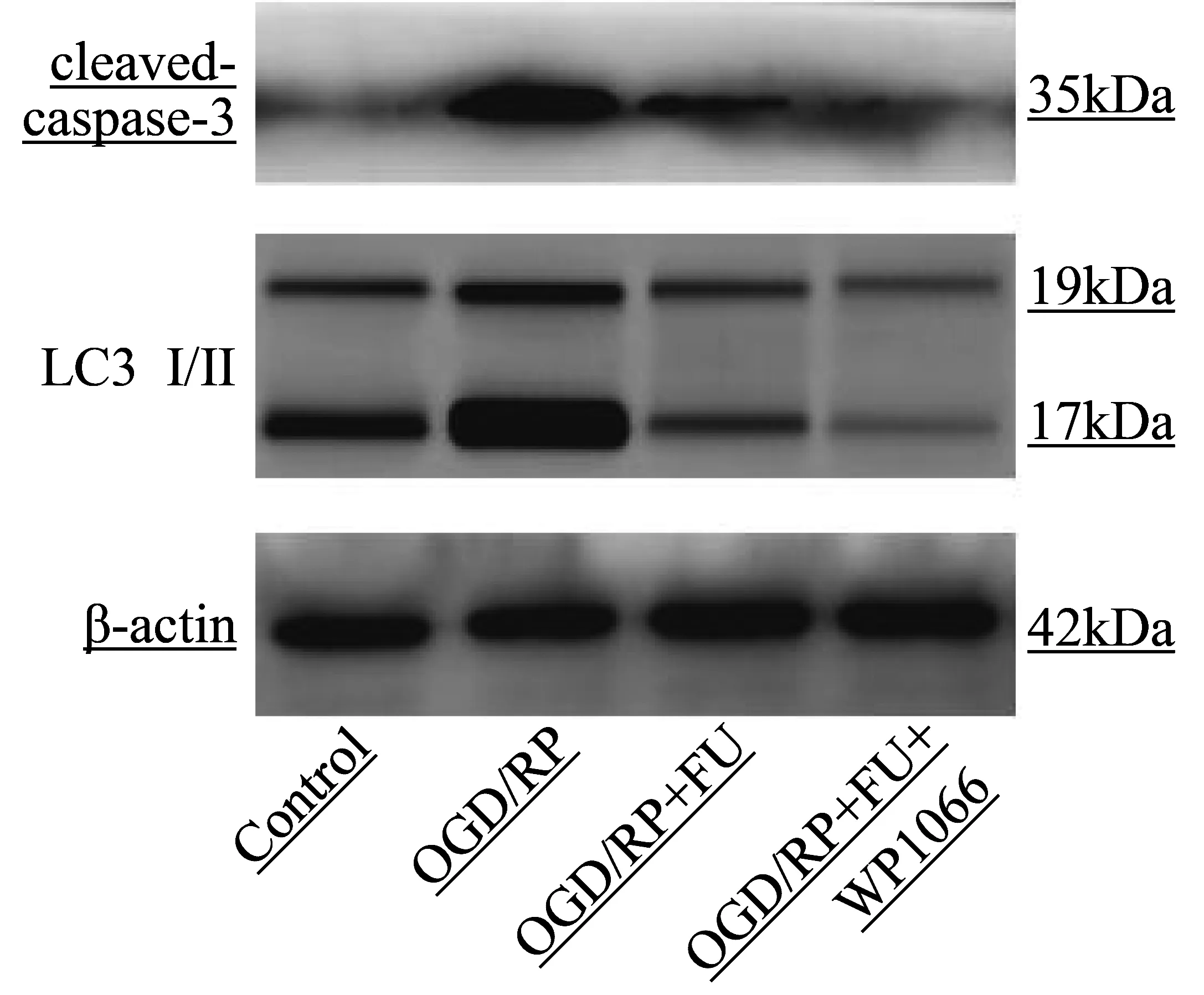
图9 经FU和WP1066共处理的PC12细胞凋亡和自噬蛋白分析图Figure 9 Apoptosis and autophagy protein analysis of PC12 cells co-treated with FU and WP1066
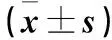
表9 FU和WP1066共处理对PC12细胞凋亡和自噬蛋白表达的影响值Table 9 Effects of co-treatment of FU and WP1066 on apoptosis and autophagy protein expression of PC12
3 讨论
缺血性脑卒中是最常见的中风类型。它是一种常见的临床疾病,通常会导致血管和神经元损伤。神经元损伤是脑缺血性卒中患者长期致残的主要原因。然而,目前还没有有效的方法来治疗神经损伤。因此,迫切需要筛选抗神经元损伤药物。在本研究中我们发现,岩藻多糖能逆转OGD/RP引起的细胞增殖抑制,降低细胞凋亡和自噬的发生。此外,FU能通过JAK1/STST3通路调节PC12细胞凋亡和自噬过程。
缺血性脑卒中发生时,以脑血管为主导的区域中心会形成核心区和周围的缺血半影区,核心区神经元出现坏死,缺血半影区神经元出现凋亡(是保护的关键)[2]。脑缺血后,与细胞凋亡相关的蛋白,如Bcl-2、Bax、Cleaved-caspase-3发生变化[3]。此外,有证据表明氧化应激产生的ROS可以介导细胞凋亡[4]。之前的研究证实,经OGD/RP诱导后的ROS含量明显增加[5],这与我们的研究一致。细胞增殖和凋亡的动态平衡对维持环境稳态具有重要作用。OGD/RP处理会抑制细胞的活力、促进PC12细胞凋亡和抑制抗氧化酶SOD、GSH-Px表达。而经FU处理可以明显抑制OGD/RP引起的细胞凋亡,并促进抗氧化酶SOD、GSH-Px的表达。这些结果表明FU能通过抑制细胞凋亡和促进抗氧化酶表达保护神经元免受OGD/RP引起的损伤。
越来越多的数据证实细胞凋亡和自噬之间存在复杂关联。自噬可以通过抑制caspase维持细胞存活[6]。自噬专门降解聚集的蛋白质和受损的细胞器,维持细胞平衡[7]。实际上,细胞在较低的基础水平时通过自噬来维持稳态。先前的研究表明,自噬在早期脑损伤时具有神经保护作用,其保护作用至少部分是通过其抗凋亡作用实现的。本研究显示,FU能拮抗OGD/RP造成细胞线粒体膜电位升高和自噬的发生,通过使用WP1066抑制剂证实FU抑制自噬的发生是通过JAK2/STAT3信号通路来实现的。有证据显示,OGD/RP可以激活自噬,被激活的自噬可能是OGD/RP导致神经元损伤的一个因素[8]。相反,也有研究显示,被激活的自噬对大鼠局灶性脑缺血有神经保护作用[9]。值得注意的是,我们的研究结果与之前的研究结果不同,之前的研究认为FU以一种不依赖caspase的方式提高自噬体的含量和细胞死亡率[10]。
大量证据证明[11,12],FU是JAK/STAT信号通路抑制剂,可以降低各种肿瘤细胞的STAT3激活水平,最终抑制肿瘤的生长。JAK/STAT信号通路是一条重要的细胞内信号通路,参与了神经元的生长、发育、分化、衰老等过程,并与脑缺血、脑肿瘤等神经系统病理过程密切相关[13,14]。在PC12细胞中,OGD/RP损伤可上调L型Ca2+通道和促进ROS的产生,增加Ca2+的流入,从而触发了包括STAT3在内的缺氧平衡转录因子的表达[15]。在大鼠大脑中动脉闭塞模型中,脑组织的神经元和星形胶质细胞中STAT3的磷酸化明显增强[16,17]。在缺血性脑损伤中,JAK/STAT信号通路的内在机制包括调节细胞凋亡[18]、抑制神经炎症[19]和改善氧化压力[15]。目前,还没有关于JAK/STAT信号通路调节缺血性脑损伤中神经元自噬过程的研究。我们的研究结果显示,对于OGD/RP诱导的PC12细胞,FU能抑制PC12细胞的凋亡、自噬和氧化应激反应,同时FU还能调控JAK2/STAT3信号通路增强该抑制作用。
综上所述,FU使OGD/RP诱导的PC12细胞免受氧化应激、自噬和凋亡作用,FU的神经保护作用可能是通过抑制JAK/STAT信号通路实现的。
