肝移植受者术后结直肠腺瘤性息肉发生情况及危险因素分析
2022-05-02姜晓青饶伟张鹏姜英俊孔心涓解曼
姜晓青 饶伟 张鹏 姜英俊 孔心涓 解曼
2021年发布的癌症数据显示,结直肠癌已成为我国第2大常见恶性肿瘤,死亡病例数居第5位[1]。在肝移植受者中,新发结直肠癌占我国肝移植术后全部新发恶性肿瘤的13.7%[2],占新发消化系统恶性肿瘤的34%[3],术后结直肠癌发生风险为普通人群的2.0~12.8倍[4-7]。有研究显示新发恶性肿瘤已成为肝移植受者术后远期死亡的主要原因之一[8-11]。《结直肠癌筛查与早诊早治指南(2020,北京)》将结肠镜作为结直肠癌筛查的金标准,系统评价显示与未做结肠镜筛查相比,结肠镜筛查可以降低56%的发病风险以及57%的死亡风险[12]。结直肠腺瘤性息肉(colorectal adenomous polyps,CAP)占全部结直肠癌癌前疾病的85%~90%甚至更多,研究显示通过内镜下摘除CAP可以有效预防75%的结直肠癌发生[13]。目前国内少有关于肝移植术后CAP的统计研究,本文通过分析青岛大学附属医院肝移植受者资料,为我国肝移植受者术后结直肠癌的防治提供参考。
1 资料与方法
1.1 研究对象
选取2016年2月至2020年1月在青岛大学附属医院行结肠镜检查的肝移植受者77例,以结肠镜检查为随访终点。其中男57例,女20例;年龄(58±9)岁;原发病包括乙型病毒性肝炎(乙肝)肝硬化27例,乙肝肝硬化合并原发性肝细胞癌(肝癌)26例,自身免疫性肝硬化7例,肝癌4例,隐源性肝硬化3例,酒精性肝硬化2例,丙型病毒性肝炎(丙肝)肝硬化1例,丙肝肝硬化合并肝癌1例,乙肝合并肝癌1例,酒精性肝硬化合并肝癌1例,先天性多囊肝合并乙肝肝硬化1例,乙肝合并丙肝肝硬化1例,乙肝合并丙肝肝硬化肝癌1例,乙肝合并药物性肝硬化1例。
肝移植术后结肠镜检查中位时间为34个月,<6个月2例,6个月~3年37例,3~5年23例,>5年15例。所有受者均采用以钙调磷酸酶抑制剂为基础的免疫抑制方案(他克莫司或环孢素+吗替麦考酚酯+糖皮质激素),均服用过他克莫司,14例联合应用西罗莫司(雷帕霉素),10例曾服用环孢素。根据受者CAP的发生情况,分为CAP组(28例)和非CAP组(49例)。
通过年龄、性别行1∶3倾向性评分匹配,选取2018年7月至2019年6月行结肠镜检查的体检者231例,其中男171例,女60例,年龄(58±9)岁。
1.2 排除标准
肝移植受者排除标准:(1)年龄不满18岁;(2)肝移植前已有CAP或结直肠癌;(3)有CAP或结直肠癌家族史;(4)合并人类免疫缺陷病毒感染;(5)合并炎性肠病;(6)结肠镜检查前行结直肠手术;(7)二次肝移植或联合其他器官移植;(8)移植后结肠镜检查时间<3个月;(9)资料不完整。
体检者排除标准:(1)年龄不满18岁;(2)合并炎性肠病;(3)结肠镜检查前行结直肠手术;(4)资料不完整。
1.3 研究内容
分析肝移植受者和体检者结直肠息肉的发生情况及病理检查结果。收集肝移植受者的临床资料,包括移植时年龄、检查时年龄、性别、体质量指数(body mass index,BMI)、吸烟史、饮酒史、合并症(高血压和糖尿病)、术后阿司匹林服用史、生化指标、原发病、免疫抑制剂应用情况,分析肝移植受者术后发生CAP的危险因素。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料用均数±标准差表示,非正态分布的计量资料用中位数(下四分位数,上四分位数)表示,计数资料用率表示。倾向性评分匹配使用最邻近匹配法,卡钳值设为0,匹配顺序随机,比例为1∶3。用Kaplan-Meier曲线描述息肉和CAP的累积发生率。采用Cox模型行单因素分析,将有意义的因素纳入Cox模型多因素分析。P<0.05为差异有统计意义。
2 结 果
2.1 结直肠息肉的发生情况
移植组和体检组结直肠息肉5年累积发生率分别为43%和34%(P=0.095)。肝移植受者中,28例发现1个息肉,8例发现2个息肉,6例发现3个及以上息肉。除1例受者息肉较多未统计外,共发现息肉65个,包括升结肠14个,横结肠10个,降结肠7个,乙状结肠21个,直肠13个。息肉直径中位数5 mm,≤5 mm的33个,6~10 mm的24个,11~20 mm的4个,>20 mm的4个。
2.2 病理检查结果
移植组和体检组CAP的5年累积发生率分别为29%和23%(P=0.242)。部分受者发现多个息肉,体积较小者(共5个)未送病理,有病理结果的共60个,包括炎性息肉25个,CAP 33个(其中8个伴有低级别上皮内瘤变,3个伴有高级别上皮内瘤变),高分化腺癌2个。
2.3 肝移植受者发生CAP的危险因素分析
单因素分析结果显示CAP组服用过环孢素的受者多于非CAP组,详见表1。Cox模型多因素分析结果显示服用环孢素是肝移植受者术后发生CAP的独立危险因素[风险比(hazard ratio,HR)7.55,95%可信区间(confidence interval,CI)2.44~23.37,P<0.01]。
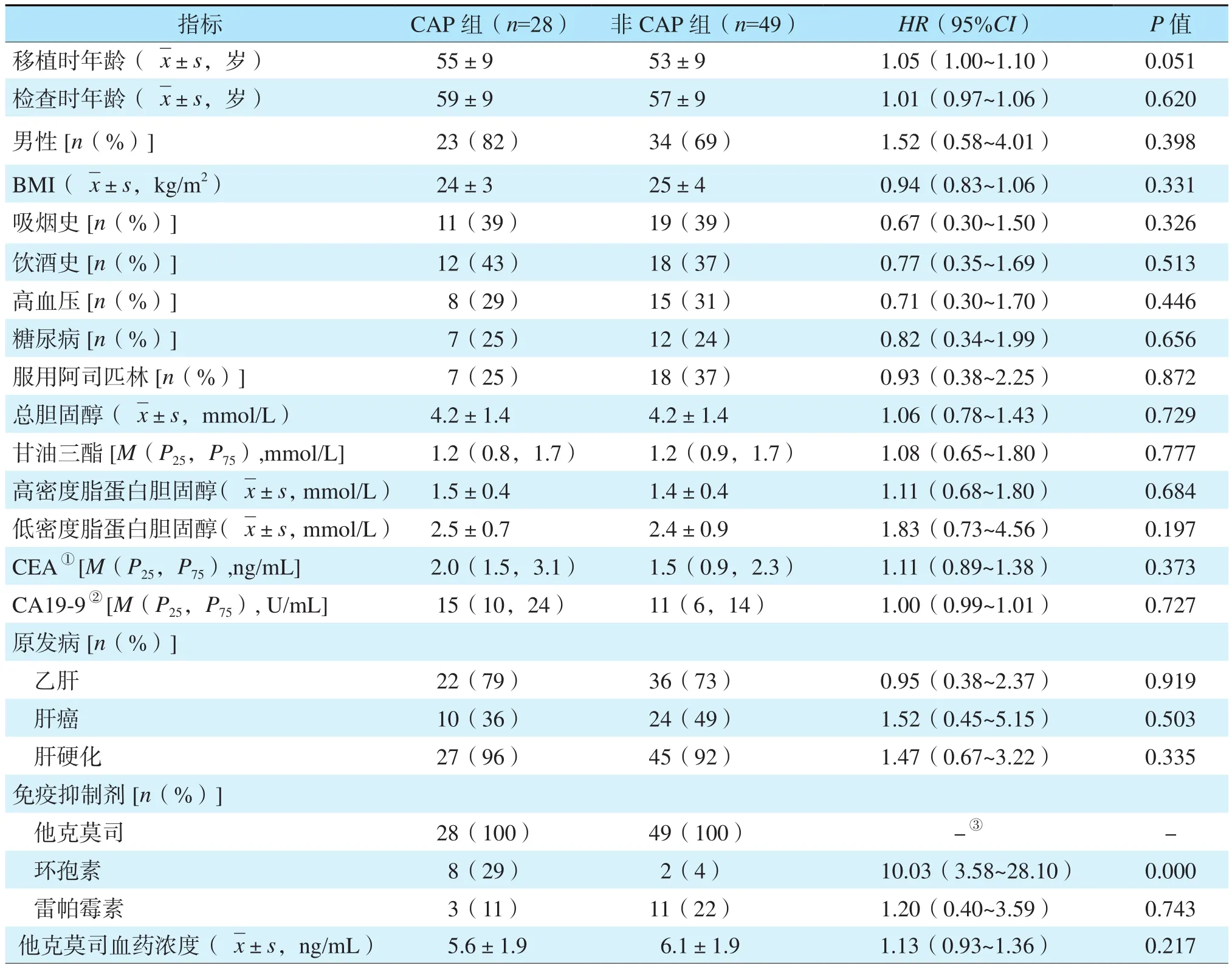
表1 肝移植受者术后发生CAP危险因素的单因素分析Table 1 Univariate analysis of risk factors for postoperative CAP in liver transplant recipients
3 讨 论
本研究结果显示,肝移植受者结直肠息肉和CAP术后5年累积发生率分别为43%和29%,略低于本团队前期研究中的62.5%和40.6%[14],可能与样本量和肝脏原发病有关。国外部分研究显示,肝移植受者术后结直肠息肉发生率为29.3%~42.0%[15-18],CAP发生率为18.3%~28.0%[15-20],均低于本研究,可能因为国内受者术前未行结肠镜筛查,导致术后检出率增加。本研究中,体检者结直肠息肉及CAP发生率均低于肝移植受者,但差异无统计意义,本团队前期研究结果显示乙肝肝移植受者结直肠息肉发生率(62.5%)高于乙肝组(55.2%)和体检组(47.9%)[14];国外研究显示肝移植受者术后CAP发生率高于体检人群、慢性肝病患者和移植前的受者[16-19],与本研究结果相符。
在我国,乙肝在成人肝移植原发病中居首位(72.27%),肝癌(45.29%)和肝硬化(37.78%)在病理病因中居前两位[21],这符合本研究移植组肝脏原发病特点。国外部分研究显示移植受者肝脏原发病以丙肝、酒精性肝病、原发性胆汁性肝硬化多见[17,19-20],与我国有一定差异。本研究中息肉数量多为1个且总体偏小,提示大部分息肉形成时间较短。息肉病理类型以CAP最多且多位于左半结肠,尤其是乙状结肠。Albright等[16]的研究中186例肝移植受者术后55例发现结直肠息肉, 38例发现CAP (15例位于左侧,10例位于右侧,其余13例位于多个位置或未明确),与本研究相符,也与美国2020年结直肠癌数据中的结直肠癌分布情况相符[22],结直肠癌分布以近端结肠最多(40%),其次是直肠(29%)。
有研究显示肝移植术后发生CAP的危险因素包括男性、肥胖、肝脏原发病为酒精性肝病和非酒精性脂肪肝、术后他克莫司浓度较高、术后结肠镜检查时间延迟等[15-17,19,23]。Danan等[19]的研究显示肝移植术后第1、2、3年的他克莫司浓度较高及术后第1年他克莫司平均浓度>7 ng/mL是CAP发生的独立危险因素。目前少有关于环孢素和雷帕霉素对肝移植术后CAP发生影响的相关研究。本研究结果显示服用环孢素是肝移植受者术后发生CAP的独立危险因素。考虑到CAP作为结直肠癌主要的癌前病变,所以CAP也可视为结直肠癌形成的一环[24]。他克莫司和环孢素能以剂量依赖方式激活原癌基因和恶性肿瘤发生途径,促进肿瘤细胞增殖和转移并抑制其凋亡[25]。雷帕霉素可通过干扰肿瘤细胞的增殖和生长周期、抑制肿瘤血管生成、诱导肿瘤细胞凋亡等起到抗肿瘤作用[26-27]。有研究显示以环孢素或他克莫司为主的免疫抑制方案是肝移植术后新发恶性肿瘤的独立危险因素[28-29]。而雷帕霉素在降低肝移植术后新发恶性肿瘤风险的研究尚且不足,美国一项大数据研究显示雷帕霉素可明显提高肝癌肝移植受者术后5年生存率[30]。Bhat等[8]和Schrem等[31]的研究结果均显示不同免疫抑制剂对移植后新发恶性肿瘤的影响差异无统计学意义,而Wimmer等[32]的研究显示服用他克莫司的肝移植受者术后10年新发恶性肿瘤发生率明显高于服用环孢素的受者。本研究中CAP组服用环孢素的受者明显多于非CAP组,服用雷帕霉素的受者少于非CAP组,与国外研究相符;所有患者均服用了他克莫司且CAP组平均浓度略低于非CAP组,与国外研究存在差异,考虑与样本量有关。
目前国内少有关于肝移植后CAP的研究,本研究发现肝移植术后CAP发生风险略有增加,服用环孢素是肝移植受者术后发生CAP的独立危险因素。未来将增加样本量,进一步研究具体机制,为改善肝移植受者预后提供新思路。
