儿童肝移植免疫耐受的研究进展
2022-05-02周艾炜刘源薛峰夏强
周艾炜 刘源 薛峰 夏强
自1963年Starzl团队成功实施第一例人体肝移植手术以来,随着外科技术、移植物保存及围手术期管理水平的提高,肝移植已成为儿童终末期肝病最有效的治疗方式,术后1年和5年受者生存率分别达到91.1%和86.3%[1]。移植物功能的长期稳定对于受者的预后和生存质量至关重要,也是器官移植领域面临的共同挑战,当前的共识是通过终身服用免疫抑制剂[如糖皮质激素(激素)、钙调磷酸酶抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂等]减少受者免疫系统对移植物的攻击,预防排斥反应,但长期服用免疫抑制剂可能导致感染、骨髓抑制、肾功能异常、肿瘤等不良反应[2-5]。北欧一项基于人群的统计学研究显示,儿童肝移植受者在长期随访中发生肿瘤的可能性会增加10倍[6]。免疫抑制剂的长期不良反应不仅影响全身器官功能和生长发育,也极大影响了儿童肝移植受者的总体生活质量,一定程度上阻碍了其在未来与社会的融入,加重其整个成长阶段的心理负担[7-8]。特别是在青春期,心理和生理的快速改变使得儿童肝移植受者的服药依从性大大降低,因随意停药或乱用药物导致的相关并发症成为了该阶段肝功能波动的最主要因素[9-10]。
因此,对免疫耐受的临床研究成为了减少免疫抑制剂用量的关键[11-12]。免疫耐受状态下,虽然机体对供者来源性抗原不会产生免疫反应,但仍能清除其它外源性抗原,这也被称为供肝特异性免疫沉默[13]。临床上部分受者在不服用免疫抑制剂的情况下,移植物能维持正常功能,且组织学上没有排斥反应迹象,即达到免疫耐受状态[14]。相比其它类型的移植物,肝脏作为免疫豁免器官,具有更丰富的内在免疫调节性,有助于自发性耐受形成[15-16]。在肝移植早期受者中已有报道,部分受者由于主动或被动因素减少免疫抑制剂服药量,甚至在完全停药状态下,依然能保持稳定的肝功能[17-18]。
1 儿童受者免疫耐受的特点
儿童肝移植的主要原发病是胆道闭锁,占所有肝移植患儿的75%[19]。这类患儿通常需要在2岁内接受肝移植治疗[20-21]。与成人肝移植受者不同,儿童肝移植在中国主要的手术方式是亲属活体肝移植,即将患儿直系亲属捐献的部分肝脏移植入患儿体内[22-23]。低龄患儿自身免疫系统尚未发育完善,加之亲属肝移植组织相容性的优势,使得低龄肝移植患儿机体对移植物具有更好的耐受性。在部分肝移植患儿中减量或者停用免疫抑制剂不仅能够极大地减缓长期服用免疫抑制剂的不良反应,也能够提高患儿服药的依从性。此外,儿童肝移植受者乙型病毒性肝炎(乙肝)、丙型病毒性肝炎(丙肝)等感染性疾病的发生率远低于成人,肝脏病理和肝内免疫环境受外源因素干扰小,对于免疫耐受的评估和分子机制研究更有利。
2 免疫耐受的诱导
儿童肝移植受者实现免疫耐受主要有3种方式,即被动免疫耐受、主动操作性免疫耐受和诱导性免疫耐受。被动免疫耐受主要是患儿因感染、严重免疫抑制剂相关不良反应等原因被迫停用免疫抑制剂,部分患儿在长期停用免疫抑制剂后肝功能仍维持稳定,无明显肝内炎症和排斥反应的表现,达到免疫耐受状态。主动操作性免疫耐受是在长期随访肝功能稳定且服药量较低的患儿中主动程序性撤除免疫抑制剂,在逐步撤药的过程中筛选出可以达到免疫耐受状态的患儿。这种方法适用于术后时间较长、单药免疫抑制剂维持且依从性较好的患儿,并在有经验的肝移植中心进行。对于在主动撤药期间发生排斥反应的患儿需及时恢复免疫抑制剂用量,必要时需通过激素治疗。诱导性免疫耐受主要是通过输注干细胞、调节性免疫细胞如调节性T细胞(regulatory T cell,Treg)、树突状细胞(dendritic cell,DC)等诱导肝移植患儿对移植物的耐受反应,从而达到诱导免疫耐受的目的。
3 操作性免疫耐受
对儿童肝移植术后操作性免疫耐受的临床研究包括单中心及多中心的研究,其中美国加州大学旧金山分校(University of California at San Francisco,UCSF)移植中心Sandy Feng教授开展了目前最为全面和规模最大的多中心研究。在其2006年至2009年进行的WISP-R研究中,入组了20例儿童肝移植受者,其中12例实现完全免疫耐受,比例高达60%,且患儿在随访期间肝功能稳定,未见肝内炎症和纤维化改变[24-25]。同时,免疫耐受患儿体内供者特异性抗体(donor specific antibody,DSA)水平未见明显提高。对于撤药期间发生急性排斥反应的患儿,加用免疫抑制剂均使肝功能恢复正常,且在长期随访中未见肝内炎症和纤维化发展。在此基础上,Feng等[26]在2012年至2014年再次对88例肝移植患儿进行操作性免疫耐受的安全性评价(iWITH),结果显示37.5%达到免疫耐受,18.0%停药后肝穿刺病理检查提示排斥反应可能,再次加用免疫抑制剂,随访期间免疫耐受和非免疫耐受患儿肝功能、肝内炎症、肝内纤维化、DSA等未见明显异常,证明了在经过筛选的患儿中操作性免疫耐受的安全性和有效性。同时,在未达到免疫耐受的患儿中,超过一半患儿的免疫抑制剂用量明显低于初始剂量,表明在肝移植患儿中进行操作性免疫耐受对降低长期免疫抑制剂暴露量也有着重要意义。
儿童肝移植术后长期随访中发现肝纤维化和炎症反应发生率随着随访时间的延长而不断提高,术后1、5、10年肝纤维化的发生率分别达到52%、81%、91%,而纤维化的发生与供肝冷缺血时间、供受者年龄等密切相关。在移植术后因各种原因停用免疫抑制剂的肝移植患儿中,程序性肝穿刺以明确肝内病理变化,特别是纤维化的程度尤为重要。Yoshitomi等[27]研究发现,虽然免疫耐受患儿在随访期间肝功能始终维持稳定,肝内未见明显排斥反应,但耐受患儿肝内纤维化的总体程度仍高于正常服用免疫抑制剂的患儿。同时,在纤维化较严重的患儿中重新加用免疫抑制剂能够缓解肝内纤维化程度,提示免疫耐受后肝内的轻度炎症反应或抗体介导的排斥反应可能与纤维化的发展有关。在Feng等[24]后续研究中发现,经过严格筛选且按照一定程序进行操作性免疫耐受的肝移植患儿,在5年的随访中肝内纤维化程度无明显增加。这些研究说明,在免疫耐受患儿中定期进行肝脏病理穿刺并评估肝内炎症和纤维化程度对维持患儿肝脏长期功能具有非常重要的意义。
4 诱导性免疫耐受
与主动操作性免疫耐受主要在肝移植术后长期随访患儿中开展不同,诱导性免疫耐受通过在移植术后输注干细胞或者具有调节功能的免疫细胞,帮助肝移植受者在术后早期实现免疫耐受[28-29]。常用的诱导性免疫细胞包括Treg、骨髓来源的间充质干细胞(mesenchymal stem cell,MSC)、调节性DC(regulatory DC,DCreg)等,目前大部分的临床研究主要是Ⅰ期或Ⅱ期临床试验[30]。Todo等[31]在进行过脾切除的活体肝移植受者中输注Treg,术后18个月有70%达到免疫耐受状态,且在2年的随访中肝功能维持稳定,这是目前细胞诱导性免疫耐受在肝移植受者中最成功的临床研究。MSC可以通过抑制CD4+、CD8+T细胞的活化以及促进Treg的增殖发挥免疫调节功能,在多项肾移植术后诱导性免疫耐受临床研究中都获得了良好结果[32]。然而,针对MSC诱导肝移植术后免疫耐受的临床研究虽然证明了外源性MSC输注的安全性,且能一定程度缓解缺血-再灌注和急性排斥反应引起的肝损伤,但是对免疫耐受的诱导效果仍不确定,多数肝移植受者仍无法达到理想的免疫耐受状态[33-34]。美国匹兹堡大学Thomson等[35]通过供者来源的DCreg诱导活体肝移植受者免疫耐受的临床实验初步证明了DCreg输注的安全性和可行性,但对免疫功能的长期调节作用仍需进一步观察。此外,包括造血干细胞、调节性巨噬细胞和骨髓来源的免疫细胞诱导肝移植术后免疫耐受的研究也在陆续开展中[36-39],然而,细胞诱导性免疫耐受仍存在包括细胞产品制备的安全性、细胞输注流程的规范化、免疫抑制剂对细胞产品功能的影响、潜在的移植物抗宿主病风险、缺乏多中心大样本的有效性验证等问题,未来仍需移植科医师及科研人员继续探索[40]。操作性免疫耐受与诱导性免疫耐受临床试验进展见表1[25-26,31,41-63]。

表1 操作性免疫耐受与诱导性免疫耐受临床试验进展Table 1 Progress in clinical trials of operational immune tolerance and induced immune tolerance
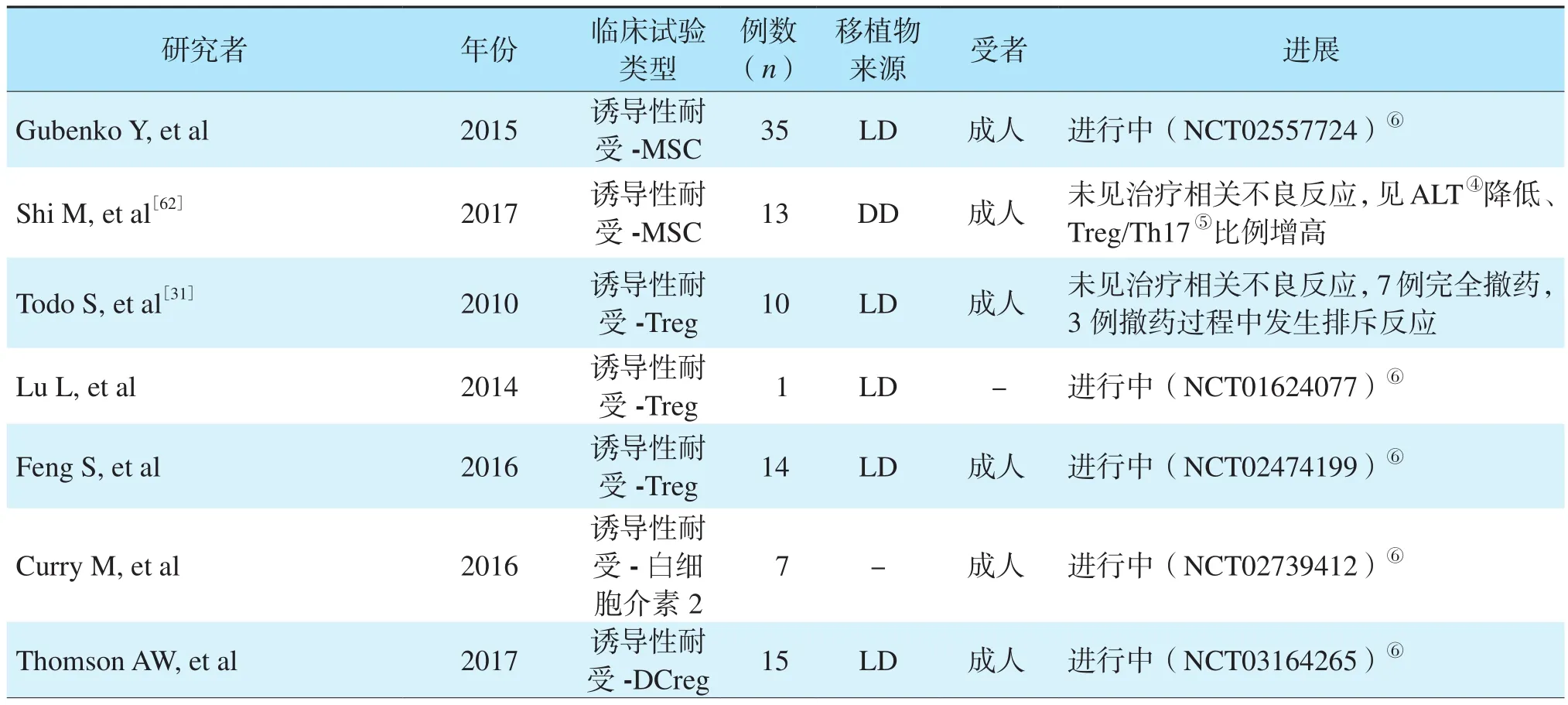
续表1
5 受者筛选与耐受标志物
如何筛选实现免疫耐受的肝移植患儿也是不少肝移植中心的研究重点[64-66]。由于缺乏足够的大样本前瞻性临床研究,对免疫耐受患儿的群体特征通常通过回顾性研究进行分析,相关指标缺乏足够的临床验证。Martínez-Llordella等[67]发现,免疫耐受患儿外周血中RAD21、RAD50、RBBP9、APRIN等调控细胞周期及细胞增殖的基因和γ σT细胞与自然杀伤(natural killer,NK)细胞表面受体的基因表达明显增多,且外周血内CD4+CD25+细胞与γ σT细胞的比例升高,提示调节性细胞在诱导免疫耐受中发挥了重要作用。Lau等[68]通过对外周血进行分析发现,CD4+CD5+CD25+CD38-/lowCD45RA-细胞在免疫耐受患儿中比例明显增高,可考虑作为筛选免疫耐受群体的标志之一。Li等[69]也发现免疫耐受患儿外周血存在更高比例的CD4+CD25+Treg和Vδ1/Vδ2 γ σ T细胞。Bohne等[70]分析移植肝内转录组学,发现5个与铁代谢相关的基因(CDHR2、MIF、PEBP1、SOCS1、TFRC)能够对免疫耐受患者进行准确预测,其灵敏度和特异度分别为0.89和0.86,但是目前铁代谢影响免疫耐受的机制仍不清楚。
6 小结与展望
综上所述,在经过筛选的儿童肝移植受者中实现免疫耐受不仅安全有效,还能极大降低免疫抑制剂的总体暴露量,减少免疫抑制剂相关不良反应,提高患儿长期随访的依从性和积极性。然而,通过细胞疗法在肝移植术后早期诱导免疫耐受虽然安全,但其诱导效果仍需进一步的临床验证。目前,对于耐受相关生物标志物的研究主要是回顾性研究,尽管能揭示免疫耐受群体外周血的免疫系统特征,但个体差异相对较大且无法做到良好的预测作用,而前瞻性研究及肝内免疫状态的研究相对缺乏,因此对免疫耐受群体的生物标志物预测的相关研究仍需进一步加强。
