超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性
2022-05-01王晓艺李培坤李锦红杜英杰边红杰贾士儒崔建东
王晓艺,李培坤,李锦红,杜英杰,边红杰,贾士儒,崔建东*
(1.天津科技大学食品营养与安全国家重点实验室,天津 300457;2.河北科技大学食品与生物学院,河北 石家庄 050018)
玫瑰是蔷薇科植物,又称刺玫瑰、穿心玫瑰、笔头花等[1],具有良好的食用价值。而重瓣玫瑰是一种被广泛食用的玫瑰,花瓣香甜、香气馥郁,有疏肝理气、活血散瘀、美容养颜等多种功效,含有多种活性物质,如多酚、多糖、有机酸等[2]。因此,玫瑰花中活性物质具有广阔的应用前景。多酚是一种生物活性物质,其结构较为复杂,按结构可以分成酚酸类、类黄酮类和1,2-二苯乙烯及木酚素类[3-4],由于多酚结构的特殊性,使其具有很好的抗氧化、抗衰老、抑菌等作用[5-7]。因此,将玫瑰花中的多酚提取出来进行综合利用受到学者广泛关注。目前,有机溶剂提取法和水浴加热浸提法是提取多酚的常用方法[8]。但是传统方法需要使用大量有机溶剂且提取时间长、操作复杂,不符合绿色化学的概念,在环保性和安全性上存在缺陷。因此,寻找一种绿色、环保且高效的植物多酚提取方法是十分必要的。
2003 年,低共熔溶剂(deep eutectic solvents,DES)的概念首次被提出[9],DES是一种新型的绿色溶剂,是由氢键供体和氢键受体组成的两组分或三组分低共熔混合物,其熔点比各个组分更低[10],具有良好的特性,如无毒、易于合成、成本低、生物可降解性等,已被公认为是传统溶剂替代品[11]。Bajkac等[12]利用DES从大豆中提取异黄酮等活性物质。Ozturk等[13]利用DES从橙皮废料中提取多酚类抗氧化剂。因此,DES在活性物质的提取方面具有较好的应用前景[14]。超声辅助提取可以在较好地保持提取物的结构和活性的同时,使植物细胞内可溶性物质快速释放、扩散并进入到提取剂中,具有省时、高效等特点[15-16]。因此,利用超声辅助DES法提取植物中的活性物质可能会增强提取效果。
本文以盛产于河北省衡水市的重瓣玫瑰“丰花1号”为原料,采用超声辅助DES法提取其中的多酚,运用单因素试验优化提取工艺,并与传统乙醇提取方法进行比较,利用NKA-9大孔吸附树脂分离纯化多酚,并研究纯化后多酚的抗氧化活性。本文将为玫瑰多酚的绿色提取提供新思路,为其在天然抗氧化剂领域中的应用中提供科学依据。
1 材料与方法
1.1 材料与试剂
玫瑰花(重瓣玫瑰“丰花1号”):产自河北衡水,60℃烘箱干燥6 h后粉碎过80目筛备用。
氯化胆碱:上海晶纯生化科技股份有限公司;乳酸:上海源叶生物科技有限公司;维生素C、福林酚、没食子酸标准品(纯度99.9%):北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS]、无水碳酸钠:上海麦克林生化科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
分析天平(ME204):梅特勒-托利多仪器有限公司;集热式磁力加热搅拌器(DF-Ⅱ):江苏金怡仪器科技有限公司;紫外可见分光光度计(UV-5100):上海元析仪器有限公司;超声波细胞粉碎机(Scientz-ⅡD):宁波新芝生物科技股份有限公司;真空冷冻干燥机(FD-1):上海田枫实业有限公司。
1.3 试验方法
1.3.1 玫瑰多酚提取工艺流程
玫瑰花粉末→加入提取剂→混匀→超声辅助提取→离心→取上清液。
1.3.2 多酚含量的测定
利用福林酚比色法[17]测定多酚含量:取不同质量浓度没食子酸标准溶液(10、20、30、40、50 μg/mL)、水和样品溶液1.0 mL,分别加入体积分数为10%的福林酚试剂 5.0 mL,静置 3 min~8 min,再加入 7.5 g/100 mL碳酸钠溶液4.0 mL,避光条件下反应1 h,以水为参比,于765 nm测定吸光值。分别以没食子酸标准溶液质量浓度(x)、吸光值(y)为横、纵坐标,线性回归方程为y=0.0179x+0.114(R2=0.9995),多酚提取量计算公式如下。

式中:C为提取液中多酚的含量,mg/mL;V为提取液的体积,mL;M为玫瑰花粉末质量,g;N为稀释倍数。
1.3.3 DES的筛选
1.3.3.1 DES的制备
DES的组成见表1。按照表1所示组分和摩尔比制备5种DES,将氢键受体与氢键供体按照一定摩尔比混合,置于磁力加热搅拌器中,85℃恒温搅拌至呈均一、澄清、透明的液体[18]。

表1 DES的组成Table 1 Composition of the DES
1.3.3.2 DES的筛选
称取 0.1 g 玫瑰花粉末,按料液比 1∶30(g/mL),分别加入30%含水量的DES,在超声时间10 min、超声功率300 W、超声温度30℃条件下提取玫瑰多酚。
1.3.4 两种方法提取玫瑰多酚的条件优化
分别用DES和乙醇作为提取剂提取玫瑰多酚,以多酚提取量为评价指标进行单因素试验,考察DES含水量(10%、20%、30%、40%、50%)、乙醇体积分数(10%、20%、30%、40%、50%)、料液比[1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)]、超声时间(5、10、15、20、25 min)、超声功率(300、400、500、600、700 W)、超声温度(30、40、50、60、70℃)、提取次数(1、2、3、4次)对玫瑰多酚提取量的影响。
1.3.5 玫瑰多酚冻干粉制备流程
玫瑰多酚提取液→NKA-9大孔树脂吸附→70%质量分数的乙醇解吸附→旋转蒸发→冷冻干燥→多酚冻干粉。
1.3.6 玫瑰多酚冻干粉抗氧化活性的测定
1.3.6.1 总还原能力测定
参考Shon等[19]的方法并略作改动,称取适量的玫瑰多酚冻干粉,用蒸馏水配制成 10、20、30、40、50 μg/mL的玫瑰多酚样品溶液。分别将上述浓度梯度溶液1.0 mL与1%铁氰化钾溶液1.0 mL混合,50℃下反应20 min后,加入10%三氯乙酸溶液1.0 mL,涡旋均匀后,3 000 r/min离心10 min,将1 mL上清液、1 mL蒸馏水和0.2 mL的0.1%三氯化铁溶液混匀,在700 nm处测定吸光值。以维生素C作为阳性对照。
1.3.6.2 DPPH自由基清除能力测定
参考Merghem等[20]的方法并略作改动,称取适量玫瑰多酚冻干粉,用蒸馏水配制成 10、20、30、40、50 μg/mL的玫瑰多酚样品溶液,分别将上述浓度梯度溶液1.0 mL与0.05 mg/mL的DPPH溶液1.0 mL混合,避光反应20 min,分别测定无水乙醇代替样品、样品溶液、无水乙醇代替DPPH溶液在517 nm下的吸光度,记为A0、A1、A2,并以维生素C作为阳性对照,计算DPPH自由基的清除率,公式如下所示。

式中:A1为加入样品后的吸光度;A2为无水乙醇代替DPPH溶液的吸光度;A0为无水乙醇代替样品的吸光度。
1.3.6.3 ABTS+自由基清除能力测定
参考Binsan等[21]的方法并稍作修改,ABTS工作液的制备:将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液等体积混合,在室温下避光过夜(12 h~16 h),制成ABTS+自由基储备液备用。将储备液用无水乙醇稀释,使其在734 nm处的吸光值为0.7±0.02,以此作为ABTS工作液。称取适量的玫瑰多酚冻干粉,用蒸馏水配制成 10、20、30、40、50 μg/mL 的玫瑰多酚样品溶液,分别将上述浓度梯度溶液0.1 mL与ABTS工作液1.0 mL混合,避光反应6 min,分别测定无水乙醇代替样品、样品溶液在734 nm下的吸光值,记为A0、A1,并以维生素C作为阳性对照,计算ABTS+自由基的清除率,公式如下所示。

式中:A1为加入样品的吸光度;A0为无水乙醇代替样品的吸光度。
1.4 数据处理与分析
使用Excel软件对试验数据进行统计分析,使用Origin软件对试验数据进行作图分析,每组试验样品测定3次。
2 结果与分析
2.1 DES的筛选
DES是由氢键受体和氢键供体组合而成的低共熔混合物,由于组成成分的不同,其对目标提取物的提取效率不同。不同DES对玫瑰多酚提取量的影响见图1。

图1 不同DES对玫瑰多酚提取量的影响Fig.1 Effect of different DES on the extraction yield of rose polyphenols
由图1可以看出,5种DES对玫瑰多酚的提取量大小顺序依次为DES-1[(94.87±0.51 mg/g)]>DES-2[(93.90±0.62 mg/g)]>DES-5[(88.77±0.57 mg/g)]>DES-3[(87.31±0.9 mg/g)]>DES-4[(86.16±0.55 mg/g)],其中DES-1对多酚的提取量最大。从统计学上分析,DES-1与DES-2无显著差异(P>0.05),DES-1与 DES-3具有极显著差异(P<0.001),DES-1与DES-4和DES-5具有显著差异(P<0.01)。但是DES-2的黏度很大,不利于试验操作;DES-1的提取效果高于其他DES,可能是因为相比于其他DES,DES-1的黏度小,分散性好,能更好地与多酚分子接触,且极性与多酚最相近。因此,在后续试验中选择DES-1与乙醇进行对比试验。
2.2 两种方法提取玫瑰多酚的条件优化
2.2.1 DES的含水量和乙醇体积分数对玫瑰多酚提取量的影响
DES含水量对玫瑰多酚提取量的影响见图2,乙醇体积分数对玫瑰多酚提取量的影响见图3。

图2 DES含水量对玫瑰多酚提取量的影响Fig.2 Effect of water content in DES on the extraction yield of rose polyphenols
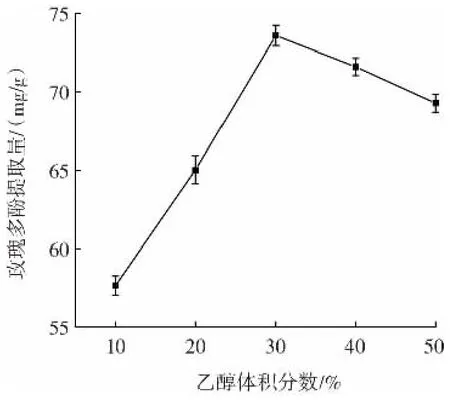
图3 乙醇体积分数对玫瑰多酚提取量的影响Fig.3 Effect of volume fraction of ethanol on the extraction yield of rose polyphenols
由图2可知,随着含水量的增加,多酚提取量先增加后减少。可能是由于在DES中加入适量水,可以增加DES分子流动性,降低黏度,增加扩散能力[10],使其能够与多酚类化合物充分接触,提高多酚提取效率,而当DES含水量较高时,过量的水使溶液极性过大,DES与多酚间氢键作用力减弱,从而使玫瑰多酚提取量下降[22]。当DES含水量为30%时,多酚提取量达到了最大值,为(94.86±0.25)mg/g。由图 3可知,当乙醇体积分数在一定范围内,随着乙醇浓度的增加,玫瑰多酚的提取量呈现先增大后减小的趋势,可能是由于在一定范围内,乙醇体积分数的增高有利于多酚类物质的溶出,多酚提取量增加。当超过该范围后,由于溶出的较多杂质多酚与竞争提取剂,导致多酚提取量降低。当乙醇体积分数为30%时,多酚提取量达到最大值,为(73.59±0.65)mg/g。因此选择体积分数为30%的乙醇与含水量30%的DES-1进行后续的比较试验。
2.2.2 料液比对玫瑰多酚提取量的影响

图4 料液比对玫瑰多酚提取量的影响Fig.4 Effect of solid-liquid ratio on the extraction yield of rose polyphenols
由图4可知,当料液比在一定范围内,多酚提取量随溶剂量的上升而增大,可能是由于溶剂增多后,能更好地与原料相互作用,传质推动力提高,有利于增加多酚提取量[13]。当原料中的多酚类物质被全部提取出来后,继续增加溶剂量,反而会使提取出来的多酚重新溶解到原料液中,使得多酚提取量下降,并且造成溶剂的浪费。当DES-1为提取剂,料液比 1∶40(g/mL)时,多酚提取量达到最大值,为(113.74±0.55)mg/g;当乙醇为提取剂,料液比1∶30(g/mL)时,多酚提取量达到最大值,为(73.81±0.59)mg/g。因此,分别选择DES提取剂料液比 1∶40(g/mL)和乙醇提取剂料液比 1∶30(g/mL)进行后续试验。
2.2.3 超声时间对玫瑰多酚提取量的影响
超声时间对玫瑰多酚提取量的影响见图5。

图5 超声时间对玫瑰多酚提取量的影响Fig.5 Effect of ultrasonic time on the extraction yield of rose polyphenols
由图5可知,随着超声时间延长,玫瑰多酚提取量呈先增大后减小的趋势。可能是因为随着超声时间增加,多酚逐渐溶出,使多酚提取量增加,但超声时间继续延长,可能会受光、热等因素影响,导致部分提取出的玫瑰多酚被氧化,从而导致提取量的降低,并且超声时间过长会增加能耗,增加提取成本[16]。当分别以DES-1和乙醇为提取剂时,超声时间都在10 min时,玫瑰多酚提取量达到最大,分别为(115.75±0.55)mg/g和(74.75±0.48)mg/g。
2.2.4 超声功率对玫瑰多酚提取量的影响
超声功率对玫瑰多酚提取量的影响见图6。

图6 超声功率对玫瑰多酚提取量的影响Fig.6 Effect of ultrasonic power on the extraction yield of rose polyphenols
从图6可知,随着超声功率的增大,玫瑰多酚提取量呈先增大后减小的趋势。在超声过程中,可能由于超声波可以提供能量,将强烈的振动传递给玫瑰花粉末和溶剂,原料细胞部分被破坏,加快胞内物质的释放,并且强化了溶质扩散,因而提取量增加[23]。而当超声功率继续增大时,可能引起部分多酚的降解,从而使多酚提取量下降。当分别以DES-1和乙醇为提取剂,超声功率都在400 W时,玫瑰多酚提取量达到最大,分别为(117.54±0.54)mg/g和(76.37±0.45)mg/g。
2.2.5 超声温度对玫瑰多酚提取量的影响
脑瘫是一种致残性慢性病,除了医疗康复外,需要长期、有效的家庭康复保驾护航,才能保证儿童康复的疗效,让更多儿童回归家庭和社会。把医院的医疗康复延续到家里,这更符合目前我国的基本国情。已有大量研究表明家庭康复在脑瘫患儿的康复训练中有显著重要性,医院加家庭康复训练的强化训练模式是儿童脑瘫康复行之有效的方法[11-13],坚持家庭康复的脑瘫患儿疗效比不坚持家庭康复的更好。父母的心理状况不良,将会影响家庭康复的执行,进而影响脑瘫儿童康复疗效。对脑瘫患儿父母进行心理干预可以更好地提高患儿康复疗效[14]。关注脑瘫患儿父母的心理状况及影响因素,出台救助政策、完善社会服务支持、积极开展家长工作等有深远意义。
超声温度对玫瑰多酚提取量的影响见图7。

图7 超声温度对玫瑰多酚提取量的影响Fig.7 Effect of ultrasonic temperature on the extraction yield of rose polyphenols
由图7可知,随着超声温度的升高,玫瑰多酚提取量呈现先增大后减小的趋势。随着温度的升高,分子运动加剧,提高了多酚类化合物在溶剂中的扩散系数和溶解度[24],使得多酚提取量增加。而当超声温度继续升高时,可能导致部分热敏性的多酚被降解,使得多酚提取量减少。当分别以DES-1和乙醇为提取剂,超声温度都在50℃时,玫瑰多酚提取量达到最大,分别为(120.89±0.48)mg/g 和(78.94±0.52)mg/g。
2.2.6 提取次数对玫瑰多酚提取量的影响
提取次数对玫瑰多酚提取量的影响见图8。
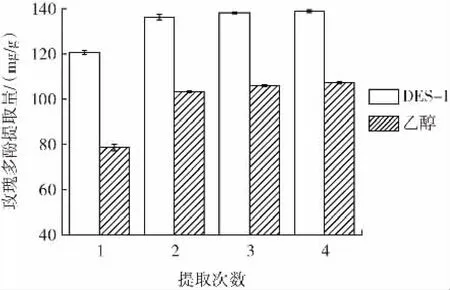
图8 提取次数对玫瑰多酚提取量的影响Fig.8 Effect of extraction times on the extraction yield of rose polyphenols
由图8可知,随着提取次数的增加,玫瑰多酚的提取总量逐渐上升,以DES-1为提取剂和以乙醇为提取剂的趋势相同,而当继续增加提取次数时,提取次数对玫瑰多酚提取量的提高不明显。因此,选择提取次数为2次,在提取量合理的情况下,降低了提取成本。
2.3 两种玫瑰多酚提取方法的比较
在DES-1与乙醇对多酚提取最优的条件下,将两种方法所得的玫瑰多酚提取量进行比较,结果见表2。

表2 两种玫瑰多酚提取方法的比较Table 2 Comparison of two extraction methods of rose polyphenols
与乙醇提取法相比,DES法的玫瑰多酚提取量提高了24%,这可能是由于DES与多酚类化合物之间有较强的氢键作用力,其扩散力、溶解度和极性有利于多酚类化合物的溶出[25]。因此,对于玫瑰多酚的提取,DES法较传统乙醇提取法效果更好。在后续的抗氧化试验中,使用DES法提取的玫瑰多酚进行测定。
2.4 玫瑰多酚抗氧化活性的测定
2.4.1 总还原能力
还原能力可延缓或终止自由基反应,可以通过还原能力的测定来评价样品的抗氧化活性。总还原能力测定结果见图9。

图9 玫瑰多酚的总还原能力Fig.9 Total reducing power of rose polyphenols
由图9可见,随着样品质量浓度增大,玫瑰多酚和维生素C吸光度逐渐增大,还原能力增强,试验结果显示,当玫瑰多酚和维生素C在10 μg/mL~50 μg/mL时,还原能力均随着浓度的增加呈线性增加,而在10 μg/mL~20 μg/mL,玫瑰多酚和维生素 C 的还原能力相差较小。
2.4.2 玫瑰多酚DPPH自由基清除能力
玫瑰多酚DPPH自由基的清除能力见图10。
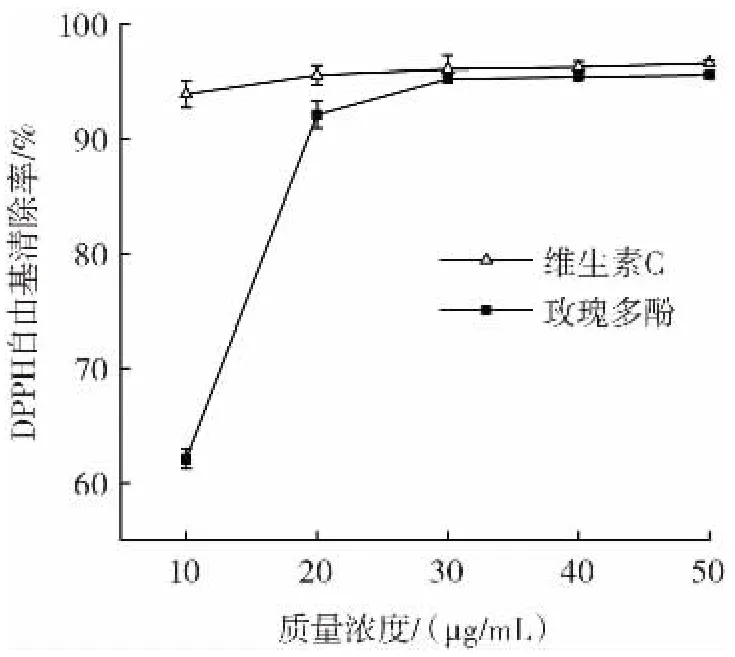
图10 玫瑰多酚DPPH自由基的清除能力Fig.10 The DPPH free radicals scavenging ability of rose polyphenols
由图 10 可见,在 10 μg/mL~30 μg/mL,随着多酚质量浓度的增加,其对DPPH自由基清除能力逐渐上升,当多酚质量浓度在30 μg/mL时,其对DPPH自由基的清除率已达到95.24%,随后继续增加多酚浓度对DPPH自由基清除效果没有太大的影响,试验结果显示,高质量浓度的玫瑰多酚拥有较强的DPPH自由基清除能力。从20 μg/mL~50 μg/mL来看,玫瑰多酚与维生素C的DPPH自由基清除能力相当。
2.4.3 ABTS+自由基清除能力
ABTS+自由基清除能力见图11。

图11 玫瑰多酚ABTS+自由基清除能力Fig.11 ABTS+free radical scavenging ability of rose polyphenol
由图11可见,随着样品质量浓度增大,玫瑰多酚和维生素C的ABTS+自由基清除能力逐渐增强。当玫瑰多酚与维生素C的ABTS+自由基清除率均接近100%时,玫瑰多酚浓度为40 μg/mL,而维生素C的浓度为50 μg/mL。因此,由试验结果所示,玫瑰多酚清除ABTS+自由基能力优于维生素C。
3 结论
本研究以盛产于河北省衡水市的重瓣玫瑰“丰花1号”为原料,采用超声辅助DES法对玫瑰花中的多酚进行高效快速提取,并与传统乙醇提取方法进行比较。通过优化单因素试验得到的DES法提取玫瑰多酚的最佳工艺条件:含水量30%的氯化胆碱-乳酸(摩尔比 1∶2)为最佳提取剂,料液比 1∶40(g/mL)、超声时间10 min、超声功率400 W、超声温度50℃、提取2次,所得多酚提取量为(136.20±1.23)mg/g。与乙醇提取法相比,DES法的多酚提取量提高了24%。表明超声辅助DES法是一种高效环保的玫瑰多酚提取方法。对纯化后的多酚进行体外抗氧化活性的测定,表明其具有良好的还原能力、DPPH自由基清除能力以及ABTS+自由基清除能力,具有较强的体外抗氧化活性。本研究为玫瑰多酚等活性物质的绿色提取提供了新思路,为其在天然抗氧化剂中的应用中提供了科学依据。
